Grande coquille bivalve de forme triangulaire, épaisse, lourde
Valves inéquilatérales plus longues (15 à 20 cm) que larges
4 à 6 côtes radiales basses et larges avec des écailles grandes et ondulées
Stries de croissance concentriques bien développées
Manteau et siphons colorés de couleur vive, tachetés sans iridescence
Siphon inhalant bordé de petits tentacules simples
Siphon exhalant arrondi légèrement proéminent
Encastré dans le récif
Bénitier allongé, tridacne allongé, tridacne mutique
en Polynésie française : Pahua et à Rapa : Pagii
Small giant clam, elongated clam, elongate clam, maxima clam (GB), Längliche Riesenmuschel, Kleine Riesenmuschel (D)
Basa, manlet, manlot, manlok, sali-ot, unay (Philippines), Katavatu (Fidji), Melibes, oruer duabeb (Palau), Shaza (Kenya)
Tridachnes maxima Röding, 1798
Tridacna (Chametrachea) maxima (Röding, 1798)
Tridacna imbricata (Röding, 1798)
Tridacna elongata Lamarck, 1819
Tridacna mutica Lamarck, 1819
Tridacna compressa Reeve, 1862
Tridacna rudis Reeve, 1862
Tridacna detruncata Bianconi, 1869
Tridacna lanceolata G. B. Sowerby II, 1884
Tridacna reevei Hidalgo, 1903
Tridacna acuticostata G. B. Sowerby III, 1912
Tridacna fossor Hedley, 1921
Tridacna maxima var. fossor Hedley, 1921
Tridacna troughtoni Iredale, 1927
Indo-Pacifique et mer Rouge
Zones DORIS : ● Indo-Pacifique, ○ [Mer Rouge]C’est l’espèce de bénitier la plus commune, elle a une très large distribution. T. maxima est présente du nord de la mer Rouge (golfe de Suez et golfe d’Eilat/Aqaba),), en englobant les récifs des océans Indien (dont les îles Éparses, Mayotte, La Réunion) jusqu'au Pacifique (dont la Nouvelle Calédonie, Wallis-et-Futuna et la Polynésie française). Elle était absente à Hawaï et est éteinte à Hong Kong. T. maxima a été introduite aux Caraïbes et à Hawaï (Wells 1997).
Tridacna maxima, comme les autres espèces de bénitiers, est toujours associée aux récifs coralliens. dont il partage les mêmes besoins, tels que la température et la lumière. Les bénitiers sont même plus exigeants pour leur dépendance vis à vis de la lumière. De ce fait, ils vivent moins profondément que ces derniers. T. maxima vit dans les zones peu profondes des récifs et des lagons, rarement au-delà de 10 m (maximum observé 21 m).
En Polynésie française, dans les zones de forte densité, cette espèce peut aller jusqu'à coloniser le sable.
T. maxima est l’une des trois espèces qui s’enfoncent dans le substrat*. Les juvéniles sont généralement entièrement encastrés dans le substrat récifal, mais les individus plus âgés finissent par sortir de la concavité et ne sont plus que partiellement encastrés.
La coquille bivalve de forme triangulaire, allongée, est épaisse et lourde. Elle mesure en général 15 à 20 cm dans sa plus grande dimension (mais elle peut atteindre 42 cm). Chaque valve*, inéquilatérale, porte 4 à 6 (généralement 5) côtes radiales basses mais larges, sur lesquelles on observe de nombreuses crêtes écailleuses (écailles ou scutelles*) (cf. le schéma) grandes et ondulées disposées de façon concentrique (les plus anciennes sont souvent usées donc seules celles présentes sur la partie supérieure sont visibles chez les individus adultes). Les stries de croissances concentriques sont bien développées.
Sur une coquille vide, la ligne de charnière représente environ un tiers de la longueur de la coquille. Le ligament* est externe. Près du sommet (ou crochet ou umbo*), une ouverture en forme de goutte correspond à l’orifice pour le passage du byssus*. Cet orifice est de taille variable, modérée à grande selon les individus.
L'extérieur de la coquille est généralement blanc cassé à crème parfois nuancé de jaune ; l'intérieur est blanc.
Chez l’animal vivant, quand la coquille est ouverte, entre les marges du manteau*, surdimensionné, qui recouvrent en général les bords de la coquille, on observe une vaste zone colorée. À environ un tiers d’une des extrémités de la coquille, on observe un orifice arrondi légèrement proéminent : il s’agit du siphon* exhalant*. De l’autre côté de la coquille, un orifice allongé bordé de petits tentacules* correspond au siphon inhalant*. Les siphons et le manteau sont richement tachetés, pigmentés souvent de couleur vive (bleu, vert, brun) mais ne sont pas iridescents avec à peine deux motifs identiques. Le long de la marge du manteau, des rangées d’ocelles* (ou organes hyalins*) sont disposés en rangées plus ou moins régulières et forment une ligne sombre presque continue sur le bord du manteau. Ils sont également dispersés de façon irrégulière sur le manteau.
L’identification des différentes espèces de bénitiers est délicate et difficile. Les motifs, les couleurs du manteau* varient considérablement d’un individu à l’autre pour la même espèce. Certaines combinaisons de couleurs et de motifs peuvent ressembler à celles d’une autre espèce.
En plongée, les individus vivants sont vus par dessus : la forme, le nombre de côtes et les marges de la coquille, sa symétrie, la présence d’écailles, les motifs et l’extension du manteau, la présence de tentacules* autour du siphon* inhalant*, la présence d'ocelles*, la profondeur et le fait que la coquille soit encastrée ou non dans le substrat* sont les seuls critères disponibles.
La coquille vide peut montrer une ouverture pour le passage du byssus*.
12 espèces de bénitiers sont décrites actuellement. Toutes ces espèces ont une distribution Indo-pacifique et vivent à faible profondeur dans les récifs coralliens ou à proximité. Certaines espèces sont plus répandues que d'autres. :
Quelques espèces sont capables de s'encastrer dans le substrat : T. maxima T. crocea et T. noae
Toutes ces espèces ont une distribution indopacifique et vivent à faible profondeur dans les récifs coralliens.
Tridacna maxima ressemble beaucoup à T. noae et T. elongatissima et peu moins à T. squamosa et T. squamosina.
T. maxima n’est jamais aussi profondément encastrée que T. crocea.
Par ordre d'importance de présence :
Tridacna squamosa Lamarck, 1819 : cette espèce est très commune (juste après T. maxima). La coquille peut mesurer jusqu’à 40 cm de longueur. Chaque valve est faiblement inéquilatérale et, contrairement à T. maxima, porte 4, 5 ou 6 grandes côtes radiales arrondies espacées. De nombreuses écailles espacées, grandes et épaisses, sont présentes sur les côtes. Les bords de la coquille sont fortement incurvés. L’ouverture pour le passage du byssus est très variable (étroite à modérée).
Les valves sont souvent colorées (jaune et rose-orange).
L’extension du manteau peut cacher la coquille et les écailles. Le siphon inhalant est bordé de tentacules nombreux et complexes. Le manteau de T. squamosa présente généralement des motifs tachetés dans des combinaisons de jaune, orange, bleu, vert et brun. Le manteau est lisse avec parfois quelques papilles.
Cette espèce est observée sur les récifs plats peu profonds jusqu'à une profondeur d'environ 20 m, voire jusqu’à 42 m dans les sites abrités. Elle peut être partiellement recouverte par la croissance du corail.
Elle est présente en mer Rouge, en Afrique de l'est, à Madagascar et aux Mascareignes et Chagos, jusqu'aux îles Tonga, Tuamotu et l’archipel des Gambier et du sud du Japon au Queensland (Australie), sauf aux îles Cocos (Keeling) et aux îles Mariannes du Nord où l'espèce est localement éteinte. Cette espèce a été introduite à Hawaï et à Guam..
Tridacna gigas (Linnaeus, 1758) : c’est le plus grand mollusque bivalve vivant (le plus grand spécimen mesurait 1,37 m de longueur et les 2 valves pesaient 230 kg). Les jeunes individus sont difficiles à distinguer des autres espèces de tridacnides, ils sont souvent confondus avec T. derasa. La coquille est épaisse et lourde, sans écailles. Chaque valve est légèrement inéquilatérale par rapport à son sommet, elle porte 4 à 5 côtes radiales. L’ouverture pour le passage du byssus est petite ou absente.
L’extension du manteau est variable, il peut rester juste sur le bord ou cacher complètement la coquille. Le manteau est généralement brun doré, jaune ou vert avec de nombreuses taches iridescentes bleues, violettes ou vertes, surtout sur les bords. Les plus grands individus peuvent avoir tellement de taches que le manteau semble bleu ou violet uni. Le siphon inhalant ne porte pas de tentacules.
La coquille ne peut pas se fermer complètement.
T. gigas vit à faible profondeur, voire dans des zones abritées de la zone de balancement des marées, et plutôt sur des récifs isolés en raison de sa surexploitation par l’homme. L’espèce T. gigas, en Nouvelle-Calédonie,
est présente à l'état de fossile, et est apparemment éteinte dans cette région.
T. gigas est présente de la mer Rouge jusqu’au Pacifique central en passant par l'Afrique de l'Est et les îles Éparses, la Nouvelle-Calédonie et la Polynésie française.
Tridacna derasa (Röding, 1798) : c’est la deuxième plus grande espèce puisque sa coquille peut atteindre jusqu’à 60 cm de longueur. Mais les coquilles sont plus allongées et étroites que celles de T. gigas. Les valves sont symétriques par rapport à leur sommet et portent 5 à 7 côtes radiales peu développées. En général, chaque valve porte peu d’écailles, voire de simples crêtes. L’ouverture pour le passage du byssus est étroite et petite.
L’extension du manteau est variable, à peine au-delà de la marge pour cacher la coquille. Le siphon inhalant est bordé de grands tentacules divisés. Cette espèce perd son byssus et peut donc être libre.
Elle peut être observée jusqu’à 20 m de profondeur.
Tridacna mbalavuana ressemble à T. derasa, mais se distingue par la présence de tubercules* à la surface de son manteau et de tentacules autour de l’orifice du siphon inhalant, une coquille plus mince et des taches colorées sur les côtes.
L'aire de répartition de Tridacna derasa est centrée sur le triangle de corail, elle est présente à l'ouest de cette zone jusqu'aux îles Cocos (mais pas dans l'Océan Indien à l'ouest des Cocos), en Nouvelle-Calédonie, au nord de cette zone jusqu'au sud du japon (archipel des Ryükyü) et à l'est jusqu'aux îles Tonga.
Tridacna noae (Röding, 1798) (= T. ningaloo). La coquille mesure entre 6 et 20 cm (voire jusqu’à 28 cm) de longueur. Les valves sont inéquilatérales avec 5 à 7 côtes radiales. Les écailles sont bien espacées. Cette espèce ressemble à T. maxima en apparence, mais se distingue par ses ocelles* peu nombreux et en lignes discontinues sur le bord du manteau et plus particulièrement par son ornementation de taches ovales (ou en forme de goutte d’eau) de différentes couleurs délimitées par des marges blanches le long du bord du manteau et par la présence de papilles sur le manteau.
Elle est observée de 1 à 15 m de profondeur, souvent encastrée dans les substrats récifaux qu'elle serait capable de creuser.
Longtemps confondue avec T. maxima mais généralement présente en plus faible abondance, sa distribution confirmée est parcellaire, elle doit être revue. Tridacna noae est documentée dans l'océan Indien en Afrique de l'est (Tanzanie) et dans l'ouest Pacifique au Japon (archipel des Ryükyü) et à Taïwan, ainsi qu'au Vanuatu.
Tridacna crocea Lamarck, 1819 : c’est l’espèce la plus petite des bénitiers, elle est morphologiquement très proche de T. maxima et de T. squamosa mais la longueur de la coquille est de 10 cm (rarement jusqu’à 15 cm). Chaque valve est modérément inéquilatérale et modérément allongée. Elle porte 5 à 6 (parfois jusqu'à 10 avec 4 ou 5 côtes moins prononcées) côtes radiales basses avec de nombreuses écailles fines, petites très rapprochées les unes des autres, mais souvent érodées sauf celles près de la marge de la coquille. L’ouverture pour le passage du byssus est grande (un tiers de la longueur de la coquille).
L’extension du manteau peut cacher la coquille et les écailles. Le manteau est très richement pigmenté (habituellement bleu ou vert iridescent avec des mélanges de nombreuses autres couleurs comme du violet, ou de l'orange). Il présente des motifs variés, des rayures, des vagues, des taches et des anneaux. Le siphon inhalant est bordé de nombreux petits tentacules simples.
La coquille est blanc-grisâtre parfois teintée de jaune, d'orange. Parfois une bande colorée est présente sur le bord supérieur de la coquille et sur sa surface intérieure.
Cette espèce peut être complètement encastrée dans le corail. Seuls les bords des valves peuvent affleurer la surface.
Elle semble supporter des eaux saumâtres et même l'émersion car elle vit dans la zone de balancement des marées et à faible profondeur (10 m maximum). De fortes densités ont été observées : 100 à 200 individus par m².
Elle est présente en Afrique de l'est, à
Madagascar, dans les Mascareignes et dans le triangle de corail, du Japon à
l’Australie et des îles Andaman (océan Indien) jusqu'au Vanuatu.
Hippopus hippopus (Linnaeus, 1758) : cette espèce mesure jusqu’à 40 cm de longueur (voire 50 cm). Les valves épaisses, étroitement imbriquées, sont inéquilatérales (parfois une valve est plus creuse que l'autre). Elles portent 7 à 8 côtes radiales sans écailles avec des taches brunâtres ou rougeâtres. L’orifice pour le passage du byssus est étroit et disparaît chez l’adulte.
Le manteau brunâtre ou vert-olive avec des motifs marbrés ne s’étend pas au-delà des bords de la coquille. Il ne porte pas d’ocelles et le siphon inhalant ne possède pas de tentacules. Cette espèce perd rapidement son byssus et, de ce fait, peut être trouvée sur des fonds sableux ou d’herbiers peu profonds (jusqu’à 10 m de profondeur). Elle peut se déplacer en roulant par des contractions du muscle adducteur*
Elle est présente du sud du Japon au nord-est de l’Australie et de l’Indonésie aux îles Tonga.
Tridacna mbalavuana Ladd, 1934 (= T. tevoroa) : cette espèce rare peut atteindre 50 cm de longueur (voire 56 cm). Elle présente seulement de faibles sculptures sur la coquille. Les valves inéquilatérales, avec une extrémité pointue, sont fines et portent des taches colorées sur les côtés. Les valves portent 6 à 7 côtes radiales basses et larges, peu marquées à la marge arrondie. Seuls les jeunes individus portent des écailles en forme de pétale. L'ouverture pour le passage du byssus est réduite. Cette espèce est proche de T. derasa.
Le manteau gris-brunâtre, sans marques colorées, porte de grands tubercules*. Il dépasse de très peu le bord de la coquille. Celle-ci peut s'ouvrir largement. Le manteau est dépourvu d'ocelles. Le siphon inhalant est toujours entouré de tentacules proéminents généralement blancs. Cette espèce possède peu d'iridophores* (voir la rubrique "informations complémentaires").
La coquille est blanc-grisâtre avec souvent des taches rouges vers les sommets, souvent masquées par des algues calcaires et des éponges.
Tridacna mbalavuana vit plus profondément que les autres espèces ( - 20m, - 30 m).
Sa distribution serait limitée aux îles Fidji et Tonga, aux îles Loyauté, en Nouvelle-Calédonie (côte est de la Grande Terre) et à la frange extérieure de la grande barrière de corail (Australie).
Tridacna elongatissima Bianconi, 1856. La coquille, allongée, lourde presque triangulaire peut mesurer jusqu’à 34 cm de longueur. Les valves inéquilatérales portent 6 à 7 côtes radiales avec des écailles circulaires assez grandes et rapprochées plutôt limitées aux sommets. L’orifice pour le passage du byssus est large. L’extérieur de la coquille est blanc-grisâtre ou jaune et l’intérieur blanc porcelané.
Le manteau est vert à brun.
Cette espèce est présente jusqu’à 12 m de profondeur seulement dans l’ouest de l’océan Indien (île de la Réunion, mais rare à l’île Maurice et apparemment absente à l’île Rodrigues et à Mayotte). Elle a été confondue avec T. maxima avec laquelle elle vit.
Tridacna squamosina Sturany, 1899, (= T. costata, T. elonga) : cette espèce ressemble à T. maxima et T. squamosa. La coquille peut mesurer jusqu’à 32 cm de longueur. Les valves sont inéquilatérales avec 5 à 7 côtes radiales pointues à leur extrémité. Les écailles sont bien espacées près des sommets et serrées sur les bords. Les deux valves fermées laissent un espace. Le byssus est développé, l'ouverture pour son passage est moyenne.
Le manteau est très variable avec une large gamme de couleurs et de motifs et est couvert de petites papilles* en forme de boutons. Le siphon inhalant est bordé par des tentacules.
Tridacna squamosina vit vers 5 m de profondeur dans les zones récifales et les herbiers uniquement en mer Rouge.
Cette espèce a été surpêchée lors des premières occupations humaines de la région (grand nombre de coquilles subfossiles, -125 000 ans).
Tridacna rosewateri Sirenko & Scarlato, 1991 (= T. lorenzi). La coquille de 6 à 19 cm de longueur (jusqu’à 26 cm) est plus fine que celle de T. squamosa,, et de T. maxima avec des prolongements des côtes plus développés. Les valves sont faiblement inéquilatérales et portent 4 à 5 côtes radiales arrondies. Les écailles sont plus grandes et éparses. L’orifice pour le passage du byssus est assez large. L'intérieur des valves est blanc porcelané.
Cette espèce est présente parmi des coraux clairsemés dans les herbiers à Thalassodendron ciliatum au nord-est de l’île Maurice.
Hippopus porcellanus Rosewater, 1982 : cette espèce, rare, possède une coquille plus lisse et plus fine que celle de H. hippopus. Elle mesure souvent moins de 40 cm de longueur. L’orifice pour le passage du byssus est étroit. Elle peut être confondue avec T. derasa mais le manteau est généralement gris ou brun, dépourvu d’ocelles, il ne s’étend pas au-delà des bords de la coquille. Le siphon inhalant possède des grands tentacules.
Cette espèce vit dans la zone de balancement des marées ainsi que peu profondément le long des bords des lagons. Sa distribution est restreinte aux Philippines, à l’Indonésie et à la Papouasie-Nouvelle-Guinée.
Au cours des quinze dernières années, trois espèces ont été redécouvertes grâce aux outils moléculaires : T. squamosina, T. noae et T. elongatissima, toutes les trois morphologiquement proches d'autres espèces avec lesquelles elles avaient été mises en synonymies : dans ce cas on parle d'espèces cryptiques*. Ce phénomène est assez commun chez les invertébrés marins et il existe peut-être encore d'autres espèces non décrites ou cryptiques.
Nicaisolopha tridacnaeformis (L.R. Fox, 1927). C’est une huître (famille des Ostreidés) dont les valves ressemblent un peu à celles des bénitiers. Cette espèce vit dans l'océan Pacifique.
Les bénitiers sont proches des Cardiidés (comme les coques communes par exemple). Les coques sont des filtreurs*. Les bénitiers, comme T. maxima, ont, quant à eux, une alimentation particulière. Le manteau* de ces mollusques contient de très grandes quantités de petites algues unicellulaires, les zooxanthelles* (Gymnodinum microadriaticum). Celles-ci sont des dinoflagellés symbiotiques*. Les bénitiers, comme les coraux des récifs coralliens, se nourrissent des produits de la photosynthèse* de ces algues et de la digestion de ces dernières. C’est la présence de ces algues symbiotiques qui est à l’origine de la distribution des bénitiers dans des eaux claires et à faible profondeur, afin de permettre la photosynthèse. Ces zooxanthelles sont logées dans une structure ramifiée (le système tubulaire à zooxanthelles) qui communique avec l’estomac de l’animal.
Les énormes populations de T. maxima que l'on trouve dans les atolls fermés où il n'y a pas de phytoplancton* provenant des eaux environnantes sont la meilleure preuve actuelle de l'importance des zooxanthelles symbiotiques comme nourriture pour l'animal.
L’étude des fèces* de Tridacna maxima a montré que le bénitier filtre du zooplancton et d’autres particules mais ne les assimile pas. L’animal rejette des protéines issues des zooxanthelles dans le milieu extérieur mélangées à des zooxanthelles non digérées. Ces fèces enrichissent l’eau de mer pour d’autres organismes (Ricart et Salvat, 1977).
D’autres organismes exploitent les produits de la photosynthèse d’algues symbiotes : une coque tropicale Corculum cardissa (bucarde cœur de vénus), des éolidiens comme la limace à bigoudis (Spurilla neapolitana), des sacoglosses comme certaines élysies (Elysia viridis), des gorgones, des hydraires, des méduses (comme Cassiopea andromeda) et bien entendu les madréporaires des récifs coralliens.
Les bénitiers sont des hermaphrodites* protandres*. La partie mâle de la gonade* se développe en premier, puis la partie femelle. Les cellules sexuelles (spermatozoîdes* et ovules*) mûrissent presque simultanément et sont libérées dans l’eau. La synchronisation de la libération de ces cellules est assurée par l’émission d’une substance induisant cette libération (une phéromone*). Elle est détectée par des chimiorécepteurs du siphon* inhalant. L’animal va alors se gonfler d’eau, fermer son siphon inhalant puis en contractant son muscle adducteur* qui va fermer la coquille il va expulser l’eau et les cellules sexuelles par le siphon exhalant.. Les spermatozoïdes sont émis en premier, ensuite les ovules (environ 100 µm de diamètre). L’autofécondation n’est pas possible. La fécondation a lieu en plein eau.
Chaque œuf (114 µm de diamètre) se développe, en environ 12 heures, en une larve* trochophore*. Celle-ci commence à produire une coquille de carbonate de calcium. Après deux jours, la larve* mesure 160 µm et devient une larve véligère*. Elle développe ensuite un pied. Après dix jours de vie planctonique, la larve rejoint le fond et peut se déplacer grâce à son pied puis elle se métamorphose* en un bénitier juvénile.
Le jeune tridacne ne possède pas encore de zooxanthelles*, il se nourrit de plancton*. Ce n’est qu’après une vingtaine de jours qu’il capture les zooxanthelles présentes dans la colonne d'eau.
La durée de vie des petites et moyennes espèces de bénitiers serait de 10 à 50 ans.
Cette espèce est capable de s'hybrider avec Tridacna squamosa, ce qui est à l'origine de morphologies intermédiaires.
En plus des zooxanthelles* contenues dans leurs tissus, les Tridacnidés servent d'hôtes à un grand nombre d'organismes qui vivent sur la surface des valves (épibiontes*), s'enfouissent dans l’épaisseur de la coquille ou encore habitent la cavité du manteau (commensaux*, ectoparasites* et endoparasites).
Parmi les épibiontes, certaines algues encroûtantes ou non, des éponges, des anémones, des ascidies, des bryozoaires et des vers tubulaires peuvent parfois encrasser la coquille et nuire à la croissance du bénitier.
Certains organismes associés même forent la coquille comme des éponges, des mollusques bivalves (Lithophaga et Gastrochaena), des annélides polychètes (Oenone fulgida), etc...
D’autres organismes commensaux vivent dans les cavités du manteau comme plusieurs espèces de crevettes Pontoniinidées, des crabes Pinnothéridés, voire des petits poissons de récifs (comme Encheliophis homei) et même des poissons vivant habituellement au sein des anémones si celles-ci font défaut.
Différents parasites sont également présents comme des copépodes cyclopoïdes (Anthessius, Lichomolgus), et des gastéropodes Pyramidellidés
Pour en savoir plus vous pouvez consulter l’article de Neo et al. 2015.
Les atolls des Tuamotu orientaux en Polynésie française étaient caractérisés par des densités naturelles de Tridacna maxima allant jusqu'à 500 par m² au début des années 2000.
Les populations des atolls de T. maxima en Polynésie française sont capables de produire 23 à 37 t /ha/an et sont si denses qu'elles créent de petites îles appelées mapiko (Gilbert et al., 2006).
Certains auteurs considèrent les Tridacninés comme des espèces ingénieures* car elles jouent de nombreux rôles écologiques sur les récifs coralliens (Neo et al. 2015.)
Chez un bivalve typique comme la coque (proche des bénitiers), les siphons* inhalant et exhalant sont situés à l’arrière de l’animal, les sommets de la coquille sont en haut et le pied en bas. Ce pied peut sortir entre les bords libres des deux valves de la coquille.
Un bénitier comme T. maxima présente une organisation originale. Comme il doit permettre à la lumière d’éclairer les zooxanthelles*, il faut que les tissus contenant ces algues puissent être exposés à la lumière solaire. La charnière de la coquille est déplacée vers le bas près de l’ouverture par laquelle sortent les fils du byssus* (l’animal a subi une rotation de 180 ° dans sa coquille).
Les tissus contenant les zooxanthelles sont largement hypertrophiés et s’étendent sur toute la longueur de la surface supérieure, couvrant l’ouverture entre les bords des deux valves afin d’offrir une grande surface d’exposition à la lumière solaire. Du fait de ces modifications, l’un des deux muscles adducteurs* a disparu (l’adducteur antérieur). Ainsi les bénitiers sont des monomyaires (un seul muscle adducteur) comme les huîtres et les coquilles Saint-Jacques mais pour des raisons différentes.
Ces profondes modifications de l’anatomie des bénitiers se sont effectuées au cours des temps géologiques.
Ainsi la partie dorsale habituelle de la coquille est devenue partie ventrale et vice versa de telle sorte que l‘« orientation » d’une valve de bénitier est très particulière.
Comment déterminer chez les bénitiers les valves droite et gauche? Il faut tenir un individu valves accolées l’une contre l’autre en plaçant le sommet et l’échancrure où passe le byssus en position inférieure et le sommet du côté opposé à l’observateur. La coquille ainsi disposée, on a face à soi les bordures ondulantes des deux valves qui représentent la bordure dorsale, la valve qui est à droite est la valve droite, celle qui est à gauche est la valve gauche (Salvat, Rives 1975).
T. maxima comme T. crocea et T. noae sont des espèces qui creuseraient le substrat. Ces espèces sont fixées au substrat* par leur byssus (les filaments du byssus sont secrétés par des glandes du pied). Par un broyage, assuré par les contractions des muscles du pied et des mouvements de la coquille et certainement par une action chimique (agents chélatants), ces bénitiers parviennent à s’enfoncer dans le substrat.
Les Tridacnidés semblent s'être séparés des autres Cardiacés vers le début du Cénozoïque (l’ère tertiaire) occupant peut-être la niche laissée vacante par l'extinction, il y a 66 millions d'années, des bivalves rudistes (comme les Hippurites). Le genre Tridacna est apparu au cours de l’Yprésien (soit il y a 56 à 47 Millions d'années).
La sous-famille des Tridacnes (les Tridacninés) comprend deux genres :
La lumière du soleil est bien sûr essentielle à l'activité photosynthétique* des zooxanthelles* abritées dans le manteau*, mais elle est potentiellement dangereuse pour le bénitier. Le risque d'exposition à des longueurs d'onde nocives a été surmonté par la production d'une pigmentation protectrice. Ces pigments sont contenus dans des cellules appelées iridophores* dans les tissus exposés. Ces cellules pigmentaires contiennent des empilements de minuscules plaquettes qui ont plusieurs fonctions. Ici, elles réfléchissent la lumière pour protéger les tissus de l'animal et génèrent ainsi des couleurs par diffraction de la lumière. C’est le même effet qui est observé sur la coquille d’autres mollusques, les plumes de certains oiseaux et les ailes de certains papillons. Ces iridophores sont donc à l’origine de la gamme de couleurs allant du bleu au vert ou du brun au jaune, ils donnent lieu à une variété presque infinie de motifs qui sont les plus vifs chez les plus petites espèces.
Sur la marge du manteau, de très nombreux (milliers) d'ocelles sont présentes. Ces yeux simples, disposés près des marges du manteau mais également dispersés de façon irrégulière sur l'ensemble du manteau, permettent une perception visuelle en mosaïque. Chez les autres espèces proches (comme les coques), ces ocelles sont disposés autour des siphons*.
Les ocelles des bénitiers permettent de détecter un danger. Cette détection va entraîner le retrait des lobes* du manteau entre les valves de la coquille et la fermeture au moins partielle de cette dernière. Ce comportement de défense est également à l’origine d’un puissant jet d’eau de mer par le siphon exhalant. Cette réaction est une réponse à la présence de poissons qui peuvent grignoter ce manteau.
De nombreux prédateurs peuvent s’attaquer aux bénitiers.
Les juvéniles sont attaqués par des crabes et certains poissons comme le Pseudobalistes flavimarginatus qui peuvent écraser les valves de la coquille, ou des gastéropodes perceurs (Fasciolaridés, Muricidés) et des astéries.
Les marques de dents sur les surfaces extérieures de la coquille indiquent des attaques par des poissons de récif comme les poissons-perroquets et des entailles sur les marges du manteau par les poissons-chirurgiens.
Pour les individus plus âgés, les prédateurs potentiels comprennent des raies aigles Myliobatidés comme Aetobatis narnari , les tortues Caretta caretta, Chelonia mydas et certains grands poissons, mais leur impact diminue à mesure que les bénitiers grandissent (Adams et al. 1988).
T. maxima est de plus en plus extrait pour la consommation locale et est susceptible de devenir une cible plus importante pour les pêcheries à l'avenir. L'abondance de T. maxima est plus élevée sur les sites éloignés des zones à forte densité de population humaine. Ce sont les muscles adducteurs* qui sont consommés et très appréciés.
En raison des motifs de son manteau aux couleurs attrayantes, T. maxima est, avec T. crocea, l'espèce la plus recherchée pour le commerce de l'aquariophilie.
Suite à l'interdiction actuelle des exportations d'individus capturés à l'état sauvage pour la plupart des pays de son aire de répartition, la majorité des individus qui entrent dans le commerce aquariophile sont d'origine cultivés.
Bien que l'espèce soit élevée principalement pour le commerce des aquariums, le repeuplement des récifs a tiré bénéfice, partout où existent des structures aquacoles
Le réchauffement climatique a également des effets indésirables, comme une surmortalité, sur les populations de bénitiers.
Cette espèce est protégée (liste rouge de l'UICN* et CITES), elle est classée dans la catégorie "risque faible/dépendant de la conservation". La commercialisation de spécimens prélevés dans la nature est interdite et seuls des juvéniles issus de reproduction en aquarium sont tolérés à la vente.
Bénitier : depuis la Renaissance, le recours au tridacne comme bénitier est devenu traditionnel pour contenir de l'eau bénite à l'entrée des églises catholiques et de ce fait, a donné au « tridacne » son nom usuel de « bénitier ». Toutefois, ce sont surtout les valves de Tridacna gigas qui sont utilisées. Le mot «Bénitier» vient de l’ancien français benoitier puis benestier issu de eau benoitier lui-même dérivé de l’ancien français ewe benëeite, benëoite.
commun : c'est l'espèce de bénitier qui a la plus vaste répartition.
Tridacna : le zoologiste et médecin français Jean Guillaume Bruguière (1750-1798) ne donne pas d'explication. Ce nom de genre latin vient du grec [tridakna], [tri] = trois et [dakn] = mordre, Cailleux et Komorn (1981) traduisent ce mot par "qu'il faut mordre trois fois ". On trouve également "dont on fait trois bouchées". Tridacna a été utilisé par le scientifique romain Pline l'ancien (23-79) pour des coquillages de très grande taille (comme des huîtres par exemple). Un des noms espagnols de la grande nacre est : tridacna.
maxima : du latin [maxim-] = le plus grand ou très grand. Il y a certainement eu une confusion lors de la description des espèces car ce bénitier n’est pas le plus grand. Le plus grand est le Tridacna gigas.
Numéro d'entrée WoRMS : 207675
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Bivalvia / Lamellibranchia / Pelecypoda | Bivalves / Lamellibranches / Pélécypodes | Mollusques aquatiques, filtreurs, au corps comprimé latéralement. Coquille composée de 2 valves articulées disposées de part et d’autre du plan de symétrie. Absence de tête, de pharynx, de radula et de glande salivaire. |
| Sous-classe | Autobranchia | Autobranches | |
| Infra-classe | Heteroconchia | Hétéroconchie | |
| Subter-classe | Euheterodonta | Euhétérodonte | |
| Super ordre | Imparidentia | Imparidenties | |
| Ordre | Cardiida | Cardiides | |
| Super-famille | Cardioidea | ||
| Famille | Cardiidae | Cardiidés | Coquille fermée en forme de cœur. Côtes radiales fortes avec parfois présence de longs tubercules. Bord des valves crénelé. |
| Sous-famille | Tridacninae | Tridacninés | |
| Genre | Tridacna | ||
| Espèce | maxima |
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Coquille épaisse et ondulée
A droite le long siphon inhalant finement crénelé et à gauche le siphon exhalant tubulaire.
Tridacna maxima est de loin l'espèce la plus commune dans l'océan Indien.
Barrière est, Mayotte (976), 1 m
04/11/2017
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Manteau de couleur variable
Seul le bord du manteau (de couleurs différentes) des ces deux individus encastrés dans le corail est visible.
La Réunion (974), 1 m
10/12/2014
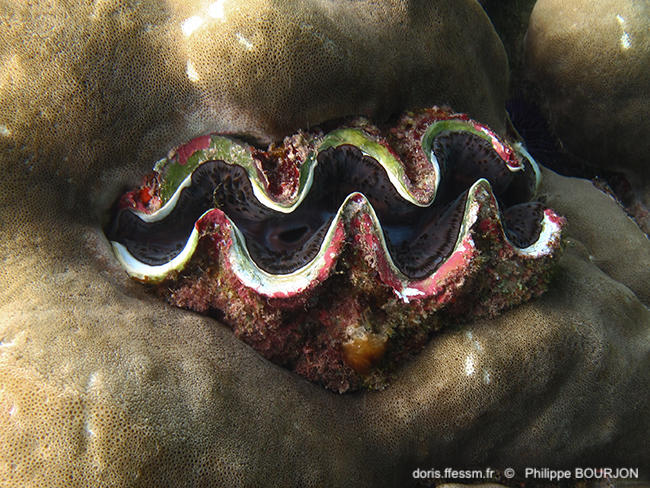
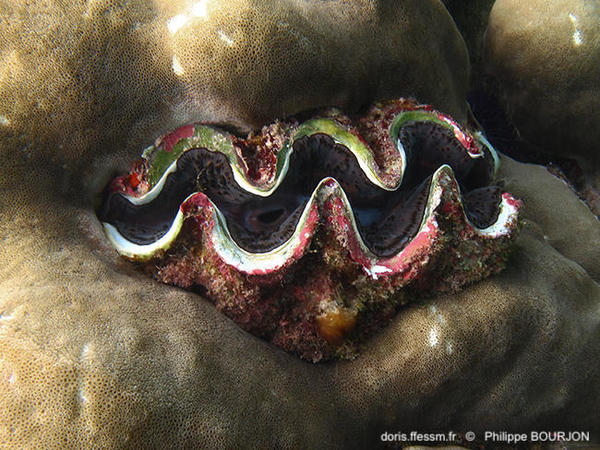
Bénitier enchâssé dans le corail
Ce bénitier est encastré dans le corail. La coquille est couverte d'épibiontes.
La Réunion (974), 1 m
10/12/2014


En mer Rouge
Bénitier commun à faible profondeur en mer Rouge. Celui-ci offre de belles couleurs du manteau et on voit bien le fort relief de la coquille.
Safaga, Egypte, 4 m
26/02/2019


Gros plan sur le siphon inhalant
Ce siphon inhalant est bordé de petits tentacules sensoriels.
Mayotte, barrière est, 1 m
04/11/2017


Manteau tacheté
Les lèvres charnues du manteau sont exposées à la lumière solaire.
Îlot Bandrélé, Mayotte (976), 5 m
25/02/2018


Bénitier commun à Tahiti
Le bénitier commun est le Tridacnidé ayant la plus grande aire de répartition, de la mer Rouge et l'Afrique de l'est à la Polynésie, et du sud du Japon jusqu'à la grande barrière de corail en Australie. C'est avec, bien que rare, T. squamosa, les deux espèces présentes en Polynésie française.
Lagon de Pirae, Tahiti, 2 m
05/02/2004


Dans le lagon calédonien
Sept des douze espèces de Tridactinidés appartenant à deux genres différents sont présentes en Nouvelle-Calédonie : Tridacna crocea, T. maxima, T. squamosa, T. derasa, T. mbalavuana, T. noae et Hippopus hippopus. T.gigas est présente à l'état de fossile, et est apparemment éteinte en Nouvelle-Calédonie.
Il s'agit, ici, de T. maxima.
Ilot Signal, Nouvelle-Calédonie, 5 m
20/12/2012
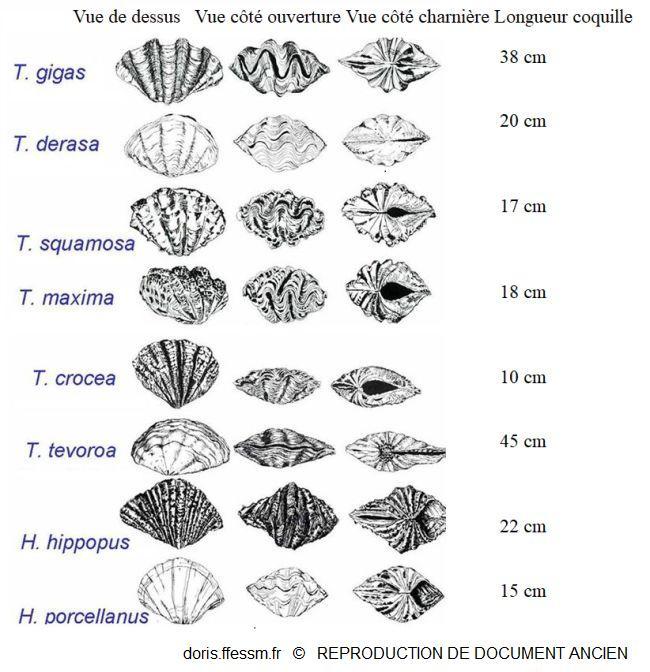
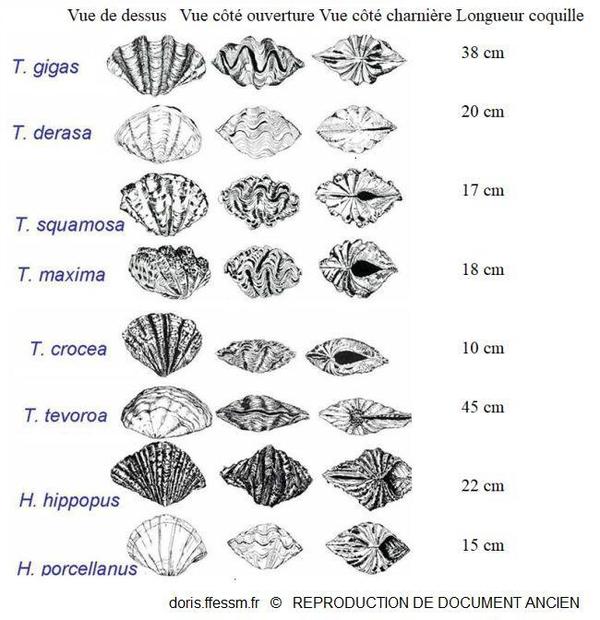
Quelques espèces de bénitiers
T. tevoroa = T. mbalavuana.
Sur cette planche, T. noae, T. elongatissima, T. squamosina et T. rosewateri ne sont pas représentés.
D’après les planches 13 (page 19) et 14 (page 20) de Norton et Jones, 1992
Reproduction de documents anciens
1992
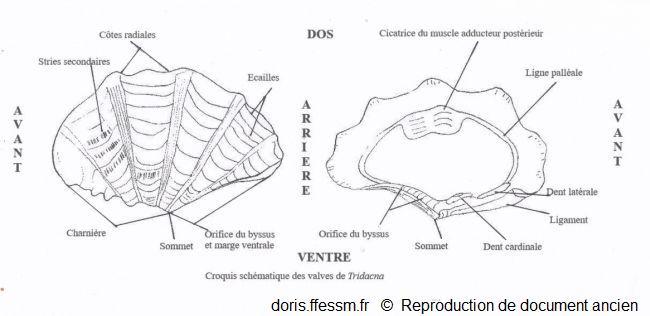
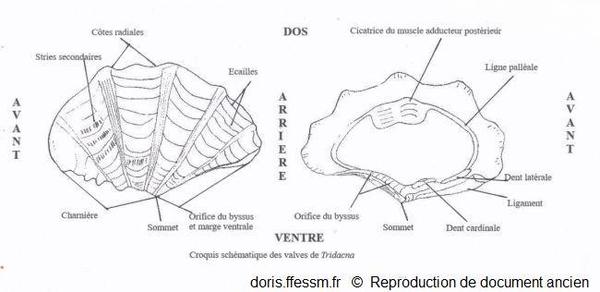
Schéma des valves de Tridacna
Ce schéma présente quelques caractéristiques des coquilles des bénitiers.
Schéma modifié d'après la planche 266 page 350 de Rosewater 1965
Reproduction de documents anciens
1965
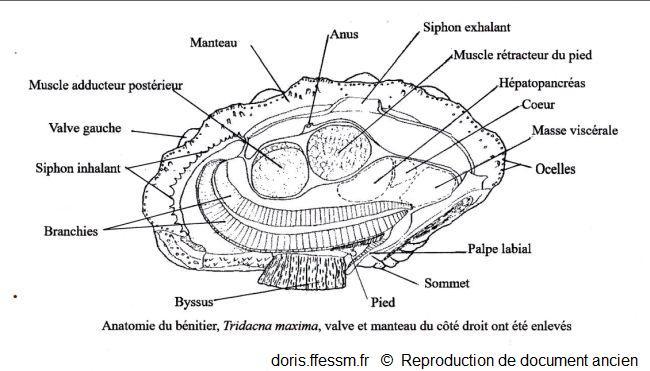
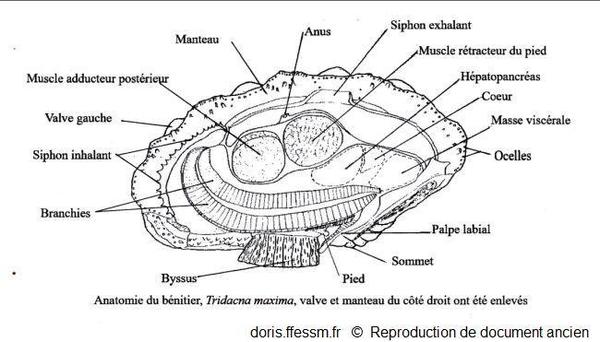
La valve et le manteau du côté droit ont été enlevés.
Schéma modifié d'après la planche 269 (page 352) de Rosewater, 1965
Reproduction de documents anciens
1965
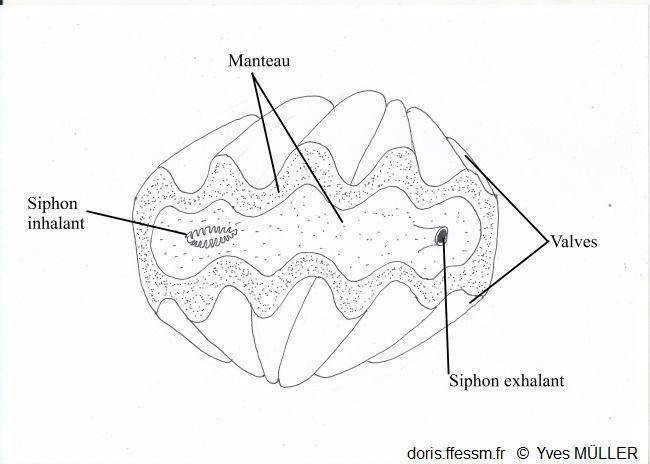
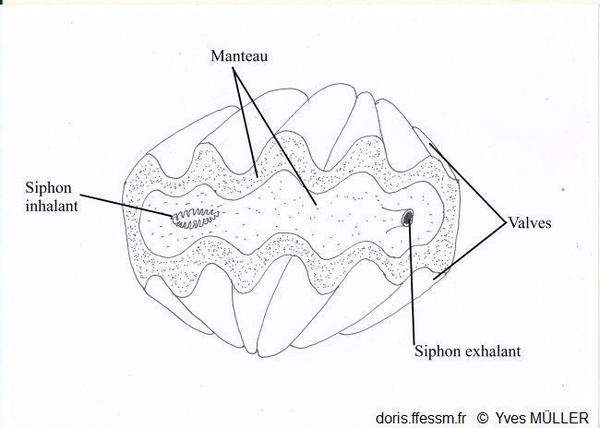
Un bénitier vivant vu de dessus
Le manteau et les siphons vus par-dessus.
Dessin
03/02/2023

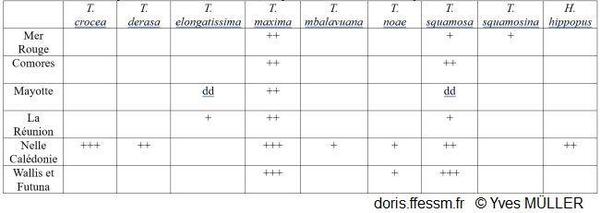
Distribution des bénitiers dans les domaines géographiques utilisés dans DORIS
+++ = abondant, ++ = fréquent, + = rare, dd = données déficientes.
D’après Neo & al 2017 et Fauvelot C (com. pers).
21/11/2023
Rédacteur principal : Yves MÜLLER
Vérificateur : Cécile FAUVELOT
Responsable régional : Yves MÜLLER
Fankboner P. V. 1981, On the siphonal eyes of giant clams (Bivalvia, Tridacnidae) and their relationship to adjacent zooxanthellae, The Veliger, 23, 245-249.
Fatherree J.W., 2002, Identifying the Tridacnid clams, Reefkeeping, 7.
Fatherreee J.W., 2007, A close-up look at tridacna crocea, Reefkeeping, 10.
Fatherreee J.W., 2015, On the Giant Clams Tridacna mbalavuana and T. squamosina, Advanced Aquarist, 3.
Fatherree J.W., 2016, On the Giant Clams : Tridacna noae and Tridacna ningaloo, Advanced Aquarist,1.
Fauvelot C., Zucco D., Borsa P., Grulois D., Magalon H., Riquet F., Andréfouët S., Berumen M.L, Sinclair-Taylor T.H., Gélin P., Behivoke F., ter Poorten J.J., Strong E.E., Bouchet P., 2020, Phylogeographical patterns and a cryptic species provide new insights into Western Indian Ocean giant clams phylogenetic relationships and colonization history, Journal of Biogeography, 47, 1086-1105.
Huelsken T., Keyse J., Liggins L., Penny S., Treml E.A., Riginos C., 2013, A novel widespread cryptic species and phylogeographic patterns within several giant clam species (Cardiidae: Tridacna) from the Indo-Pacific Ocean, PLoS ONE 8, e80858.
Jameson S.C., 1976, Early life of the giant clam Tridacna crocea Lamarck, Tridacna maxima (Röding), and Hippopus hippopus (Linnaeus), Pacific Science, 30, 219–233.
Jantzen C., Wild C., El-Zibdah M., Roa-Quiaoit H.A., Haacke C., Richter C., 2008, Photosynthetic performance of giant clams, Tridacna maxima and T. squamosa, Red Sea, Marine Biology, 155, 211–221.
Jeffrey S.W., Haxo F.T., 1968, Photosynthetic pigments of symbiotic dinoflagellates (Zooxanthellae) from corals and clams, Biological Bulletin, 135(1), 149–165.
LaBarbera M., 1975, Larval and post-larval development of the giant clams Tridacna maxima and Tridacna squamosa (Bivalvia : Tridacnidae), Malacologia, 15(1), 69-79.
Ladd, H. S., 1934, Geology of Viti Levu, Fiji. Bulletin of the Bernice P. Bishop Museum, 119, 1-263.
Land M.F., 2003,The spatial resolution of the pinhole eyes of giant clams (Tridacna maxima), Proceedings of the Royal Society of London, B: Biological Sciences,185-188.
Mekawy M.S., Madkour H.A., 2012, Studies on the Indo-Pacific Tridacnidae (Tridacna maxima) from the Northern Red Sea, Egypt, International Journal of Geosciences, 3, 1089–1095.
McCoy D.E., Burns D.H., Klopfer E., Herndon L.K., Ogunlade B., Dionne J.A., Joohnsen S., 2024, Heart cockle shells transmit sunlight to photosymbiotic algae using bundled fiber optic cables and condensing lenses, Nature Communications, 15, 9445, 1-13
Neo M.L. , Eckman W., Vicentuan K., Teo S.L.M., Todd P.A., 2015, The ecological significance of giant clams in coral reef ecosystems, Biological Conservation, 181, 111-123.
Neo M.L., Wabnitz C.C.C., Braley R.D., Heslinga G.A., Fauvelot C., Wynsberge S. van, Andréfouët S., Waters C., Tan A. S-H.,Gomez E.D., Costello M.J., Todd P.A., 2017, Giant clams (Bivalvia: Cardiidae: Tridacninae): a comprehensive update of species and their distribution, current threats and conservation status. Chapter 4 Oceanography and marine Biology, An Annual Review, volume 55 in Hawkins S.J., Evans A.J., Dale A.C., Firth L.B., Hughes D.J., Smith J.P., 302p.
Norton J. H., Shepherd M. A., Long H. M., Fitt W. K., 1992, The Zooxanthellal Tubular System in the Giant Clam, The Biological Bulletin,183(3), 503-506.
Othman A.S.bin, Goh G.H.S., Todd P.A., 2010, The distribution and status of giant clams (family Tridacnidae) – a short review, The Raffles Bulletin of Zoology, 58(1), 103-111.
Ricard M., Salvat B., 1977, Faeces of Tridacna maxima (Mollusca: Bivalvia), composition and coral reef importance. In Proceedings of the Third International Coral Reef Symposium, 1, Biology, D.L.Taylor (ed.). Miami, Florida: Rosenstiel School of Marine and Atmospheric Science, 495–501.
Rosewater J., 1965, The family Tridacnidae in the Indo-Pacific, Indo-Pacific Mollusca, 1(6), 347-396.
Sirenko B. I, Scarlato O. A., 1991, Tridacna rosewateri sp. n. Una nuova specie di Tridacna dall'Oceano Indiano. A new species of giant clam from Indian Ocean, La Conchiglia, 22(261), 4-9.
Stasek C.R., 1965, Behavioural adaptation of the giant clam Tridacna maxima to the presence of grazing fishes, The Veliger, 8, 29–35.
Sturany R., 1901, Expedition S.M. Schiff “Pola” in das Rothe Meer, nördliche und südliche Hälfte. 1895/96 – 1897/98, Zoologische Ergebnisse XIV. Lamellibranchiaten des Rothen Meeres, Denkschriften der Kaiserlichen Akademie der Wissenschaften, Mathematisch-Naturwissenschaftliche Classe, 69, 255–295, pl. 1-7.
Soo P., Todd P.A., 2014, The behaviour of giant, (Bivalvia: Cardiidae:Tridacninae), Marine Biology, 161, 2699-2717.
Su PW, Zhang GL, Chen B, Soong K, Liu LL., 2021, Reproduction and early juvenile growth of the giant clams Tridacna noae and Tridacna maxima in Taiwan, Zoological Studies, 60, 49.
Tan E.Y.W., Quek Z.R., Neo M.L., Fauvelot C., Huang D., 2022, Genome skimming resolves the giant clam (Bivalvia: Cardiidae: Tridacninae) tree of life, Coral Reefs, 41, 497-510.
Vaillant L., 1868, Recherches sur la famille des Tridacnides, Annales Sciences naturelles Zoologie, (5), IV, 65+172, pls viii-xii,
Van Wynsberge S., Andréfouët S., Gaertner-Mazouni N., Wabnitz C.C.C., Menoud M., Le Moullac G., Levy P., Gilbert A. Remoissenet G., 2017, Growth, survival and reproduction of the giant clam Tridacna maxima (Röding 1798, Bivalvia) in two contrasting lagoons in French Polynesia, PLoS ONE 12, e0170565. doi:101317/journal.pone.0170565.
Wilkens L.A., 1986, The visual system of the giant clam Tridacna :Behavioral adaptations, Biological Bulletin, 170, 393-408.
Yonge C.M., 1936, Mode of life, feeding, digestion and symbiosis with zooxanthellae in the Tridacnidae, Sci. Rep. Gr. Barrier Reef Exped. Br. Mus., 1, 283–321.
Yonge C.M., 1975, Giant clams, Scientific American, 232(4), 96-105.
Yonge C.M., 1982, Functional morphology and evolution in the Tridacnidae (Mollusca: Bivalvia: Cardiacea). Records of the Australian Museum, 33(17), 735–777.
La page de Tridacna maxima dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.