Organisme microscopique unicellulaire eucaryote de couleur jaune ou brunâtre
Cellule sphérique voire ellipsoïdale de 5 à 13 µm de diamètre, à la surface lisse et dépourvue de flagelle
Majoritairement vit en symbiose au sein d'autres organismes
Dans les cellules de l’endoderme de certains cnidaires
Dans une structure tubulaire ramifiée chez les bénitiers
Xanthelle, chlorelle, cyanelle
Zooxanthella (GB), Zooxantelle (I), Zooxantela (E), Zooxanthellen (D), Zoöxanthellen (NL), Zooxantela (P)
Symbiodinium Gert Hansen & Daugbjerg, 2009
Symbionte* cosmopolite
Zones DORIS : ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ● Atlantique Nord-Ouest, ○ [Méditerranée française], ○ [Mer Rouge], ● Indo-PacifiqueCertaines espèces peuvent avoir une répartition géographique mondiale.
Les zooxanthelles sont en symbiose* avec de nombreux organismes aquatiques : des cnidaires (coraux de récif, anémones de mer, gorgones, méduses), certains mollusques (bénitiers, nudibranches), des éponges et des plathelminthes (vers plats), ainsi que certains protozoaires ciliés et des foraminifères.
Ces hôtes sont présents dans les habitats marins peu profonds (avec depuis peu des exceptions, cf "rubrique informations complémentaires"), des latitudes tropicales aux latitudes tempérées.
La grande majorité des zooxanthelles sont des dinoflagellés c'est à dire des organismes microscopiques unicellulaires eucaryotes* de couleur jaune ou brunâtre. Il existe de nombreux autres organismes unicellulaires eucaryotes symbiotiques* (voir la rubrique « espèces ressemblantes »).
Ces dinoflagellés endosymbiotiques (soit intracellulaires) sont des cellules sphériques voire ellipsoïdales de 5 à 13 µm de diamètre, à la surface lisse et dépourvues de flagelle* (par contre les formes libres de dinoflagellés possèdent deux flagelles). Dans chaque cellule de l’hôte, on peut observer un nombre variable de zooxanthelles généralement une à huit (voire beaucoup plus).
Chez les cnidaires, les zooxanthelles sont contenues dans les cellules de l’endoderme* (paroi interne de la cavité gastrique). En général, elles sont enveloppées par une membrane dans le cytoplasme* de leur hôte (on parle d’endosymbiote).
Chez les bénitiers (mollusques bivalves, par exemple Tridacna maxima), les symbiotes se trouvent dans une structure tubulaire ramifiée qui communique avec l’estomac, elles sont situées entre les cellules (intercellulaire) et non au sein des cellules.
Les symbiotes* des coraux sont tous des zooxanthelles. Mais ils appartiennent à différents taxons* de dinoflagellés (voir les rubriques “divers biologie” et “informations complémentaires”).
Il existe cependant d’autres symbiotes photosynthétiques* dans divers hôtes animaux :
Ces dinoflagellés possèdent un chloroplaste* dans leur cytoplasme*, qui leur permet d’effectuer la photosynthèse* en présence de lumière. Une grande partie des composés organiques (glucides, lipides) produits sont livrés à l’hôte pour ses besoins métaboliques. Les symbiotes* utilisent les déchets azotés et phosphorés du polype* et les recyclent en acides aminés et autres substances. Cependant le dioxyde de carbone (CO2) issu de la respiration du polype n’est pas absorbé par la zooxanthelle qui tire ce gaz directement de l’eau de mer.
Pour les coraux vivant dans les zones peu profondes, les zooxanthelles peuvent ainsi fournir au corail jusqu’à 90 % de ses besoins en matière organique (et différentes molécules issues également du processus de photosynthèse) nécessaires à son métabolisme. Ce qui permet aux coraux d’être efficaces dans des eaux oligotrophes* comme le sont les eaux des mers transparentes.
Le dioxygène (O2) est un sous-produit de la photosynthèse, il diffuse vers le cytoplasme des cellules du polype en complément de celui absorbé directement dans l’eau de mer. La nuit, seul le dioxygène de l’eau de mer est utilisé pour la respiration du polype.
On retrouve le même mécanisme de photosynthèse pour toutes les zooxanthelles des organismes hôtes comme les bénitiers (mollusques bivalves comme Tridacna maxima) et les nudibranches éolidiens (comme Pteraeolidia semperi) ou sacoglosses (comme Elysia viridis). Ces nudibranches sont d’ailleurs appelés « limaces à énergie solaire » ("solar powered sea slugs").
Les zooxanthelles, et les autres dinoflagellés, contiennent des chlorophylles* a et c, du béta-carotène* (pigments présents chez la plupart des végétaux chlorophylliens) et des pigments propres aux dinoflagellés comme la péridinine (qui est une xanthophylle*), de la néopéridinine, de la dinoxanthine et de la néo-dinoxanthine (Jeffrey 1968).
Cette diversité des pigments permet aux zooxanthelles de pouvoir s’adapter aux différentes conditions d’éclairement (par exemple en fonction de la profondeur).
Les dinoflagellés symbiotes* (ou endosymbiotiques) dans les cellules sont dans un état végétatif non mobile.
Ces dinoflagellés peuvent être acquis par leur hôte de deux façons différentes :
La grande richesse des récifs coralliens est due à la symbiose avec les dinoflagellés car le milieu océanique où ils vivent est particulièrement pauvre (oligotrophe*).
Dans une anémone de mer, on peut compter jusqu’à plusieurs millions de zooxanthelles par milligramme de protéines animales ou 5 millions de cellules par cm² de tissu corallien.
Il existe de nombreux dinoflagellés symbiotiques* appartenant à plusieurs ordres (au moins 4) et familles. Mais la famille des Symbiodiniceae (ordre des Suessiales) est de loin la plus répandue géographiquement et la plus importante du point de vue écologique. Au sein de cette famille le genre Symbiodinium (parmi au moins neuf autres genres) comprend la première espèce décrite Symbiodinium microadriaticum (que l’on croyait largement répandue). Cette diversité est due à de grandes différences génétiques et moléculaires.
S. microadriaticum comprendrait de nombreux clades* A, B, C, D, E, F et G aux propriétés différentes.
Il existe probablement des centaines d'espèces non décrites dans la famille des Symbiodiniaceae, chacune ayant des attributs écologiques et des répartitions géographiques distincts, y compris des espèces qui sont spécifiques à un hôte et endémiques* au niveau régional, et d'autres, à spectre plus large, qui s'associent à de nombreux types d'hôtes dans de vastes zones océaniques comme l'Indo-Pacifique.
La répartition et le nombre de zooxanthelles dans les tissus de l’hôte dépendent de nombreux facteurs (la température de l’eau, les conditions d’éclairement) et bien entendu des caractéristiques physiologiques de cet hôte.
Comme les zooxanthelles peuvent posséder plusieurs pigments, cela leur permet de répondre à des conditions d’éclairement variable, par exemple, en fonction de la profondeur.
Un même hôte peut contenir plusieurs clades différents de dinoflagellés. Parmi les différents taxons* de zooxanthelles, on observe des différences dans l’adaptation à des régimes de lumière variable et dans la réponse aux radiations ultraviolettes.
Les zooxanthelles, par leur photosynthèse, stimulent la précipitation du carbonate de calcium (CaCO3 donc du calcaire) sous forme cristallisée (l’aragonite). Elles favorisent la formation du squelette externe des coraux. La formation de ce carbonate de calcium est ainsi plus importante en présence de lumière et de zooxanthelles.
En cas de conditions défavorables (augmentation progressive de la température de surface de la mer, du rayonnement ultra-violet, ainsi que de l'eutrophisation* et de l'augmentation de la sédimentation), les polypes* sont stressés. Si ce stress est trop important ou dure trop longtemps, les polypes expulsent les zooxanthelles : les coraux blanchissent. Cette situation est réversible si les conditions redeviennent favorables suffisamment vite. Sinon, cela peut entraîner une mortalité corallienne généralisée.
Tous les dinoflagellés symbiotiques* ne sont pas des Symbiodiniaceae et tous les Symbiodiniaceae ne sont pas symbiotiques. Certaines espèces de plusieurs genres différents vivent libres.
D’autres dinoflagellés sont responsables d'épisodes d’efflorescence* (blooms*) à l’origine de marées toxiques (marée rouge, …) ou d'empoisonnement des moules, huîtres, poissons (ciguatera* provoquée par le dinoflagellé Gambierdiscus polyniesiensis par exemple), ...ou d'émission de bioluminescence* comme la noctiluque Noctiluca scintillans.
En fonction de la physiologie du polype*, la répartition des algues dans les tissus de l’hôte varie. En ce qui concerne les polypes* qui s’épanouissent la nuit, la quantité de zooxanthelles est moindre sur les tentacules* que ceux qui s’épanouissent le jour.
Des mollusques bivalves comme les Fraginae (Corculum cardissa voir les fiches bénitiers) ont une portion de coquille dépigmentée et translucide (« fenêtre ») pour laisser passer la lumière.
La symbiose trouve son origine évolutive dans la phagocytose* des cellules photosynthétiques par des cellules hétérotrophes*, mais l’origine des plastes* des dinoflagellés est encore à préciser, algue verte ou algue rouge ?
Les travaux de D. Riddle (2006, 2011, 2016) donnent la liste des hôtes et des symbiotes connus.
Selon Richards 2019 (et Kwong & al. 2020), la symbiose corallienne serait due à non pas deux mais trois protagonistes (le troisième est nommé corallicolides) dont les caractéristiques et le rôle doivent être encore définis.
Des zooxanthelles (Symbiodiniaceae du genre Cladocopium)
sont hébergées dans un scléractiniaire (Leptoseris hawaïensis) dans
l’archipel des Gambier (Polynésie française) à 172 m de profondeur soit dans
une zone de lumière vraiment très réduite. Des algues vertes endolithiques (c'est-à-dire à
l’intérieur du squelette du cnidaire) du genre Ostreobium adaptées aux
très faibles luminosités sont associées à ces Symbiodiniaceae. (Rouzé &
al. 2021, Bonacolta & al. 2023).
Les dinoflagellés sont apparus il y a plus de 200 millions d’années à une période où les coraux modernes constructeurs de récifs ont commencé à se diversifier. Les estimations de l'horloge moléculaire situent l'origine de la lignée la plus ancestrale de la famille des Symbiodiniaceae au début ou au milieu du Jurassique, lorsque les coraux ont atteint leur taux de diversification maximal après une longue période de récupération à la suite de l'extinction massive de la fin du Trias. Par conséquent, l'origine des écosystèmes* modernes des récifs coralliens a commencé à l'ère mésozoïque (ou secondaire), facilitée par l'émergence de mutualismes* animal-dinoflagellés.
Zooxanthelle : francisation du nom de genre donné par K. Brandt.
Zoochlorelle : francisation du nom de genre donné par K. Brandt.
Dinoflagellés : du grec [dinos] = tourbillon, tournoyant et du latin [flagellum] = fouet. Ce nom fait référence à la nage particulière de ces organismes (quand ils sont libres) du fait de l’agitation des deux flagelles. Ce nom aurait été créé en 1773 par le zoologiste danois Otto Friedrich Müller (1730-1784).
Zooxanthella : du grec [zoo-] = animal, [xantho-] = jaune et du diminutif [-ella]. Nom de genre donné, en 1881, par le biologiste marin allemand Karl Brandt (1854-1931).
Symbiodinium : du grec [sym] = ensemble, [bio] = vie, vivre et [dinos] = tourbillon, tournoyant et le suffixe neutre (-ium). La racine [dinos] fait référence au taxon* des dinoflagellés auquel appartient Symbiodinium, mais Symbiodinium n'a pas de flagelle et donc ne tourbillonne pas dans l'hôte. Ce nom de genre a été donné par Gert Hansen & Daugbjerg en 2009 sans explication et sans spécimen type. De ce fait, l'espèce Symbiodinium microadriaticum n'était pas reconnue officiellement. L'étude a été reprise par le biologiste nord américain Todd C. LaJeunesse en 2017 afin de valider ce genre et cette espèce.
microadriaticum : du préfixe grec [micro-] = petit et de la latinisation du nom de la mer Adriatique. Ce nom d’espèce a été donné par le biologiste marin aux Etats-Unis d’Amérique, Hugo David Freudenthal (1930-2021), en 1962. Il a choisi microadriaticum parce qu'il a perçu une similitude morphologique entre les cellules de sa culture en laboratoire, bien que de taille beaucoup plus petite, et le dinoflagellé de la mer Adriatique Gymnodinium adriaticum décrit par Kofoid & Swezy en 1921.
Zoochlorelle : du grec [zoo-] = animal, et [chloro-] = vert tendre et [-ella] = diminutif. Nom de genre donné en 1881 par le biologiste marin allemand Karl Brandt (1854-1931).
Ostreobium : du grec [ostreon] = huître, dans le sens "partie la plus dure" et du suffixe grec [-bio / -bium] = vie, en référence à l'habitat de ces algues qui sont présentes dans le squelette des constructeurs de récifs coralliens tropicaux.
Corallicolides: du latin [corallium] = corail et du sufixe latin [-cola] = habitant, donc qui habite le corail.
Numéro d'entrée WoRMS : 604811
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Myzozoa ou Mastigophora | Myzozoaires | Unicellulaires possédant un ou plusieurs flagelles. Certains possèdent des chloroplastes et sont photosynthétiques. |
| Sous-embranchement | Dinozoa | Dinozoaires | |
| Classe | Dinophyceae | Dinophycées | Deux flagelles, thèque le plus souvent cellulosique et solide, noyau de type dinocaryon, pigment rouge orangé caractéristique : la péridinine. |
| Ordre | Suessiales | Suessiales | |
| Famille | Symbiodiniaceae | Symbiodiniacées | |
| Genre | Zooxanthella | ||
| Espèce | spp. |
 Diatomées et autre phytoplancton
Diatomées et autre phytoplancton

Branches de Pocillopopora
Les taches brunes sont des zooxanthelles.
Dans une cuvette rocheuse, Trois Bassins, côte ouest de l'île de la Réunion, 1 m
23/10/2024
 Diatomées et autre phytoplancton
Diatomées et autre phytoplancton

Détail d'une branche d'Acropora
On observe les zooxanthelles sous la forme de taches brunes.
Dans une cuvette rocheuse, Trois bassins, Côte ouest de l'île de la Réunion, 1 m
23/10/2024
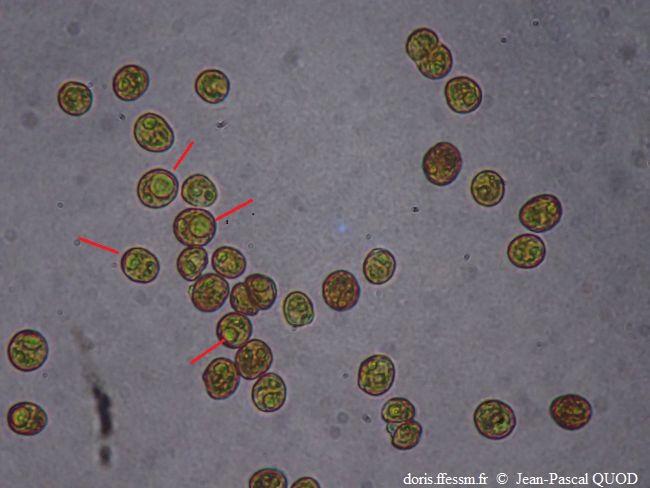
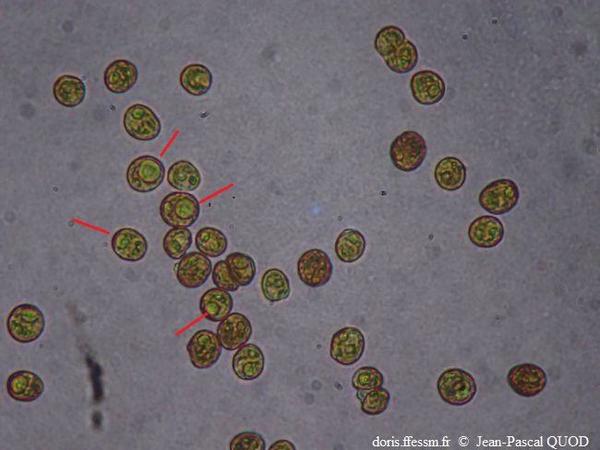
Zooxanthelles observées au microscope
Dans quelques cellules (d'un diamètre de l'ordre de 10 µm) , le chloroplaste est bien visible.
Au microscope,
10/2024


fungia
L'individu de gauche a expulsé ses zooxanthelles
Majicavo Mayotte 2-3m
17/04/2019


Quelques Goniopora mal en point
Le sommet des colonies est en cours de blanchissement
Handréma Mayotte 2-3m.
02/05/2019
Rédacteur principal : Yves MÜLLER
Vérificateur : Jean-Pascal QUOD
Responsable régional : Yves MÜLLER
Baillie B.K., Belda-Baillie C.A., Maruyama T., 2000, Conspecificity and indo-pacific distribution of Symbiodinium genotypes (dinophyceae) from giant clams, Journal of Phycology, 36, 1153-1161.
Bonacolta A.M., Weiler B.A., Porta-Fito T., Sweet M., Keeling P., del Campo J., 2023, Beyond the Symbiodiniaceae: diversity and role of microekaryotic coral symbionts, Coral Reefs, 42, 567-577.
Brandt K., 1883, Uber die morphologische und physiologische Bedeutung des Chlorophylls bei Thieren, 2 Artikel. Archiv fur Anatomie und Physiologie, Leipzig,191-302.
Carlos A.A., Baillie B.K., Maruyama T., 2000, Diversity of dinoflagellate symbionts (zooxanthellae) in a host individual, Marine Ecology Progress Series, 195, 93-100.
Carlos A.A., Baillie B.K., Kawachi M., Maruyama T., 1999, Phylogenetic position of Symbiodinium (Dinophyceae) isolates from tridacnids (Bivalvia), cardiids (Bivalvia), a sponge (Porifera), a soft coral (Anthozoa), and a free-living strain, Journal of Phycology 35, 1054-1062.
Chalias V., 2020, Les Zooxanthelles: des organismes de plus en plus complexes,4p. https://recifalnews.fr/2020/05/
Davy S. K., Allemand D., Weis V. M., 2012, Cell Biology of Cnidarian-Dinoflagellate Symbiosis, Microbiology and Molecular Biology Reviews, 76(2), 229–261.
Del Campo J., Pombert J-F., Slapeta J., larkum A., Keeling P.J., 2017, The 'other' coral symbiont : Ostreobium diversity and distribution, The International Society for Microbial Ecology Journal, 11, 296-299.
Doyle W. L., Doyle M. M., 1940, The structure of zooxanthellae, Carnegie Inst. Washington Publ. No. 517. Papers from Tortugas Lab., 32, 129-42.
Fitt W.K., Trench R.K., 1981, Spawning, development and acquisition of zooxanthellae by Tridacna squamosa (Mollusca, Bivalvia), Biological Bulletin, 161, 213-235.
Freudenthal H. D. 1962. Symbiodinium gen. nov. and Symbiodinium microadriaticum sp. nov., a zooxanthella. Taxonomy, life cycle, morphology, Journal of Protozoology, 9, 45-52.
Furla P., Allemand D. 2009, Relation de couple au soleil: l’endosymbiose Cnidaires-Dinoflagellés, Biofutur, 299, 40-43.
Hansen G., Daugbjerg N., 2009, Symbiodinium natans sp. nov.: a ‘‘free-living’’ dinoflagellate from Tenerife (northeast-atlantic ocean), Journal of Phycology, 45, 251–263.
Jeffrey S.W., Haxo F.T., 1968, Photosynthetic pigments of symbiotic dinoflagellates (Zooxanthellae) from corals and clams, Biological Bulletin, 135(1), 149–65.
Karako S., Stambler N., Dubinsky Z., 2002, The Taxonomy and Evolution of the Zooxanthellae-Coral Symbiosis, Cellular Origin, Life in Extreme Habitats and Astrobiology, Kluwer Academic Publishers, 539–557.
Kevin M.J., Hall W.T., McLaughlin J.J.A., Zahl P.A., 1969, Symbiodinium microadriaticum Freudenthal, a revised taxonomic description, ultrastructure, Journal of Phycology, 5, 341-350.
Kwong W.K., Irwin N.A.T., Mathur V., Na I., Okomoto N., Vermeij M.J.A., Keelong P.J., 2020, Taxonomy of the apicomplexan symbionts of coral, including Corallicolida ord. nov., reassignment of the genus Gemnocystis, and description of new species Corallicola aquarius gen. nov. sp. nov. and Anthozoaphila gnarlus gen. nov. sp. nov., bioRxiv, 9p.
LaJeunesse, T.C., 2001, Investigating the biodiversity, ecology, and phylogeny of endosymbiotic dinoflagellates in the genus Symbiodinium using the ITS region: in search of a “species” level marker, Journal of Phycology, 37, 866–880.
LaJeunesse, T.C., 2017, Validation and description of Symbiodinium microadriaticum, the type species of Symbiodinium (Dinophyta) (Note).Journal of Phycology, 53(5), 1109-1114.
LaJeunesse T.C., 2020, Quick guide, Zooxanthellae, Current Biology Magazine, 30, R1096-R1113.
Lampert K.P., 2016, Cassiopea and its Zooxanthellae, in Goffredo, Stefano Dubinsky, Zvy, (2016). The Cnidaria, Past, Present and Future, Cassiopea and Its Zooxanthellae, 26, 415–423.
Leggat W., Hoegh-Guldberg O., Dove S., Yellowlees D., 2007, Analysis of an EST library from the dinoflagellate (Symbiodinium sp.) symbiont of reef-building corals, Journal of Phycology, 43(5), 1010-1021.
Loh W.K.W., Cowlishaw M., Wilson N.G., 2006, Diversity of Symbiodinium dinoflagellate symbionts from the Indo-Pacific sea slug Pteraeolidia ianthina (Gastropoda: Mollusca), Marine Ecology Progress Series, 320,177-184.
Liu H., Stephens T.G., Gonzàlez-Pech R.A., Beltran V.H., Lapeyre B., Bongaerts P., Cooke I., Aranda M., Bourne D.G., Forêt S., Miller D.J., van Oppen M.J.H., Voolstra C.R., Ragan M.A., Chan C.X., 2018, Symbiodinium genomes reveal adaptive evolution of functions related to coral-dinoflagellate symbiosis, Communication Biology, 1(95), 1-11.
McCoy D.E., Burns D.H., Klopfer E., Herndon L.K., Ogunlade B., Dionne J.A., Joohnsen S., 2024, Heart cockle shells transmit sunlight to photosymbiotic algae using bundled fiber optic cables and condensing lenses, Nature Communications, 15, 9445, 1-13.
Muscatine L., Porter J.W., 1977, Reef Corals: Mutualistic Symbioses Adapted to Nutrient-Poor Environments, BioScience, 27(7), 454–460.
Probert I., Siano R., Poirier C., Decelle J., Biard T., Tuji A., Suzuki N., Not F., Lane C., 2014, Brandtodinium gen. nov. and B. nutricula comb. nov. (Dinophyceae), a dinoflagellate commonly found in symbiosis with polycystine radiolarians, Journal of Phycology, 50(2), 388–399.
Richards T.A., McCutcheon J. P., 2019, Coral symbiosis is a three-player game, Nature, 568, 41-42.
Riddle D., 2006, Feature Article: Lighting by Number: “Types” of Zooxanthellae and What They Tell Us, Advanced Aquarist’s Online Magazine, 5(1).
Riddle D., 2011, Feature Article: Getting Really Up to Date on Zooxanthellae (Symbiodinium spp.), Advanced Aquarist
Riddle D., 2016, An Update on Symbiodinium Species and Their Hosts, Advanced Aquarist, XVII,
Rouzé H., Galand P.E., Medina M., Bongaerts P., Pichon M., Pérez-Rosales G., Torda G., Moya A., Under The Pole Consortium, Raina J-B., Hédouin L., 2021, Symbiotic associations of the deepest recorded photosynthetic scleractinian coral (172 m depth), The International Society for Microbial Ecology Journal, 5p.
Scaps P., Vianney D., Berhimpon S., Runtukahu F., 2007, Zooxanthellate scleractinian corals of the northern coast of Sulawesi, Atoll Research Bulletin, 553, 1-21.
Taylor, D. L. 1974. Symbiosis between the (chloroplasts of Griffithsia flosculosa (Rbodophyta) and Hermea bifida (Gastropoda, Opisthobranchia), Publ. Stag. ZooL Napoli, 39, 116-200.
Trench R.K., 1979, The Cell Biology of Plant-Animal Symbiosis, Annual Review of Plant Physiology, 30(1), 485-531.
Wakefield T., Farmer M., Kempf S., 2000, Revised Description of the Fine Structure of in situ "Zooxanthellae" Genus Symbiodinium, The Biological Bulletin,199(1), 76–84.
Zahl P.A., McLaughlin J.J.A., 1959, Studies in Marine Biology. IV. On the Role of Algal Cells in the Tissues of Marine Invertebrates, Journal of Protozoology, 6(4), 311-352, 6(4), 344–352.
----------
La page de Symbiodinium microadriaticum dans
l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.