Grande coquille bivalve de forme triangulaire, épaisse, lourde, jusqu'à 40 cm de longueur
Valves presque équilatérales
4, 5 ou à 6 grandes côtes radiales arrondies et espacées avec de grandes et larges écailles saillantes, espacées
Entre les côtes petites rides interrompues par de fines stries de croissance concentriques
Valves souvent colorées (jaune, rose-orange) ou blanches
Manteau et siphons colorés avec des motifs tachetés jaunes, orange, bleus, verts et bruns
Siphon inhalant allongé bordé de nombreux tentacules complexes
Siphon exhalant sur un monticule conique
Grand bénitier gaufré, tridacne faîtière, tridacne tuilée
Scaly clam, giant
fluted clam, giant clam, fluted giant clam, fluted clam (GB), Schuppige
Riesenmuschel, Schuppen-Riesenmuschel (D)
Tridacna imbricata Röding, 1792
Tridacna (Chametrachea) squamosa Lamarck, 1819
Tridacna lamarcki Hidalgo, 1903
Indopacifique, mer Rouge
Zones DORIS : ● Indo-Pacifique, ○ [Mer Rouge]Tridacna squamosa a une large distribution. C’est la deuxième espèce la plus répandue après T. maxima. Elle est présente en mer Rouge, dans l'océan Indien (en Afrique de l'est, à Madagascar, aux Mascareignes*, Chagos), dans l'océan Pacifique jusqu'aux îles Tonga, Tuamotu, l’archipel des Gambier et du sud du Japon au Queensland (Australie), sauf aux îles Cocos (Keeling) et aux îles Mariannes du Nord où l'espèce est localement éteinte. Cette espèce a été introduite à Hawaï et à Guam.
Tridacna squamosa, comme les autres espèces de bénitiers, est toujours associée aux récifs coralliens. De ce fait, les besoins comme la température et la lumière sont les mêmes. Les bénitiers sont même plus exigeants pour leur dépendance vis à vis de la lumière que les coraux. Toutefois, ils vivent moins profondément que les coraux. Cette espèce est observée sur les platiers* récifaux peu profonds ou les zones sableuses adjacentes jusqu'à une profondeur d'environ 20 m, voire jusqu’à 42 m dans les sites abrités. Elle peut être partiellement recouverte par la croissance du corail.
La coquille peut mesurer jusqu’à 40 cm de longueur. Chaque valve* triangulaire est presque équilatérale contrairement à T. maxima, elle porte 4 ou 5 ou 6 grandes côtes* radiales arrondies espacées. Tridacna squamosa peut être distingué de toutes les autres espèces de la famille par sa sculpture caractéristique d'écailles (ou scutelles*) saillantes, larges, semblables à des feuilles, très espacées sur les côtes radiales. Une sculpture radiale secondaire entre les côtes forme de petites rides interrompues par de fines lignes de croissance concentriques (aspect réticulé ou légèrement noduleux). Les bords de la coquille sont fortement incurvés. L’ouverture byssale* est très variable (étroite à modérée).
Les valves sont souvent colorées (jaune et rose-orange) ou blanches.
L’extension du manteau* peut cacher la coquille et les écailles. Le manteau est lisse avec peu de papilles*, il présente généralement des motifs tachetés dans des combinaisons de jaunes, orange, bleus, verts et bruns.
Le siphon* inhalant* est allongé et bordé de tentacules* nombreux et complexes. Le siphon exhalant* est situé sur un monticule conique
et est généralement dirigé vers l'avant.
Les ocelles* sont distribués de façon irrégulière uniquement le long des bords du manteau. Vers le milieu du bord du manteau, les ocelles peuvent être sur de petits monticules du manteau.
L'extérieur de la coquille est blanc grisâtre, souvent avec diverses nuances d'orange, de jaune ou de rose/mauve. L'intérieur de la coquille est blanc porcelaine, avec une touche occasionnelle d'orange.
L’identification des différentes espèces de bénitiers est délicate et difficile. Les motifs, les couleurs du manteau* varient considérablement d’un individu à l’autre pour la même espèce. Certaines combinaisons de couleurs et de motifs peuvent ressembler à celles d’une autre espèce.
En plongée les individus vivants sont vus par dessus, la forme, le nombre de côtes et les marges de la coquille, sa symétrie, la présence d’écailles, les motifs et l’extension du manteau, la présence de tentacules* autour du siphon* inhalant*, la présence d'ocelles*, la profondeur et le fait que la coquille soit encastrée ou non dans le substrat* sont les seuls critères disponibles.
La coquille vide peut montrer la présence de l’ouverture pour le passage du byssus*.
12 espèces de bénitiers sont décrites actuellement (sous-famille des Tridacninae). Toutes ces espèces ont une distribution indopacifique et vivent à faible profondeur dans les récifs coralliens ou à proximité.
Certaines espèces sont plus répandues que d'autres :
Quelques espèces sont capables de s’encastrer dans le substrat : Tridacna maxima, T. crocea, T. noae et T. elongatissima.
Par ordre d'importance de présence :
Tridacna maxima (Röding, 1798). Cette espèce ressemble beaucoup à T. noae et T. elongatissima et un peu moins avec T. squamosina et T. crocea.
La coquille bivalve de forme triangulaire, allongée, est épaisse et lourde. Elle mesure en général 15 à 20 cm dans sa plus grande dimension (mais peut atteindre 42 cm). Chaque valve, inéquilatérale, porte 4 à 6 (généralement 5) côtes radiales basses mais larges, sur lesquelles on observe de nombreuses écailles (ou scutelles*) grandes et ondulées disposées de façon concentrique (les plus anciennes sont souvent usées donc seules celles présentes sur la partie supérieure sont visibles chez les individus adultes).
Sur une coquille vide, la ligne de charnière représente environ un tiers de la longueur de la coquille. Le ligament* est externe. L’orifice pour le passage du byssus est de taille variable.
L'extérieur de la coquille est généralement blanc cassé à crème parfois nuancé de jaune, l'intérieur est blanc.
Chez l’animal vivant, les bords du manteau recouvrent en général les bords de la coquille. Le siphon est bordé de petits tentacules. Les siphons et le manteau sont richement tachetés, pigmentés souvent de couleur vive (bleu, vert, brun) mais pas iridescents avec à peine deux motifs identiques. Le long de la marge du manteau, des ocelles sont disposés en rangées plus ou moins régulières et forment une ligne sombre presque continue sur le bord du manteau. Ils sont également dispersés de façon irrégulière sur le manteau. T. maxima n’est jamais aussi profondément encastrée que T. crocea.
C’est l’espèce de bénitier la plus commune, elle a une très large distribution. T. maxima est présente du nord de la mer Rouge (golfe de Suez et golfe d’Eilat/Aqaba), en englobant les récifs des océans Indien (dont les îles Éparses, Mayotte, La Réunion) jusqu'au Pacifique (dont la Nouvelle-Calédonie, Wallis-et-Futuna et la Polynésie française).
Tridacna gigas (Linnaeus, 1758). C’est le plus grand mollusque bivalve vivant. Le plus grand spécimen mesurait 1,37 m de longueur et les 2 valves pesaient 230 kg. Les jeunes individus sont difficiles à distinguer des autres espèces de tridacnides, ils sont souvent confondus avec T. derasa. La coquille est épaisse et lourde, sans écailles. Chaque valve est légèrement inéquilatérale par rapport à son sommet, elle porte 4 à 5 côtes radiales. L’ouverture pour le passage du byssus est petite ou absente.
L’extension du manteau est variable, il peut rester juste sur le bord ou cacher complètement la coquille. Le manteau est généralement brun doré, jaune ou vert avec de nombreuses taches iridescentes bleues, violettes ou vertes, surtout sur les bords. Les plus grands individus peuvent avoir tellement de taches que le manteau semble bleu ou violet uni. Le siphon inhalant ne porte pas de tentacules.
La coquille ne peut pas se fermer complètement.
T. gigas vit à faible profondeur, voire dans des zones abritées de la zone de balancement des marées, et plutôt sur des récifs isolés en raison de sa surexploitation par l’homme. T. gigas, en Nouvelle-Calédonie, est présente à l'état de fossile et est apparemment éteinte. T. gigas est présent de la mer Rouge au Pacifique central en passant par l'Afrique de l'Est et les îles Éparses, la Nouvelle-Calédonie et la Polynésie française.
Tridacna derasa (Röding, 1798). C’est la deuxième plus grande espèce puisque sa coquille peut atteindre jusqu’à 60 cm de longueur. Mais les coquilles sont plus allongées et étroites que celles de T. gigas. Les valves sont symétriques par rapport à leur sommet et portent 5 à 7 côtes radiales peu développées. En général, chaque valve porte peu d’écailles, voire de simples crêtes. L’ouverture pour le passage du byssus est étroite et petite.
L’extension du manteau est variable, à peine au-delà de la marge pour cacher la coquille. Le siphon inhalant est bordé de grands tentacules divisés. Cette espèce perd son byssus et peut donc être libre.
Elle peut être observée jusqu’à 20 m de profondeur.
Tridacna mbalavuana ressemble à T. derasa, mais se distingue par la présence de tubercules* à la surface de son manteau et de tentacules autour de l’orifice du siphon inhalant, une coquille plus mince et des taches colorées sur les côtes.
L'aire de répartition de Tridacna derasa est centrée sur le triangle de corail, elle est également présente à l'ouest de cette zone jusqu'aux îles Cocos (mais pas dans l'Océan Indien à l'ouest des Cocos), en Nouvelle-Calédonie, au nord de cette zone jusqu'au sud du Japon (archipel des Ryükyü) et à l'est jusqu'aux îles Tonga.
Tridacna noae (Röding, 1798), (= T. ningaloo). La coquille mesure entre 6 et 20 cm (voire jusqu’à 28 cm) de longueur. Les valves sont inéquilatérales* avec 5 à 7 côtes radiales. Les écailles sont bien espacées.
Cette espèce ressemble à T. maxima en apparence, mais se distingue par ses ocelles peu distribués et espacés sur le bord du manteau et plus particulièrement par son ornementation de taches ovales (ou en forme de goutte d’eau) de différentes couleurs délimitées par des marges blanches le long du bord du manteau et par la présence de papilles sur le manteau.
Elle est observée de 1 à 15 m de profondeur souvent encastrée dans les substrats récifaux qu'elle serait capable de creuser.
Longtemps confondue avec T. maxima mais généralement présente en plus faible abondance, sa distribution confirmée est parcellaire, elle doit être revue. Tridacna noae est documentée dans l'océan Indien en Afrique de l'est (Tanzanie) et dans l'ouest Pacifique au Japon (archipel des Ryükyü) et à Taïwan, ainsi qu'aux Vanuatu.
Tridacna crocea Lamarck, 1819. C’est l’espèce la plus petite des bénitiers, elle est morphologiquement très proche de T. maxima et de T. squamosa mais la longueur de la coquille est de 10 cm (rarement jusqu’à 15 cm). Chaque valve est modérément inéquilatérale et modérément allongée. Elle porte 5 à 6 (parfois jusqu'à 10 avec 4 ou 5 côtes moins prononcées) côtes radiales basses avec de nombreuses écailles fines, petites très rapprochées les unes des autres, mais souvent érodées sauf celles près de la marge. L’ouverture byssale est grande (1/3 de la longueur de la coquille).
L’extension du manteau peut cacher la coquille et les écailles. Le manteau est très richement pigmenté (habituellement bleu ou vert iridescent avec des mélanges de nombreuses autres couleurs comme du violet, de l'orange). Il présente des motifs variés, des rayures, des vagues, des taches et des anneaux. Le siphon inhalant est bordé de nombreux petits tentacules simples.
La coquille est blanc-grisâtre parfois teintée de jaune, d'orange. Parfois une bande colorée est présente sur le bord supérieur de la coquille et sur sa surface intérieure.
Cette espèce peut être complètement encastrée dans le corail. Seuls les bords des valves peuvent affleurer la surface.
Elle semble supporter des eaux saumâtres et même l'émersion car elle vit dans la zone de balancement des marées et à faible profondeur (10 m maximum). Des fortes densités ont été observées : 100 à 200 individus par m².
Elle est présente en Afrique de l'est, à Madagascar, dans les Mascareignes, dans le triangle de corail, du Japon à l’Australie et des îles Andaman (océan Indien) jusqu'au Vanuatu.
Hippopus hippopus (Linnaeus, 1758). Cette espèce mesure jusqu’à 40 cm de longueur (voire 50 cm). Les valves épaisses, étroitement imbriquées, sont inéquilatérales (parfois une valve est plus creuse que l'autre). Elles portent 7 à 8 côtes radiales sans écailles avec des taches brunâtres ou rougeâtres. L’orifice pour le passage du byssus est étroit et disparaît chez l’adulte.
Le manteau brunâtre ou vert-olive avec des motifs marbrés ne s’étend pas au-delà des bords de la coquille. IL ne porte pas d’ocelles et le siphon inhalant ne possède pas de tentacules. Cette espèce perd rapidement son byssus et de ce fait peut être trouvée sur des fonds sableux ou d’herbiers peu profonds (jusqu’à 10 m de profondeur). Elle peut se déplacer en roulant par des contractions du muscle adducteur*.
Cette espèce est présente du sud du Japon au nord-est de l’Australie et de l’Indonésie aux îles Tonga.
Tridacna mbalavuana Ladd, 1934 (= T. tevoroa). Cette espèce, rare, peut atteindre 50 cm de longueur (voire 56 cm). Elle présente seulement de faibles sculptures sur la coquille. Les valves inéquilatérales, avec une extrémité pointue, sont fines et portent des taches colorées sur les côtés. Les valves portent 6 à 7 côtes radiales basses et larges, peu marquées, à la marge arrondie. Seuls les jeunes individus portent des écailles en forme de pétale. L'ouverture pour le passage du byssus est réduite. Cette espèce est proche de T. derasa.
Le manteau gris-brunâtre, sans marques colorées, porte de grands tubercules*. Il dépasse de très peu le bord de la coquille. Celle-ci peut s'ouvrir largement. Le manteau est dépourvu d'ocelles. Le siphon inhalant est toujours entouré de tentacules proéminents généralement blancs. Cette espèce possède peu d'iridophores* (voir la rubrique "informations complémentaires").
La coquille est blanc-grisâtre avec souvent des taches rouges vers les sommets, souvent masquées par des algues calcaires et des éponges.
Tridacna mbalavuana vit plus profondément que les autres espèces (- 20m, - 30 m).
Sa distribution serait limitée aux îles Fidji et Tonga, aux îles Loyauté, en Nouvelle-Calédonie (côte est de la Grande Terre) et à la frange extérieure de la grande barrière de corail (Australie).
Tridacna elongatissima Bianconi, 1856. La coquille, allongée, lourde, presque triangulaire, peut mesurer jusqu’à 34 cm de longueur. Les valves inéquilatérales portent 6 à 7 côtes radiales avec des écailles circulaires assez grandes et rapprochées plutôt limitées aux sommets. L’orifice pour le passage du byssus est large. L’extérieur de la coquille est blanc-grisâtre ou jaune et l’intérieur blanc porcelané*.
Le manteau est vert à brun.
Cette espèce est présente jusqu’à 12 m de profondeur seulement dans l’ouest de l’océan Indien (île de La Réunion, mais rare à l’île Maurice et apparemment absente à l’île Rodrigues et à Mayotte). Elle a été par le passé souvent confondue avec T. maxima avec laquelle elle vit.
Tridacna squamosina Sturany, 1899, (= T. costata, T. elonga). Cette espèce ressemble à T. maxima et T. squamosa. La coquille peut mesurer jusqu’à 32 cm de longueur. Les valves sont inéquilatérales avec 5 à 7 côtes radiales pointues à leur extrémité. Les écailles sont bien espacées près des sommets et serrées sur les bords. Les deux valves fermées laissent un espace. Le byssus est développé, l'ouverture pour son passage est moyenne.
Le manteau est très variable avec une large gamme de couleurs et de motifs et est couvert de petites papilles en forme de boutons. Le siphon inhalant est bordé par des tentacules
Tridacna squamosina vit vers 5 m de profondeur dans les zones récifales et les herbiers, elle est endémique* de la mer Rouge.
Cette espèce a été surpêchée lors des premières occupations humaines de la région (grand nombre de coquilles subfossiles - 125 000 ans).
Tridacna rosewateri Sirenko & Scarlato, 1991 (= T. lorenzi). La coquille de 6 à 19 cm de longueur (jusqu’à 26 cm) est plus fine que celle de T. squamosa, et de T. maxima avec des prolongements des côtes plus développées, les valves sont faiblement inéquilatérales et elles portent 4 à 5 côtes radiales arrondies. Les écailles sont plus grandes et éparses. L’orifice pour le passage du byssus est assez large. L’intérieur des valves est blanc porcelané*.
Cette espèce est endémique du plateau des Mascareignes* où elle a été observée parmi des coraux clairsemés dans les herbiers à Thalassodendron ciliatum au nord-est de l’île Maurice et dans l'archipel de St-Brandon, qui appartient à la République de l'île Maurice.
Hippopus porcellanus Rosewater, 1982. Cette espèce, rare, possède une coquille plus lisse et plus fine que celle de H. hippopus. Elle mesure souvent moins de 40 cm de longueur. L’orifice pour le passage du byssus est étroit. Elle peut être confondue avec T. derasa mais le manteau est généralement gris ou brun, dépourvu d’ocelles, il ne s’étend pas au-delà des bords de la coquille. Le siphon inhalant possède des grands tentacules.
Cette espèce vit dans la zone de balancement des marées et peu profondément le long des bords des lagons. Sa distribution est restreinte aux Philippines, à l’Indonésie et à la Papouasie-Nouvelle-Guinée et dans le triangle de corail.
Au cours des 15 dernières années, trois espèces ont été redéfinies grâce aux outils moléculaires : T. squamosina, T. noae et T. elongatissima, toutes les trois morphologiquement proches d'autres espèces avec lesquelles elles avaient été mises en synonymes : dans ce cas on parle d’espèce cryptique*. Ce phénomène est assez commun chez les invertébrés marins et il existe peut-être encore d’autres espèces non décrites ou cryptiques.
Nicaisolopha tridacnaeformis (L.R. Fox, 1927). C’est une huître (famille des Ostreidés) dont les valves ressemblent un peu à celles des bénitiers. Cette espèce vit dans l'océan Pacifique.
Les bénitiers sont proches des Cardiidae (comme les coques communes par exemple). Ces dernières sont des filtreurs. Cependant les bénitiers ont une alimentation particulière. Le manteau* de ces mollusques contient de très grandes quantités de petites algues unicellulaires, les zooxanthelles* (Famille des Symbiodiniacées). Celles-ci sont des Dinoflagellés symbiotiques*. Les bénitiers, comme les coraux des récifs coralliens, bénéficient des produits de la photosynthèse* de ces algues et de leur digestion. C’est la présence de ces algues symbiotiques qui est à l’origine de la distribution des bénitiers dans des eaux claires et à faible profondeur afin de permettre la photosynthèse. Ces zooxanthelles sont logées dans une structure ramifiée (appelée système tubulaire à zooxanthelles) qui communique avec l’estomac de l’animal.
Un même individu peut héberger plusieurs genres différents de zooxanthelles qui sont acquises depuis l'eau environnante et dont la composition peut changer en fonction des conditions environnementales. C'est également à cette symbiose* avec des Symbiodiniacées que les bénitiers doivent leur propension au blanchiment en cas de stress thermique trop intense et/ou prolongé.
D’autres organismes exploitent les produits de la photosynthèse d’algues symbiotes* : une coque tropicale Corculum cardissa (bucarde coeur de Vénus), des éolidiens comme la limace à bigoudis (Spurilla neapolitana), des sacoglosses comme certaines élysies (Elysia viridis), des gorgones, des hydraires, des méduses (comme Cassiopea andromeda par exemple) et bien entendu les scléractinaires, coraux constructeurs des récifs coralliens.
Les bénitiers sont des hermaphrodites* protandres*. La partie mâle de la gonade* se développe en premier, puis la partie femelle. Les cellules sexuelles (spermatozoïdes* et ovules*) maturent simultanément et sont libérées dans l’eau. La synchronisation de la libération de ces cellules est assurée par l’émission d’une substance induisant cette libération (une phéromone*). Elle est détectée par des chimiorécepteurs du siphon* inhalant*. L’animal va alors se gonfler d’eau, fermer son siphon inhalant puis en contractant son muscle adducteur* qui va fermer la coquille, il va expulser l’eau et les cellules sexuelles par le siphon exhalant*. Les spermatozoïdes sont émis en premier, ensuite les ovules (environ 100 µm de diamètre). L’autofécondation n’est pas possible. La fécondation a lieu en pleine eau
Chaque œuf se développe, en environ 12 heures, en une larve* trochophore*. Celle-ci commence à produire une coquille de carbonate de calcium. Après deux jours, la larve* mesure 160 µm et devient une larve véligère*. Elle développe ensuite un pied. Après dix jours de vie planctonique*, la larve rejoint le fond et peut se déplacer avec son pied puis elle se métamorphose* en un bénitier juvénile.
Les larves de bénitiers ont tendance à s'installer sur des substrats* qui offrent un abri sous forme de rainures et de crevasses.
Les bénitiers juvéniles finissent par s'attacher au substrat à l'aide du byssus* et resteront en place tout au long de leur vie. Les espèces plus grandes perdent généralement leur byssus après avoir atteint l'âge adulte et ne sont maintenues en place que par leur taille et leur poids.
Le jeune tridacne ne possède pas encore de zooxanthelles*, il se nourrit de plancton*. Ce n’est qu’après une vingtaine de jours qu’il capture les zooxanthelles présentes dans la colonne d'eau.
La taille et l'âge de la maturité varient selon l'espèce et l'emplacement géographique, mais en général, les bénitiers sont connus pour atteindre la phase de maturité mâle dès 2-3 ans et la phase de maturité femelle vers 3-5 ans.
La durée de vie des petites et moyennes espèces de bénitiers serait de 10 à 50 ans.
Cette espèce est capable de s'hybrider avec Tridacna maxima et donc être à l'origine de morphologies intermédiaires.
En plus des zooxanthelles* contenues dans leurs tissus, les Tridacnidés servent d'hôtes à un grand nombre d'organismes qui vivent sur la surface des valves (épibiontes*), s'enfouissent dans l’épaisseur de la coquille ou encore habitent la cavité du manteau (commensaux*, ectoparasites* et endoparasites*).
Parmi les épibiontes, certaines algues encroûtantes ou non qui peuvent parfois encrasser la coquille et nuire à la croissance, des éponges, des anémones, des ascidies, des bryozoaires et des vers tubulaires.
Certains même forent la coquille comme des éponges (comme les cliones), des mollusques bivalves (Lithophaga et Gastrochaena), des vermets, des annélides polychètes tubicoles (Oenone fulgida), etc...
D’autres organismes commensaux vivent dans les cavités du manteau comme plusieurs espèces de crevettes Pontoniinidées, voire des petits poissons de récifs (comme Encheliophis homei) et même des poissons des anémones si celles-ci font défaut.
Différents parasites* sont également présents comme des copépodes* cyclopoïdes (Anthessius, Lichomolgus), des gastéropodes Pyramidellidés (ces derniers insèrent leur proboscis* dans le tissu du bénitier et consomment l’hémolymphe*).
Pour en savoir plus, vous pouvez consulter l’article de Neo et al. 2015.
Les infections dues à des bactéries sont le plus souvent causées par des Rickettsia sp. qui infectent les branchies*. Celles causées par des protozoaires* sont souvent dues à des Marteila sp. ou Perkinsus sp.
Ce sont surtout les jeunes individus qui sont touchés.
Certains auteurs considèrent les Tridacninés comme des espèces ingénieures* car elles jouent de nombreux rôles écologiques sur les récifs coralliens :
Chez un bivalve typique comme la coque commune (proche des bénitiers), les siphons* inhalant* et exhalant* sont situés à l’arrière de l’animal, les sommets de la coquille sont en haut et le pied en bas. Ce pied peut sortir entre les bords libres des deux valves de la coquille.
Un bénitier présente une organisation originale. Comme il doit permettre à la lumière d’éclairer les zooxanthelles*, il faut que les tissus contenant ces algues puissent être exposés à la lumière solaire. La charnière de la coquille est déplacée vers le bas près de l’ouverture par laquelle sortent les fils du byssus* (l’animal a subi une rotation de 180 ° dans sa coquille).
Les tissus contenant les zooxanthelles* sont largement hypertrophiés et s’étendent sur toute la longueur de la surface supérieure couvrant l’ouverture entre les bords des deux valves afin d’offrir une grande surface d’exposition à la lumière solaire. A cause de ces modifications, l’un des deux muscles adducteurs* a disparu (l’adducteur antérieur). Ainsi les bénitiers sont des monomyaires* (un seul muscle adducteur) comme les huîtres et les coquilles Saint-Jacques mais pour des raisons différentes.
Ces profondes modifications de l’anatomie des bénitiers se sont effectuées au cours des temps géologiques.
Ainsi la partie dorsale habituelle de la coquille est devenue partie ventrale et vice versa de telle sorte que l‘«orientation» d’une valve de bénitier est très particulière.
Comment déterminer chez les bénitiers les valves droites et gauches ? Il faut tenir un individu valves accolées l’une contre l’autre en plaçant le sommet et l’échancrure cordifome* (où passe le byssus) en position inférieure et le sommet du côté opposé à l’observateur. La coquille ainsi disposée, on a face à soi les bordures ondulantes des deux valves qui représentent la bordure dorsale, la valve qui est à droite est la valve droite, celle qui est à gauche est la valve gauche (Salvat, Rives 1975).
Les T. squamosa juvéniles sont typiquement attachés par le byssus aux roches coralliennes, tandis que les adultes peuvent être attachés par le byssus ou être libres.
Les Tridacnidae semblent s'être séparés des autres Cardiacea vers le début du Cénozoïque (l’ère tertiaire), occupant peut-être la niche laissée vacante par l'extinction, il y a 66 millions d'années, des bivalves rudistes (comme les Hippurites). Le genre Tridacna est apparu au cours de l’Yprésien (soit il y a 56 à 47 Millions d'années).
La sous-famille des Tridacnes (les Tridacninés) comprend deux genres :
La lumière du soleil est bien sûr essentielle à l'activité photosynthétique* des zooxanthelles* abritées dans le manteau, mais elle est potentiellement dangereuse pour le bénitier. Le risque d'exposition à des longueurs d'onde nocives a été surmonté par la production d'une pigmentation protectrice. Ces pigments sont contenus dans des cellules appelées iridophores* dans les tissus exposés. Ces cellules pigmentaires contiennent des empilements de minuscules plaquettes qui ont plusieurs fonctions. Ici, elles réfléchissent la lumière et ainsi génèrent des couleurs par diffraction de la lumière, c’est le même effet qui est observé sur la coquille d’autres mollusques, les plumes de certains oiseaux et les ailes de certains papillons. Ces iridophores sont donc à l’origine de la gamme de couleurs allant du bleu au vert ou du brun au jaune, ils donnent lieu à une variété presque infinie de motifs qui sont les plus vifs chez les plus petites espèces.
Sur la marge du manteau, de très nombreux (milliers) ocelles* sont présents (autrefois appelés organes hyalins). Ces yeux simples disposés près des marges du manteau* mais également dispersés de façon irrégulière ailleurs, permettent une perception visuelle en mosaïque. Chez les autres espèces proches (comme les coques), ces yeux sont disposés autour des siphons*.
Les ocelles des bénitiers sont responsables du retrait des lobes du manteau entre les valves de la coquille et de la fermeture au moins partielle de cette coquille. Ce comportement de défense est également à l’origine d’un puissant jet d’eau de mer par le siphon exhalant.
Cette réaction est une réponse à la présence de poissons qui peuvent grignoter ce manteau.
De nombreux prédateurs peuvent s’attaquer aux bénitiers.
Les juvéniles sont attaqués par des crabes et Pseudobalistes flavimarginatus qui peuvent écraser les valves de la coquille, ou des gastéropodes perceurs (Fasciolaridés, Muricidés) et des astéries.
Les marques de dents sur les surfaces extérieures de la coquille indiquent des attaques par des poissons de récif comme les poissons-perroquets et des entailles sur les marges du manteau par les poissons-chirurgiens.
Pour les individus plus âgés, les prédateurs potentiels comprennent des raies aigles Myliobatidae comme Aetobatis narnari, les tortues Caretta caretta, Chelonia mydas et certains grands poissons, mais leur impact diminue à mesure que les bénitiers grandissent.
T. squamosa est principalement récoltée à des fins de subsistance dans les communautés insulaires locales.
Comme la coquille et le manteau sont colorés, l'espèce est très prisée dans le commerce des coquillages. Cette espèce serait plus facile à maintenir en aquarium.
Cette espèce a été cultivée avec succès, principalement à des fins de repeuplement dans de nombreux endroits, mais peu d’informations sont disponibles sur les résultats.
Des objets ont été fabriqués avec la coquille de cette espèce dès les VIIie et VIie siècles avant notre ère par les Phéniciens. Une valve présente au British Museum montre une tête gravée sur le sommet côté interne et des sphinx ailés et des fleurs de lotus incisés.
Le réchauffement climatique a également des effets indésirables sur les populations de bénitiers.
Les bénitiers sont confrontés à un certain nombre de menaces naturelles et d’origine humaine dans l’ensemble de leur aire de répartition comme :Tridacna squamosa est classé par l'UICN* dans la catégorie "risque faible/dépendant de la conservation".
Bénitier : depuis la Renaissance, le recours au tridacne comme bénitier est devenu traditionnel pour contenir de l'eau bénite à l’entrée des églises catholiques et de ce fait a donné au « tridacne », son nom usuel de «bénitier». Toutefois, ce sont surtout les valves de Tridacna gigas qui sont utilisées. «Bénitier» vient de l’ancien français benoitier, puis benestier issu de eau benoitier lui-même dérivé de l’ancien français ewe benëeite, benëoite.
gaufré : les écailles (ou scutelles*) caractéristiques de cette espèce sont à l'origine de ce mot.
Tridacna : le zoologiste et médecin français Jean Guillaume Bruguière (1750-1798) ne donne pas d'explication. Ce nom de genre latin vient du grec [tridakna], [tri] = trois et [dakn] = mordre, Cailleux et Komorn (1981) traduisent ce mot par "qu'il faut mordre trois fois ". On trouve également "dont on fait trois bouchées". Tridacna a été utilisé par le scientifique romain Pline l'ancien (23-79) pour des coquillages de très grande taille (comme des huîtres par exemple). Un des noms espagnols de la grande nacre est : tridacna.
squamosa : du latin [squamosa] = squameux c'est-à-dire couvert d'écailles.
Numéro d'entrée WoRMS : 207674
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Bivalvia / Lamellibranchia / Pelecypoda | Bivalves / Lamellibranches / Pélécypodes | Mollusques aquatiques, filtreurs, au corps comprimé latéralement. Coquille composée de 2 valves articulées disposées de part et d’autre du plan de symétrie. Absence de tête, de pharynx, de radula et de glande salivaire. |
| Sous-classe | Autobranchia | Autobranches | |
| Infra-classe | Heteroconchia | Hétéroconchie | |
| Subter-classe | Euheterodonta | Euhétérodonte | |
| Super ordre | Imparidentia | Imparidenties | |
| Ordre | Cardiida | Cardiides | |
| Super-famille | Cardioidea | ||
| Famille | Cardiidae | Cardiidés | Coquille fermée en forme de cœur. Côtes radiales fortes avec parfois présence de longs tubercules. Bord des valves crénelé. |
| Sous-famille | Tridacninae | Tridacninés | |
| Genre | Tridacna | ||
| Espèce | squamosa |
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Dans son environnement corallien
Bien que la coquille
soit encroûtée, on distingue les écailles sur les côtes radiales. Le
manteau recouvre le bord de la coquille.
Mayotte, îlot de la Prévoyance, 9 m
10/05/2012
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Tridacna squamosa
Le manteau est lisse avec quelques papilles et de nombreux motifs colorés. le siphon exhalant est visble mais pas le siphon inhalant.
île d'Ouvea, îles Loyauté, 12-15 m.
2015


un individu de belle taille
La coquille est également
recouverte d’épibiontes, mais les écailles sont bien visibles.
Mayotte, Passe en S, 5 m
14/05/2012
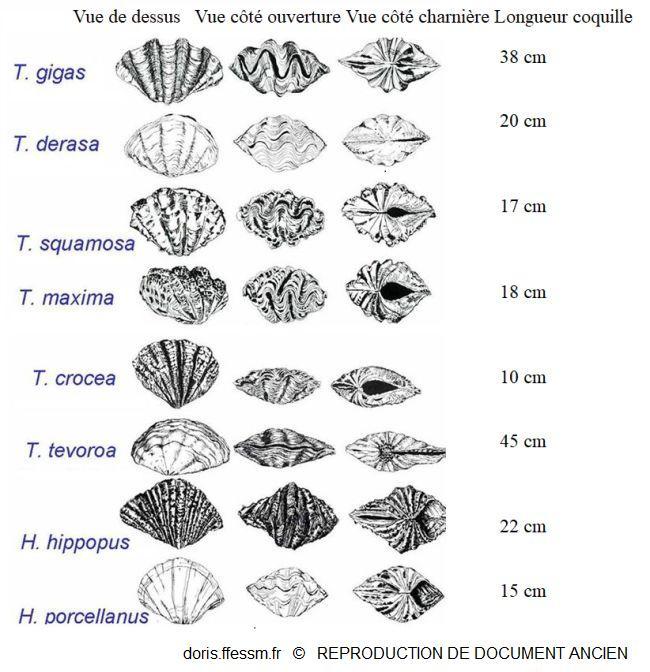
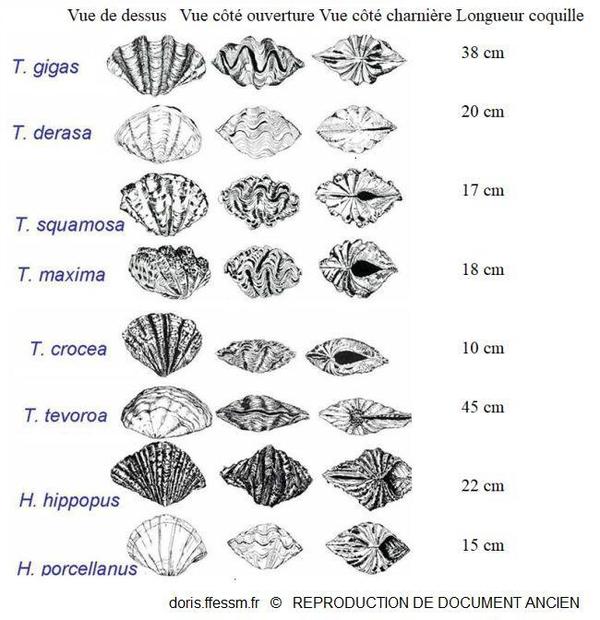
Quelques espèces de bénitiers
T. tevoroa = T. mbalavuana.
Sur cette planche, T. noae, T. elongatissima, T. squamosina et T. rosewateri ne sont pas représentés.
D’après les planches 13 (page 19) et 14 (page 20) de Norton et Jones, 1992
Reproduction de documents anciens
1992
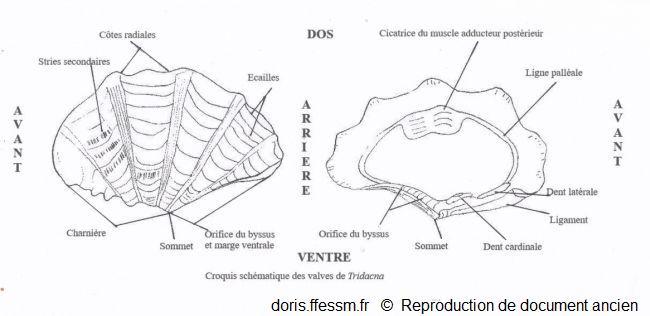
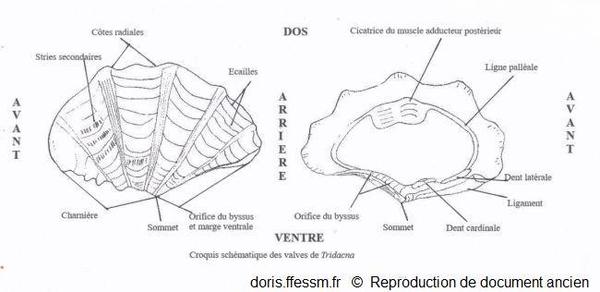
Schéma des valves de Tridacna
Ce schéma présente quelques caractéristiques des coquilles des bénitiers.
Schéma modifié d'après la planche 266 page 350 de Rosewater 1965
Reproduction de documents anciens
1965
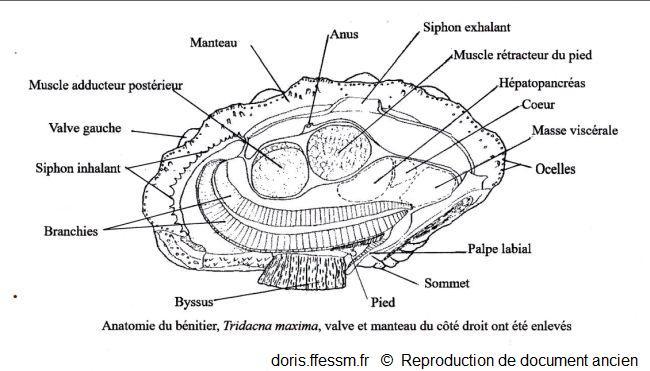
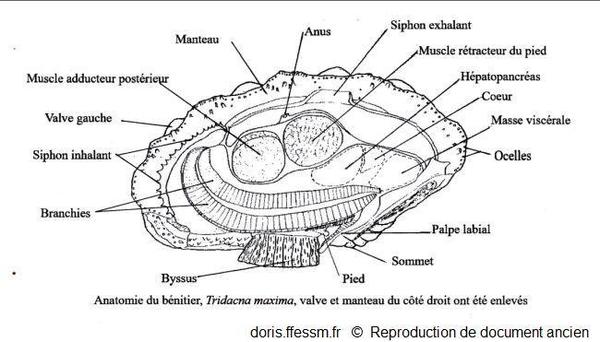
L'anatomie de Tridacna maxima est identique à celle de T. squamosa
La valve et le manteau du côté droit ont été enlevés.
Schéma modifié d'après la planche 269 (page 352) de Rosewater, 1965
Reproduction de documents anciens
1965
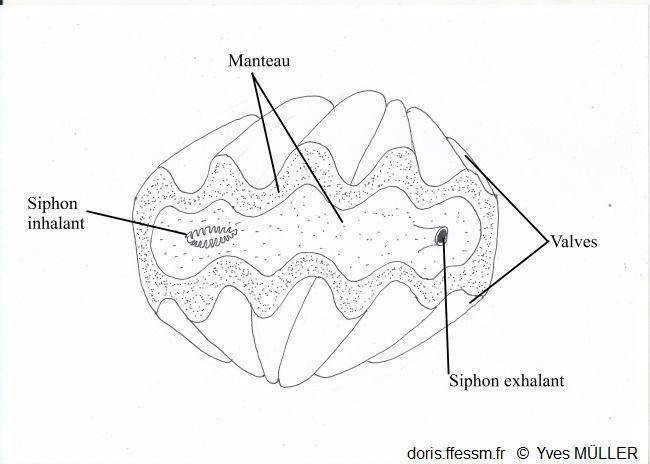
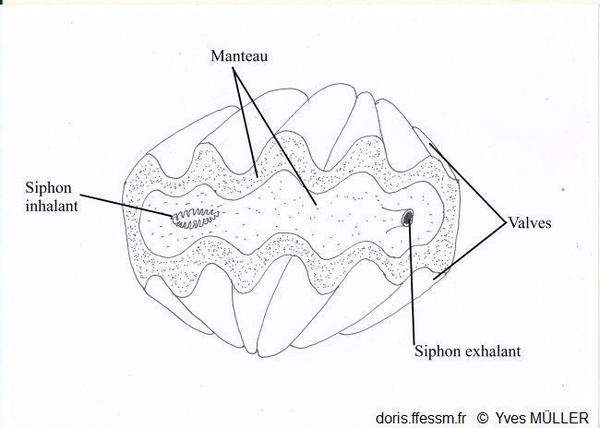
Un bénitier vivant vu de dessus
Le manteau et les siphons vus par-dessus.
Dessin
03/02/2023

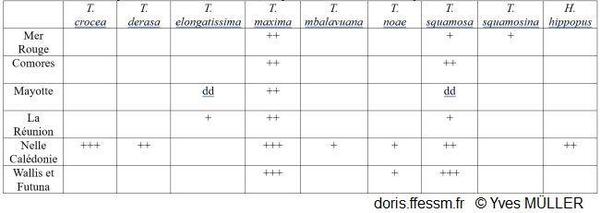
Distribution des bénitiers dans les domaines géographiques utilisés dans DORIS
+++ = abondant, ++ = fréquent, + = rare, dd = données déficientes.
D’après Neo & al 2017 et Fauvelot C (com. pers).
21/11/2023
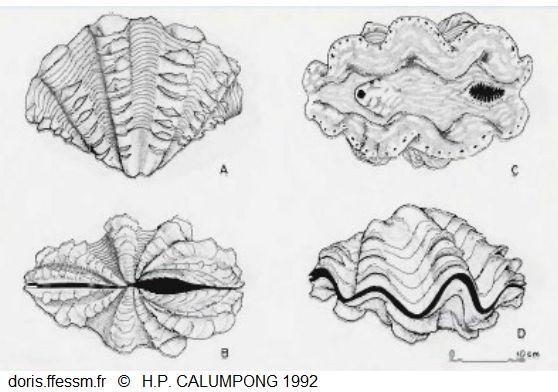
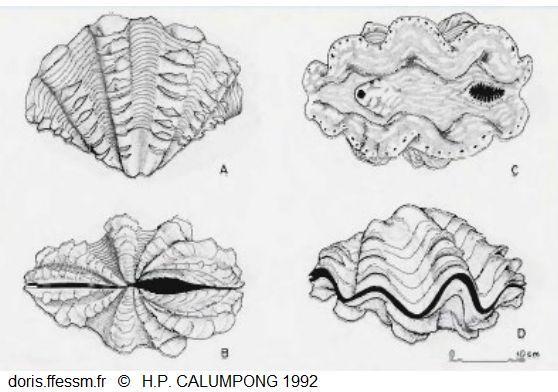
Dessins de Tridacna squamosa
A : vue latérale
B : vue du côté de la charnière
C : vue de dessus, à droite le siphon inhalant, à gauche le siphon exhalant
D : coquille fermée.
Dessins de H.P. Calumpong, 1992
Reproduction de documents anciens
1992
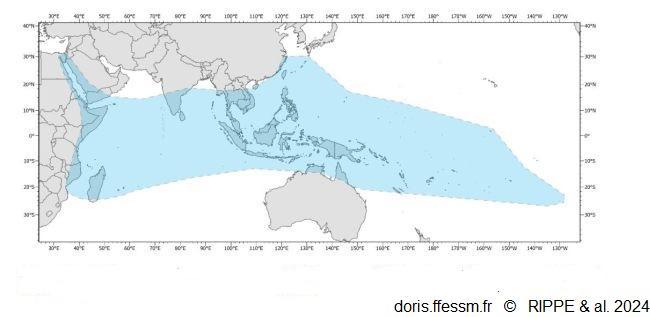
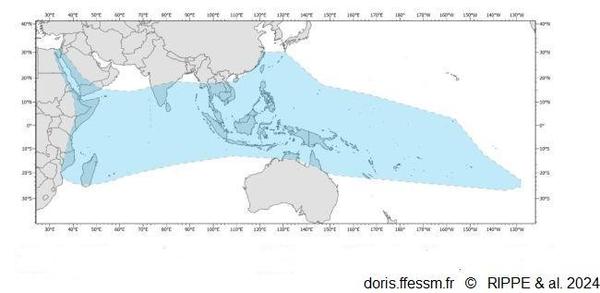
Aire de répartition de Tridacna squamosa
Les aires où Tridacna squamosa a été réintroduit
n'ont pas été reportées sur la carte.
Fig 32 page 177 in
Rippe & al.
Reproduction de documents anciens
2024
Rédacteur principal : Yves MÜLLER
Rédacteur : Cécile FAUVELOT
Vérificateur : Lucie PENIN
Responsable régional : Yves MÜLLER
Andréfouët S., Van Wynsberge S., Fauvelot C., Bruckner A. W., Remoissenet G., 2014, Significance of new records of Tridacna squamosa Lamarck, 1819, in the Tuamotu and Gambier archipelagos (French Polynesia), Molluscan Research, 34, 277–284.
Beckvar N., 1981, Cultivation, spawning, and growth of the giant clams Tridacna gigas, T. derasa, and T. squamosa in Palau, Caroline islands, Aquaculture, 24, 21-30.
Calumpong H.P., 1992, The giant clam:
an ocean culture manual, Australian Centre for International
Agricultural Research, Monograph N°16, 68p.
Carlos A.A., Baillie B.K., Kawachi M.,Maruyama T., 1999, Phylogenetic position of Symbiodinium (Dinophyceae) isolates from tridanids (bivalvia), Cardiids (Bivalvia), a sponge (Porifera, a soft coral (Anthozoa), and a free-living strain, Journal of Phycology, 1054-1062.
Fankboner P. V., 1981, On the siphonal eyes of giant clams (Bivalvia, Tridacnidae) and their relationship to adjacent zooxanthellae, The Veliger, 23, 245-249.
Fatherree J.W., 2002, Identifying the Tridacnid clams, Reefkeeping, 7.
Fauvelot C., Zucco D., Borsa P., .Grulois D., Magalon H., Riquet F., Andréfouët S.,. Berumen M. L, Sinclair-Taylor T. H., Gélin P., Behivoke F., ter Poorten J.J., Strong E. E., Bouchet P., 2020, Phylogeographical patterns and a cryptic species provide new insights into Western Indian Ocean giant clams phylogenetic relationships and colonization history, Journal of Biogeography, 47, 1086–1105.
Fitt W.K., Trench R.K., 1981, Spawning, development and acquisition of zooxanthellae by Tridacna squamosa (Mollusca, Bivalvia), Biological Bulletin, 161, 213-235.
Huelsken T., Keyse J., Liggins L., Penny S., Treml E.A., Riginos C., 2013. A novel widespread cryptic species and phylogeographic patterns within several giant clam species (Cardiidae : Tridacna) from the Indo-Pacific Ocean. PLoS ONE 8, e80858.
Jantzen C., Wild C., El-Zibdah M., Roa-Quiaoit H.A., Haacke C., Richter C., 2008, Photosynthetic performance of giant clams, Tridacna maxima and T. squamosa, Red Sea, Marine Biology, 155, 211–221.
LaBarbera M., 1975, Larval and post-larval development of the giant clams Tridacna maxima and Tridacna squamosa (Bivalvia : Tridacnidae), Malacologia, 15(1), 69-79.
Neo M.L. , Eckman W., Vicentuan K., Teo S.L.M. , ToddP.A., 2015, The ecological significance of giant clams in coral reef ecosystems, Biological Conservation, 181, 111-123.
Neo M.L., Wabnitz C.C.C., Braley R.D., Heslinga G.A., Fauvelot C., Wynsberge S. van, Andréfouët S., Waters C., Tan A. S-H.,Gomez E.D., Costello M.J., Todd P.A., 2017,Giant clams (Bivalvia: Cardiidae: Tridacninae): a comprehensive update of species and their distribution, current threats and conservation status. Chapter 4 Oceanography and marine Biology, An Annual Review, volume 55 in Hawkins S.J., Evans A.J., Dale A.C., Firth L.B., Hughes D.J., Smith J.P.302p.
Othman A.S.bin, Goh G.H.S., Todd P.A., 2010, The distribution and status of giant clams (family Tridacnidae) – a short review, The Raffles Bulletin of Zoology, 58(1), 103-111.
Ramah S., Kaullysing D.,Bhagooli R., 2021, First in-situ observation of the endemic giant clam Tridacna rosewateri from the Nazareth Bank, Mascarene Plateau. Western Indian Ocean, Journal of Marine Science, (2/2021), 193-196.
Rippe J.P., Young C.N., Maison K., Stout,C., Doss S., 2024, Status Review Report of Seven Giant Clam Species Petitioned under the U.S. Endangered Species Act: Hippopus hippopus, H. porcellanus, Tridacna derasa, T. gigas, T. mbalavuana, T. squamosa, and T. squamosina. Draft report to the National Marine Fisheries Service, Office of Protected Resources, 283 p.
Rosewater J., 1965, The family Tridacnidae in the Indo-Pacific, Indo-Pacific Mollusca, 1(6), 347-396. 22 (261), 4-9.
Yonge C.M., 1936, Mode of life, feeding, digestion and symbiosis with zooxanthellae in the Tridacnidae, Scientific Reports Great Barrier Reef Expedition British Museum, 1, 283–321.
Yonge C.M., 1975, Giant clams, Scientific American, 232(4), 96-105.
Yonge C. M., 1982, Functional morphology and evolution in the Tridacnidae (Mollusca: Bivalvia: Cardiacea). Records of the Australian Museum, 33(17), 735–777,
La page de Tridacna squamosa dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.