Corps allongé très comprimé latéralement
Quatre bandes bleu électrique entre les yeux
Couleur beige grisâtre à verdissant avec abdomen blanc et barres obliques blanches sur les flancs
Tache blanche avec trois rangs d’épines noires à l’arrière du corps
Première dorsale en forme d’épine érectile noire
Blackbar triggerfish, white banded triggerfish, white barred triggerfish, prickly filefish, lagoon triggerfish, painted trigger(GB), Pesce balestra picasso (I), Picassofisch, Drückerfische Picasso (D), Gona (Kenya), Swartbalk-snellervis (Afrique du Sud), Tsontso (région de Toliara, Madagascar), Picassofish, bourse corail (Maurice), Gabulhi (Maldives), Pugot, pakol (Philippines), Humuhumu (Micronésie), Cumu tina ni gone (Fidji), Oiri uouo, kokiri (Polynésie française), Lagoon humu (Hawaï)
Balistes aculeatus Linnaeus, 1758
Balistapus aculeatus (Linnaeus, 1758)
Balistes ornatissimus Lesson, 1831
Balistes heteracanthus Bleeker, 1859
Monacanthus cherverti Alleyne et Macleay, 1877
Rhinecanthus aculeatus Smith, 1949
Rhinecanthus aculeatus aculeatus (Linnaeus, 1758)
Atlantique tropical Est, mer Rouge, Indo-Pacifique tropical
Zones DORIS : ● Indo-Pacifique, ○ [Mer Rouge]On trouve ce baliste en Atlantique Est, depuis le Sénégal jusqu'à l’Afrique du Sud. Il se rencontre également en mer Rouge, dans l’océan Indien et dans le Pacifique jusqu’aux îles Pitcairn.
Ce poisson est inféodé aux récifs. On le trouve dans les lagons, sur fonds sableux ou détritiques avec des massifs de corail dispersés, en zones abritées. Il se rencontre entre 0 et 50 m mais plus souvent entre 0 et 10 m, dans des eaux à 25 °C de température moyenne. La profondeur maximale ne fait pas l’unanimité : certains auteurs la situent à 10 m, d’autres à 20. Les juvéniles fréquentent les très faibles profondeurs, les plus petits se trouvent souvent au plus près du rivage.
Le corps est allongé et fortement comprimé latéralement. Il peut atteindre 30 cm de longueur totale (longueur avec la queue), la moyenne étant de 15 cm. Son aspect est lisse malgré une peau couverte d’écailles modifiées en plaques osseuses juxtaposées.
La couleur de fond est beige grisâtre à verdissant.
Une large tache noire plus ou moins prononcée est située au centre du corps. Le dos est marqué par une zone sombre autour de la première dorsale et par deux barres reliant la tache noire centrale à la seconde dorsale. La première barre est rouille à noire et rejoint le début de la nageoire, la seconde est noirâtre et rejoint sa fin. On distingue donc parfaitement deux zones claires sur le haut du dos de ce poisson.
La gorge est blanche, ainsi que la partie ventrale jusqu’à une ligne oblique reliant la tache noire à l’anus. Au-delà, la partie ventrale porte quatre barres obliques blanches. Ces motifs partent de la ligne médiane et sont orientés vers la nageoire anale.
L’arrière du corps porte une longue marque blanche allant jusqu’au pédoncule caudal, sur laquelle se situent trois rangées d’épines noires en forme de griffes orientées vers l’avant. Les deux premières lignes portent 9 à 14 épines, la troisième, située sous les autres et occupant le pédoncule caudal, en porte 3 à 7. Il arrive que quelques épines isolées s’ajoutent de part et d’autre des extrémités de ces alignements.
La tête, très longue, fait environ un tiers du corps. La bouche est terminale, petite et non protractile. Les lèvres sont épaisses et jaunes. La lèvre supérieure est surlignée d’un arc de cercle bleu clair tranchant sur une longue moustache jaunâtre puis orange qui descend jusque sous les pectorales, où elle rejoint une ligne noire venue de la tache centrale. Le museau est crème à verdâtre au-dessus de cette moustache, blanc en dessous. Quatre larges lignes bleu électrique sur fond noir relient les yeux sur le front. Trois d’entre elles, plus fines, poursuivent sous l’œil jusqu’aux pectorales. Les deux premières entourent une zone vert clair, la dernière borde une zone vert foncé à noire. Deux paires de narines presque invisibles se situent sur le bord antérieur de la première ligne frontale. Les yeux sont haut placés, indépendants et proéminents. La protubérance charnue qui les protège est coiffée par une calotte ocre à orange mais elle peut aussi être beige ou gris violacé ; l’iris* est doré autour de la pupille, et ocre ou gris au-delà. Les opercules sont réduits à une petite fente au-dessus des pectorales.
La première dorsale est constituée de trois rayons dont les deux premiers constituent un dispositif de blocage : le second rayon, plus court, est conçu pour verrouiller en position érigée le premier, qui est long, résistant, incurvé par un sillon postérieur et couvert de petites épines lui donnant un air cranté sur sa face antérieure. En position de repos, l’ensemble est logé dans un sillon ménagé au sommet du dos. La seconde dorsale comporte 23 à 26 rayons mous et l’anale 21 à 23 rayons mous. Elles sont situées en arrière du corps et approximativement symétriques. Elles sont translucides, de même que les pectorales et la caudale. Cette dernière est arrondie. Les pelviennes sont inexistantes et remplacées par une épine enkystée sur la quasi-totalité de sa longueur dans une poche qu’elle peut distendre en se dressant. L’extrémité de l’épine est couverte de très petites aspérités.
Il existe d'autres balistes qui sont appelés picasso (Rhinecanthus assasi, R. verrucosus, R. lunula, R. rectangulus, etc.) mais la livrée spectaculaire de Rhinecanthus aculeatus empêche qu’il soit confondu avec une autre espèce, même au sein de son propre genre. Aucune n'a une tache centrale noire et quatre barres obliques blanches sur les flancs.
Il est essentiellement carnivore, mais peut avoir à l’occasion des comportements omnivores : il peut se nourrir de crustacés, de vers, de coquillages, d’ophiures, d’oursins, de siponcles, de mollusques divers, de petits poissons, d’œufs, de coraux, d’algues, de détritus, de plantes marines, de tuniciers, de foraminifères, etc. Il trouve ses proies en bousculant les petits blocs et en arpentant les roches, mais principalement en fouillant le sable, sur lequel il peut projeter de l’eau pour les débusquer. Le sable vidé de ses occupants ressort ensuite par les opercules en une longue traînée pendant que l’animal cherche une nouvelle occasion.
Rhinecanthus aculeatus atteint sa maturité sexuelle entre 8 et 14 cm. Les sexes sont séparés. Le territoire du mâle contient celui de deux à trois femelles, parfois davantage. Les deux sexes participent à sa défense. On a constaté qu’un même territoire peut être conservé plus de 8 ans.
La ponte a lieu le matin, autour des nouvelles ou des pleines lunes, les femelles pondent plusieurs fois dans la période. Le nombre d’œufs est faible (une étude indienne donne une fourchette de 936 à 7262 œufs), probablement du fait de la protection maternelle qui limite la prédation sur les œufs : les pontes massives en vue d’optimiser le nombre d’éclosions ne sont donc pas nécessaires. Ils sont fixés dans un nid préparé sur le substrat (sable ou détritus) et sont fertilisés aussitôt. Contrairement à ce qui se passe dans de nombreuses espèces pratiquant la fertilisation externe, ce sont les femelles qui défendent leurs œufs. Elles doivent aussi les ventiler avec leurs pectorales. Ils éclosent le soir du même jour après le coucher du soleil, la femelle protège quelque temps encore les larves*. Le mâle ne participe pas à la protection des œufs ni des larves.
Les larves sont compétentes dès la naissance (vision et capacités natatoires et d’orientation). Elles sont argentées en fin de phase pélagique* et mesurent environ 1,2 cm à la colonisation*. Quatre jours après l’installation*, elles ont l’abdomen blanc et le reste du corps grisâtre avec des lignes noires très espacées sur le front et la nuque, et quelques motifs en barres diagonales à peine suggérés. Puis le haut du corps devient jaune verdâtre, la tache noire centrale apparaît ainsi que de minuscules épines le long du pédoncule caudal et on distingue une bande gris-vert de la bouche aux pectorales (qui deviendra la « moustache » jaune-orange). Le premier rayon de la première dorsale fait presque la moitié de la hauteur du corps (environ un tiers chez les adultes). La forme des motifs se précise, mais il n’y a pas encore de couleurs. La livrée des adultes commence par la « moustache » jaune et la barre oblique rouille sur le dos. Les motifs bleus sur le front, où les barres noires ont épaissi et pris leur place définitive, viennent ensuite avec les motifs en lignes blanches. Quand la livrée complète de l’adulte est réalisée, les petits juvéniles y ajoutent une tache bleu vif autour de l’anus (qui diminuera et sera entourée de noir). Le jeune adulte a proportionnellement le corps moins long et plus haut que l’adulte achevé.
Des observations expérimentales montrent que les larves sont capables de changer de couleur pour imiter celle de leur environnement. En situation expérimentale, on a pu aussi prouver qu’elles utilisent l’odorat pour identifier les signaux chimiques émis par les adultes de leur espèce (conspécifiques), ce stimulus déterminant le lieu de l’installation sans que les autres canaux sensoriels soient sollicités. L’auteur de l’étude reconnaît que les contraintes de l’expérience et le stress qu’elles induisent peuvent influer sur ses résultats. Des observations in situ montrent que les larves peuvent s’installer régulièrement dans des lieux que les conspécifiques adultes ne fréquentent jamais comme le bord orienté vers le rivage d’un beach-rock (grès de plage*), où les petits juvéniles restent dans les vasques à marée basse et où la densité de prédateurs est très faible à marée haute, par exemple. Une expérience d’élevage faite à La Réunion a établi un taux de survie en élevage de 87% à 196 jours.
Rhinecanthus aculeatus peut être parasité notamment par des protozoaires parasites du sang comme Haemogregarina balistapi, probablement transmis par un ectoparasite, un crustacé isopode de la famille des Gnathiidae comme Gnathia aureamaculosa.
C’est un animal très territorial et agressif qui passe beaucoup de temps à combattre ses congénères comme les autres espèces aux frontières de son domaine, notamment en période de reproduction, où il peut même attaquer les nageurs. Il commence généralement alors par multiplier des attaques d’intimidation rapides qui s’arrêtent à une cinquantaine de centimètres de l’intrus, puis, si celui-ci persiste, il le contourne pour venir tenter de le mordre par derrière. En dehors des périodes de reproduction, il est solitaire et nettement moins agressif. Les balistes passent par ailleurs pour être plutôt plus intelligents que la moyenne des poissons.
Malgré son aspect lisse, ce poisson porte des écailles armées de petits tubercules en leur centre, ce qui rend son contact rugueux.
Sa dentition est composée de 8 fortes dents sans espacement sur chaque mâchoire. La mâchoire supérieure porte de surcroît 6 dents pharyngiennes plates servant de contrefort aux premières dents. Les dents sont à croissance continue, le bris de coquilles ou de carapaces permet leur usure.
Comme tous les balistes, il se propulse par des ondulations synchronisées de la dorsale et de l’anale, la queue servant à produire les accélérations nécessitées par la situation. Ce type de propulsion commun aux Balistidés (Balistidae) est parfaitement adapté à un environnement corallien, dans la mesure notamment où il permet de faire du surplace ou machine arrière, et de tourner sur un faible rayon ou même de pivoter sur son axe. Il est de surcroît économe en énergie. Le système de propulsion MPF (median paired fin) a été étudié sur Rhinecanthus aculeatus en vue de produire un robot sous-marin destiné à l’exploration des ressources minérales océaniques, il est considéré comme plus stable et manœuvrable que les robots conventionnels. Les aspects morphologiques et cinématiques de l’animal sont conservés dans le projet.
La première dorsale constitue un système à cran d’arrêt : la partie antéro-basale de la seconde épine vient se loger dans le sillon postérieur de la première et la verrouille ainsi en position érigée. Le déverrouillage se fait par l’abaissement de la seconde épine. Ce système permet à l’animal de ne pas être extrait par un prédateur de l’anfractuosité dans laquelle il se serait réfugié, et sans doute aussi de résister aux courants, notamment pendant son sommeil (il dort dans un trou, couché sur le flanc). L’épine pelvienne, érectile, participe de cette fonction. L’érection de la première dorsale sert aussi à l’intimidation, celle de l’épine pelvienne s’y ajoutant si la manœuvre n’a pas été suffisante.
Les juvéniles se précipitent dans un trou d’une roche ou d’un bloc de corail mort quand ils sont poursuivis, et y restent bloqués même si la pierre est soulevée. Les adultes préfèrent le plus souvent fuir ou attaquer, mais ils utiliseront la même méthode s’ils sont poursuivis par un adversaire obstiné. Ils peuvent pâlir quand ils sont inquiétés, la tache noire devenant d’un gris clair très diffus, et toutes les couleurs s’atténuant, notamment derrière la tête.
Ce poisson peut être bruyant : il émet des grognements quand il est effrayé ou se sent menacé, et il produit des sortes d’éternuements quand il est sorti de l’eau. Les grognements sont produits par l’action des muscles intercostaux sur deux os des pectorales, la vessie natatoire faisant caisse de résonance. De là lui vient son nom vernaculaire hawaïen, Humu-humu-nuku-nuku-apu'a, qui signifie « poisson qui sort de l’eau en grognant comme un porc ».
Au niveau de la vision, il a été démontré que l’une des fonctions des doubles cônes, présents dans l'œil de Rhinecanthus aculeatus, lui permettait une vision trichromatique semblable à la vision humaine.
Son premier nom, Balistes aculeatus, lui a été donné par Linné en 1758, qui le décrit dans le Systema Naturae, dixième édition, tome I. La localité du type est l’Inde.
Son nom vernaculaire anglais part de la même inspiration que le nom français « baliste » : le terme anglais est « triggerfish », le mot « trigger » signifiant gâchette. La gâchette est la pièce interne du mécanisme d’une arme à feu qui arme le percuteur et que libère une pression sur la détente (souvent confondue avec la gâchette) : l’analogie concerne alors le mouvement du percuteur, ou le fait qu’il suffise d’appuyer sur le second rayon de la dorsale pour déverrouiller le premier.
Rhinecanthus aculeatus est parfois présenté comme l’emblème national de l’Etat de Hawaï, par une confusion due au nom vernaculaire hawaïen (Humu-humu-nuku-nuku-apu'a), qui est aussi celui de Rhinecanthus rectangulus. C’est pourtant bien la seconde espèce, R. rectangulus, qui est l’emblème de Hawaï.
Séché, il pouvait servir aux anciens Hawaïens de combustible pour la cuisine, quand les combustibles ordinaires manquaient. On rapporte aussi qu’il servait de substitut au porc dans des cérémonies religieuses.
Considéré comme une ressource halieutique mineure, il a cependant une forte valeur commerciale dans le commerce aquariophile. Sa livrée spectaculaire, mais aussi sa robustesse et la facilité de sa maintenance, notamment au niveau de la nourriture, le font rechercher par les amateurs malgré son agressivité.
Ce baliste est encore assez abondant, mais la dégradation de nombreux écosystèmes récifaux du fait de facteurs humains et abiotiques* fait craindre une diminution importante de ses populations à terme.
Baliste picasso clair :
Le mot baliste vient du latin [balista], ou [ballista], qui désigne une sorte de catapulte, un engin de guerre servant à lancer des projectiles divers en propulsant un bras fixé à un axe d’une position horizontale à une position verticale. L’allusion renvoie soit à la façon dont le premier rayon de la première dorsale se dresse chez Rhinecanthus aculeatus, qui peut être comparée au mouvement du bras de la baliste à l’occasion du tir, soit au système de verrouillage/déverrouillage que la machine de guerre comporte aussi.
Picasso : il s’agit bien sûr du nom d’un des grands peintres français du XXème siècle, Pablo Ruiz Picasso (1881-1973). Il fut le fondateur du cubisme et est considéré à ce titre comme l’un des maîtres de la peinture abstraite, sa notoriété dépassant largement le cercle des amateurs d’art. Il évoque ainsi pour le grand public la peinture abstraite en général. Les motifs de la livrée de Rhinecanthus aculeatus semblent tracés à grands coups de pinceau, avec des couleurs aux contrastes violents et sans intention particulière du côté de la signification : ils paraissent donc créés par un peintre abstrait, d’où l’utilisation du nom du plus célèbre d’entre eux. Il serait cependant difficile de trouver dans l’œuvre de Picasso des toiles susceptibles de justifier le rapprochement.
Plusieurs balistes sont nommés "balistes picasso" et l'adjectif clair le distingue donc des autres.
Rhinecanthus : le sens du mot est incertain, dans la mesure où le descripteur du genre, Swainson, n’a pas motivé le choix du nom. Il résulte d’une composition de racines grecques : [rhino-] qui signifie nez, et [kanthos] qui désigne le cerclage de fer d’une roue, ou [kanthiai], qui signifie « gros paniers ». Du côté de l’interprétation, on peut se risquer à privilégier [kanthos] dans la mesure où toutes les espèces du genre Rhinecanthus possèdent une selle qui passe sur le museau au niveau des narines et descend jusqu’aux pectorales ; le sens serait alors « au nez cerclé », ou « bardé ».
aculeatus : le mot latin signifie « qui a des piquants, pointu ». Il peut donc renvoyer à la première épine de la première dorsale du poisson, à l’épine pelvienne, à celles qui arment la partie postérieure de son corps, ou à l’ensemble.
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Chordata | Chordés | Animaux à l’organisation complexe définie par 3 caractères originaux : tube nerveux dorsal, chorde dorsale, et tube digestif ventral. Il existe 3 grands groupes de Chordés : les Tuniciers, les Céphalocordés et les Vertébrés. |
| Sous-embranchement | Vertebrata | Vertébrés | Chordés possédant une colonne vertébrale et un crâne qui contient la partie antérieure du système nerveux. |
| Super classe | Osteichthyes | Ostéichthyens | Vertébrés à squelette osseux. |
| Classe | Actinopterygii | Actinoptérygiens | Ossification du crâne ou du squelette tout entier. Poissons épineux ou à nageoires rayonnées. |
| Sous-classe | Neopterygii Teleostei | Néoptérygiens Téléostéens | Poissons à arêtes osseuses, présence d’un opercule, écailles minces et imbriquées. |
| Super ordre | Acanthopterygii | Acanthoptérygiens | Rayons épineux aux nageoires, écailles cycloïdes ou cténoïdes, présence d'une vessie gazeuse et pelviennes thoraciques ou jugulaires, sans être systématiquement présents, sont des caractères que l'on ne rencontre que chez les Acanthoptérygiens. |
| Ordre | Tetraodontiformes | Tétraodontiformes | Groupe hétérogène mais absence d'écailles imbriquées, ouvertures branchiales réduites, bouche très peu fendue, pelviennes anormales ou absentes. |
| Sous-ordre | Tetraodontoidei | Tétraodontoïdes | Mâchoires et dents transformées en "bec de perroquet". |
| Famille | Balistidae | Balistidés | La première épine de la première nageoire dorsale peut se bloquer en position verticale. |
| Genre | Rhinecanthus | ||
| Espèce | aculeatus |
 Poissons osseux nageant près du fond
Poissons osseux nageant près du fond

Dans le lagon
Ce poisson est inféodé aux récifs et on le trouve souvent, comme ici, dans les lagons, sur fonds sableux ou détritiques avec des massifs de corail dispersés...
Lagon de l'Ermitage, La Réunion, 1,5 m
12/03/2011
 Poissons osseux nageant près du fond
Poissons osseux nageant près du fond

Tête
La tête, très longue, fait environ un tiers du corps. La bouche est terminale et petite, avec d'épaisses lèvres jaunes. Celles-ci sont surlignées d’un arc de cercle bleu clair tranchant sur une longue moustache jaunâtre puis orange qui descend jusque sous les pectorales, où elle rejoint une ligne noire venue de la tache centrale.
Quatre larges lignes bleu électrique sur fond noir relient les yeux sur le front. Trois d’entre elles, plus fines, poursuivent sous l’œil jusqu’aux pectorales.
Lagon de Saint-Leu, La Réunion, 1,20 m
10/12/2006


De face
Le corps est très comprimé, la vue de face avec les épines dorsales et pelvienne érigées fait au poisson une morphologie très particulière dans cette perspective. L’attitude est menaçante mais elle n’implique pas qu’une charge lui succède. Les charges en période de reproduction sont directes et ne passent pas par une intimidation préalable.
Lagon de l'Ermitage, La Réunion, 1,5 m
10/04/2011


Dentition
Ce baliste porte huit fortes dents incisiformes sur chaque mâchoire.
Le spécimen photographié a été trouvé mort, d’où la forme anormalement relâchée de la lèvre inférieure, notamment.
Lagon de l'Ermitage, La Réunion, 1,50 m
25/03/2012


Epines dorsale et pelvienne érigées
Le comportement d’intimidation commence par l’érection de l’épine dorsale, lui succède celle de l’épine pelvienne si la première démonstration n’a pas suffi.
Lagon de l'Ermitage, La Réunion, 1,5 m
10/04/2011


Epine dorsale
Au repos, le système de verrouillage de la première dorsale est logé dans un sillon. On voit ici la face antérieure du premier rayon, avec ses tubercules lui donnant un aspect cranté. Sa face postérieure est creuse, ce qui permet au second rayon de se placer dans ce sillon pour verrouiller la position érigée du premier rayon.
Lagon de l'Ermitage, La Réunion, 1,5 m
02/02/2011


Enkysté dans un trou
Ce poisson pourchassé se cachera dans un trou où il se bloquera avec l’épine dorsale, et s’il le faut la pelvienne, pour empêcher qu’on ne l’en sorte.
Lagon de l'Ermitage, La Réunion, 1,5 m
29/12/2009


Rangs d’épines postérieures
Trois rangées d’épines en forme de griffes orientées dans le sens de la nage arment des deux côtés l’arrière du corps.
Quelques épines éparses s’ajoutent parfois de part et d’autre des extrémités, mais on peut voir ici un quatrième rang assez organisé, ce qui n’est pas fréquent.
Lagon de l'Ermitage, La Réunion, 1,5 m
09/02/2011


Zone anale
Une tache bleu vif orne l’anus des juvéniles, elle est réduite et entourée de noir chez l’adulte.
Lagon de l'Ermitage, La Réunion, 1,5 m
20/04/2011


Ecailles
Les écailles de Rhinecanthus aculeatus portent plusieurs séries en ligne de petits tubercules pointus qui le rendent particulièrement rugueux au toucher.
La Réunion
25/03/2012


Croissance des juvéniles
Voici rassemblé ici de quoi illustrer la croissance des juvéniles de Rhinecanthus aculeatus.
A : Larve peu après l’installation, les couleurs sont encore absentes et les motifs sont à peine suggérés
B : Les motifs se dessinent, la tache noire centrale s’affirme, la bande grisâtre sous le menton qui annonce la moustache jaune a ici commencé à jaunir. Les rangées d’épines à l’arrière du corps apparaissent, mais il n’y a pas encore de couleurs.
C : La moustache jaune et la barre oblique rouille sont les premières couleurs à apparaître. Leur succèdent immédiatement les barres bleues entre les yeux et les lignes qui en descendent, qui sont ici pour le moment blanches. Les obliques blanches à l’arrière deviennent visibles.
D : Quand le petit juvénile porte l’essentiel de la livrée achevée de l’adulte, il mesure autour de 4 cm.
Lagon de l'Ermitage, La Réunion, 1,5 m
2011


En chasse
Ce jeune individu fouille le sable à la recherche de nourriture. Il creuse en soufflant de l'eau, aspire le sable... Le menu peut être très diversifié.
Mangrove de Pantar, Archipel d'Alor (Petites îles de la Sonde), Indonésie, 2 m
10/04/2008


Rejet du sable aspiré
Le sable aspiré pour en prélever les occupants ressort par les opercules.
Lagon de l'Ermitage, La Réunion, 1,5 m
23/02/2011
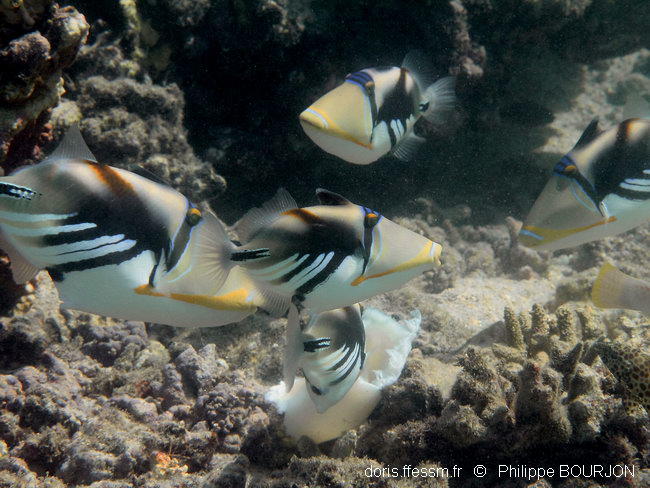

En groupe
Cinq balistes Picasso sont regroupés avec d’autres espèces autour de ce qui semble être le reste d’un manteau de poulpe. Il n’y avait aucune hostilité entre les participants au banquet, sans doute parce que la pièce était trop grosse pour être transportée et que la perspective de nourriture était assurée pour tous...
Lagon de l'Ermitage, La Réunion, 1,5 m
06/04/2011


Territorial
C’est un animal très territorial et agressif qui passe beaucoup de temps à combattre ses congénères comme les autres espèces aux frontières de son domaine, notamment en période de reproduction, où il peut même attaquer les nageurs.
Tahiti, Polynésie française, 5 m
02/04/2010


En colère !
Ce mâle patrouille sur son territoire en période de reproduction et n’apprécie pas la venue du photographe,... qui sera chargé. On note un pâlissement général des couleurs, et une disparition spectaculaire de la tache centrale et des bandes noires.
Lagon de l'Ermitage, La Réunion, 1,5 m
10/11/2012


Espèce récifale
C'est sur le récif, côté lagon ou côté extérieur, que l'on peut rencontrer le baliste picasso clair. On le voit ici au milieu de demoiselles à trois bandes noires Dascyllus aruanus.
Maldives, 4 m
18/03/2009


A Mayotte
Voici un individu surpris en face de la plage de N'Gouja, au sud-ouest de Mayotte.
N'Gouja, Mayotte, 1 m
09/12/2008

Rédacteur principal : Philippe BOURJON
Vérificateur : Alain-Pierre SITTLER
Responsable régional : Alain-Pierre SITTLER
Durville P., Bosc P., Galzin R., Conand C., 2003, Aptitude à l’élevage des post-larves de poissons coralliens, Ressources marines et commercialisation, Bulletin de la CPS, 11, 19-30.
Junker M., 2005, Approvisionnement en larves de poissons du lagon de Wallis (Pacifique Sud), Thèse de Doctorat, Université de la Nouvelle-Calédonie (LERVEM), 286p.
Kuwamura T., 1997, Evolution of female egg care in haremic Triggerfish, Rhinecanthus aculeatus, Ethology, 103, 12, 1015-1023.
Lecchini D., 2004, Étude expérimentale sur les capacités sensorielles des larves de poissons coralliens dans la détection de leur lieu d’installation, Elsevier SAS, C. R. Biologies 327, 159–171.
Loofbourrow H., 2006, Hydrodynamics of balistiform swimming in the Picasso triggerfish, Rhinecanthus aculeatus, BSc. University of British Columbia, 103p.
Maamaatuaiahutapu M., Remoissenet G., Galzin R., 2006, Guide d’identification des larves de poissons récifaux de Polynésie française, Éditions Téthys, 104p.
Matsuura K., 1979, Philogeny of the superfamily Balistoidea (pisces : Tetraodontiformes), Faculty of Fisheries, Hokkaido University, 169p.
McCormick M.I., Makey L., Dufour V., 2002, Comparative study of metamorphosis in tropical reef fishes, Marine Biology, 141(5), 841–853.
Waqalevu V. P., 2009, Capture, identification and culture techniques of coral reef fish larvae (French Polynesia), University of the South Pacific, School of Marine Studies, Laucala Campus, Fiji, CRISP, 21p., Annexe 3.
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.