Tube parcheminé de section cylindrique, opaque et en forme de U
Partie centrale du tube enfouie et deux extrémités libres dressées sur 10 cm environ
Corps caché dans le tube, mou et très fragile
Corps épais de grande taille à 3 régions très différenciées
Corps de coloration verdâtre ou blanc jaunâtre
2 courts palpes filiformes
Chétoptère, chétoptère de Valenciennes
Parchment worm (GB), Perkamentworm, perkamentkokerworm (NL), Pergamentwurm (D)
Tricoelia variopedata Renier, 1804
Chaetopterus norvegicus M. Sars, 1835
Chaetopterus sarsi Boeck in Sars 1860
Chaetopterus sarsii Boeck in Sars, 1860
Chaetopterus insignis Baird, 1864
Chaetopterus leuckarti Quatrefages, 1866
Chaetopterus quatrefagesii Jourdain, 1868
Chaetopterus brevis Lespès, 1872
Chaetopterus variopedatus [auctt.]
Atlantique Nord Est, Méditerranée
Zones DORIS : ● Europe (côtes françaises), ○ [Méditerranée française], ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]Le grand chétoptère vit dans les habitats côtiers peu profonds (Atlantique, Méditerranée).
Les tubes de Chaetopterus
variopedatus sont présents dans les fonds, de sable ou de vase, peu profonds (jusqu’à 40 m), plus rarement en bas de la zone de balancement des marées. La
majeure partie du tube en forme de U est enfouie jusqu'à 15 cm de profondeur dans les sédiments.
Chaetopterus variopedatus supporte des variations
de salinité puisqu’il peut être observé dans des estuaires.
En profondeur il
peut vivre en milieu rocheux dans les crevasses et sous les rochers.
Il affectionne aussi les poches d'huîtres abandonnées.
Chaetopterus variopedatus vit dans un tube en forme de U dont les deux extrémités ont des ouvertures légèrement rétrécies. Les rétrécissements sont nettement plus marqués sur les tubes desséchés retrouvés en laisse de mer, ce qui explique sans doute les descriptions "anciennes" peu conformes à l'aspect in situ du tube des individus vivants. Ces extrémités dépassent d’une dizaine de centimètres du sédiment. Le tube membraneux, résistant, souple, est formé d’épais feuillets superposés, blanchâtres, opaques, parcheminés. Bien que les descriptions parlent de tube non annelé, il y a bien des anneaux irréguliers visibles, sans doute dus aux différentes phases de croissance du tube à ses extrémités. Les anneaux plus ou moins en biais correspondraient aux sutures des rajouts successifs de plaques parcheminées. Les tubes mesurent 15 à 25 cm de long pour 1,5 à 2,5 cm de diamètre (jusqu’à 85 cm pour 4 cm de diamètre).
Le corps épais, de grande taille (jusqu’à 25 cm de long) de cet annélide polychète est mou et fragile. Il reste caché dans le tube sans en sortir et ne s'approche pas des ouvertures, les tubes observés en plongée semblent donc toujours "vides". Il présente une coloration jaune verdâtre ou blanc jaunâtre. Trois parties sont nettement distinctes :
En plongée, les tubes souples d’autres grands vers polychètes peuvent évoquer ceux de Chaetopterus variopedatus. Le tube de Sabella spallanzanii est souvent bien plus long, celui de Sabella pavonina de taille similaire, mais dans les deux cas le tube est unique et le panache peut être très largement visible.
Parmi les tubes rigides de taille similaire, ceux blanchâtres des protules peuvent éventuellement évoquer ceux du grand chétoptère.
Il existe plusieurs genres et espèces dans la famille des Chaetoptéridés.
A l'exception de Chaetopterus, tous les membres de la famille construisent un tube plus ou moins droit orienté verticalement dans le substrat*. Ce tube contient une ou plusieurs cloisons perforées transversales. De plus les genres autres que Chaetopterus possèdent une paire de longs tentacules*.
Les genres Phyllochaetopterus et Spiochaetopterus comprennent des espèces de petite taille (quelques centimètres de longueur) et beaucoup plus minces qui habitent des tubes cornés, cylindriques, annelés, plus ou moins transparents. L’espèce Mesochaetopterus sagittarius (Claparède, 1870), elle, habite un tube parcheminé mais mesure 2-3 cm de long pour 1 mm de large.
L'espèce Mesochaetopterus rogeri est bien différente par ces deux longs tentacules.
L’espèce Chaetopterus pergamentaceus Cuvier, 1810, présente aux Caraïbes, pourrait être identique à C. variopedatus.
Les notopodes (rames dorsales des parapodes*) en forme d’aile du segment 12 se placent de façon à constituer un anneau. Ils sécrètent du mucus qui forme un filet. Le battement rythmique des éventails des segments 14,15 et 16 génère un courant d’eau qui entre par l’orifice du tube du côté de l’avant de l’animal et qui sort par l’autre extrémité. Les particules alimentaires sont retenues par le filet muqueux et l’extrémité de ce dernier est enroulée de façon continue pour former une balle dans la cupule dorsale. Lorsque cette balle atteint une certaine taille, le filet est détaché et incorporé dans la balle. Celle-ci est alors conduite vers la bouche par des mouvements ciliaires. Si un objet susceptible d’encombrer le dispositif se présente, les notopodes aliformes se rétractent pour permettre à l'objet de contourner le filet. Un spécimen de chétoptère de 18 à 24 cm de long peut produire un filet muqueux à la vitesse d'environ 1 mm/s, avec des boulettes de nourriture d'un diamètre moyen de 3 mm.
Dans les pelotes fécales sont retrouvés des tests de diatomées, de foraminifères, des coquilles de larves* de mollusques, des carapaces de copépodes et celles de nombreux jeunes crustacés planctoniques*, ainsi que des œufs du grand chétoptère, sans compter ce qui a été complètement digéré.
Donc Chaetopterus variopedatus se nourrit de plancton et de matières organiques en suspension.
Les sexes sont séparés. La partie postérieure des mâles matures est blanchâtre alors que celle des femelles est orange. Les femelles ovigères* portent de 150 000 à plus d'un million d'œufs à la fois. Le frai a lieu pendant la période chaude. Les gamètes* sont libérés et la fécondation a lieu en pleine eau. Les chétoptères présentent un développement original car les segments de la partie médiane se développent plus vite que les autres parties du corps (on parle d'hétérochronie).
Bien qu'il soit étroitement adapté à un mode de vie particulier, à l'intérieur de son tube parcheminé qu'il n'abandonne jamais, le grand chétoptère est capable, très facilement, d’autotomie* lorsqu'on veut le saisir par la partie antérieure ou lorsqu'on l'irrite assez fortement. La rupture se fait toujours entre le premier et le second segment de la région moyenne.
Chaetopterus est l'un des rares genres de polychètes avec des régions spécialisées distinctes qui peuvent régénérer un corps entier à partir d'un seul segment. Cette capacité est plus fréquente chez les vers ayant des corps indifférenciés.
Cet animal s’autotomisant très facilement, les individus régénérés sont fréquents et présentent souvent des anomalies qui les ont fait considérer comme des espèces distinctes. Le nombre des segments antérieurs est très variable. Le nombre et la taille des segments de la région postérieure sont aussi très variables.
C. variopedatus est considéré comme une espèce écologiquement importante pour deux raisons.
Harmothoe setosissima (Lamarck, 1818), Gattyana cirrhosa (Pallas, 1766), Polynoe scolopendrina Savigny, 1822 et Malmgrenia lunulata (Delle Chiaje, 1830) sont des annélides polychètes qui peuvent être observés dans les tubes du grand chétoptère, ainsi qu’un petit bryozoaire Hypophorella expansa Ehlers, 1876, ainsi que des nématodes et des protozoaires.
Sur la côte ouest de l’Atlantique on peut trouver les crustacés Pinnixa chaetopterana Stimpson, 1860, Polyonyx gibbesi Haig, 1956 par exemple.
Un gobie, Crystallogobius linearis (Düben, 1845) dépose ses œufs dans des tubes de vers polychètes vides, souvent dans ceux de Chaetopterus, à 20-40 m de profondeur. Les œufs sont gardés par les mâles, qui souvent se cachent eux aussi dans le tube.
Comme de nombreux individus montrent des signes de régénération (petit nombre de segments, …), il est probable que cette espèce soit la proie de grands poissons et de crustacés se nourrissant sur le fond. Du fait qu’elle vive dans son tube, elle est peu accessible mais son extrémité antérieure peut dépasser et elle est de couleur claire. Il existe peu d'informations sur les prédateurs du grand chétoptère.
Cette espèce correspond certainement a un grand nombre d'espèces très proches (un complexe d'espèces) ce qui explique le fait que certains proposent qu'elle soit cosmopolite. Ce complexe d'espèces mériterait une révision.
La forme du corps et des parapodes sont très modifiés par rapport au schéma classique des polychètes. Cela est en liaison avec ce comportement alimentaire unique.
L'analyse récente de la phylogénie moléculaire montre que Chaetopterus variopedatus est certainement un complexe d'espèces.
Le courant d'eau sert les fonctions importantes de la respiration, de l'évacuation des déchets, du nettoyage du tube et de l'alimentation.
Le tube est sécrété par la surface ventrale de la région antérieure du corps. Les
soies notopodiales du 4ème segment, très élargies, sont utilisées pour déchirer
la paroi du tube afin d'agrandir le tube au fur et à mesure de la croissance, puis l'animal sécrète pour en augmenter à la fois la longueur et la largeur.
La durée de vie de C. variopedatus varie avec les conditions environnementales et d'autres facteurs, mais la plupart des spécimens étudiés vivent pendant une période d'environ un an ou moins.
Après de fortes tempêtes de nombreux tubes parcheminés vides ou avec le ver peuvent être échoués sur les plages.
Cette espèce, malgré les doutes concernant son unicité, est très étudiée car elle constitue un important modèle pour les premiers stades du développement embryonnaire. Cela est dû au fait que la fécondation et l'élevage des premiers stades sont faciles au laboratoire.
La vitesse d’écoulement de l’eau dans le tube doit être assez élevée pour permettre une filtration efficace sur un filtre de petite taille. Elle serait 2 fois plus élevée que chez les bivalves et 5 fois plus que chez les ascidies. Cela semble lié à la surface des filtres chez ces différents organismes, très petite chez le grand chétoptère et beaucoup plus importante chez les bivalves et les ascidies simples.
Le film de mucus se compose de deux réseaux croisés de filaments parallèles pouvant retenir les particules d'un diamètre d'environ 0,5 µm et laisser passer les particules plus petites.
En 2006, une lectine spécifique au β-galactose appelée CVL a été isolée à partir des tissus du grand chétoptère. Elle présente une activité anti-VIH-1. Sa cible se situe au début de la réplication du virus et du blocage de l’entrée du virus dans les cellules hôtes. Cette substance aura-t-elle un développement dans le traitement du SIDA ?
Les propriétés visco-élastiques de la matière du tube ont fait l’objet d’études. Celles-ci ont montré des caractéristiques remarquablement stables dans des gammes de température importantes comparables à celles de la soie du ver à soie et à celles de la soie d’araignée.
Il s'agit du plus grand chétoptère.
Chaetopterus : du grec [chaete] = soie* et du grec [pter-] = aile, ce sont les notopodes en forme d'ailes portant des soies qui sont à l'origine du nom de genre créé par Cuvier en 1830.
variopedatus : du latin [vari-] = varié et du latin [pedat-] = pied, donc à pieds de forme variée pour les notopodes aliformes* du segment 12 et les éventails des segments 14, 15 et 16.
pergamentaceus: (pour l'espèce présumée synonyme des Caraïbes) du latin [pergamena] = parchemin avec le suffixe [-eus] = qui a un rapport avec la matière, donc de parchemin. La racine latine vient du grec [pergamen] = ville de Pergame (Bergama, aujourd'hui, en Turquie). C'est dans cette ville que le parchemin fut inventé.
Numéro d'entrée WoRMS : 129914
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Annelida | Annélides | Vers segmentés (annelés) à section cylindrique, à symétrie bilatérale constitués de segments semblables. Le premier segment porte la bouche et le dernier l’anus. Nombreuses formes marines, dulcicoles ou terrestres, libres ou parasites. |
| Classe | Polychaeta | Polychètes | Annélides marines. Chaque segment porte des excroissances locomotrices (les parapodes) plus ou moins développées, munies de touffes de soies chitineuses rigides. Chez la plupart des espèces, la tête porte plusieurs organes sensoriels, des mâchoires, et souvent un panache branchial coloré. Animaux libres dans la colonne d'eau ou sur les sédiments mais aussi galéricoles ou tubicoles. |
| Sous-classe | Sedentaria | Annélides polychètes sédentaires | |
| Famille | Chaetopteridae | Chaetoptéridés | Espèces sédentaires vivant dans un tube parcheminé ou corné partiellement à totalement enfoui dans le substrat. Pas de véritables branchies, deux longs palpes, corps divisé en 3 régions très distinctes dont une médiane de cinq paires de parapodes très élargis. |
| Genre | Chaetopterus | ||
| Espèce | variopedatus |
 Annélides Polychètes sédentaires (Sédentaires)
Annélides Polychètes sédentaires (Sédentaires)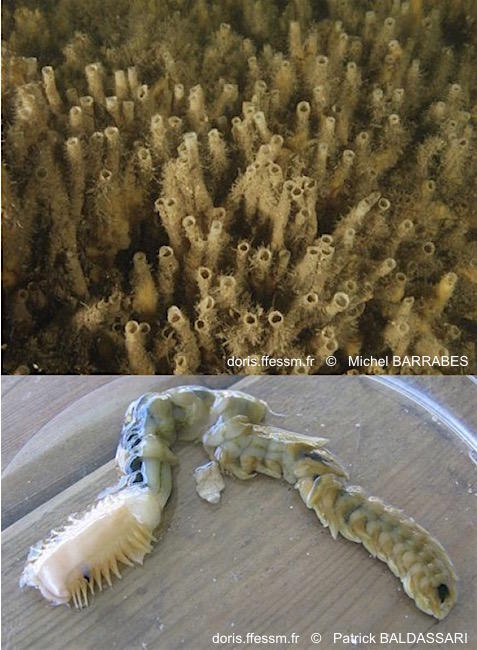
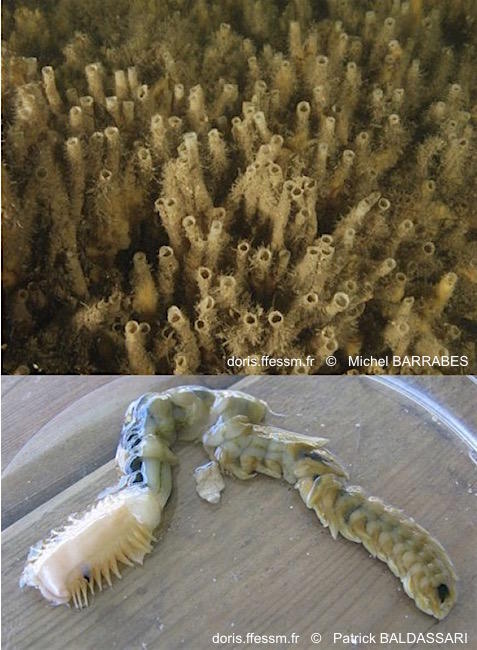
Grand chétoptère, tube et corps
Pour le plongeur Chaeptopterus variopedatus se présente sous la forme de paires de tubes érigés, souvent regroupées en grand nombre (photo du haut). Le corps (photo du bas) mou, caché dans le tube, est divisé en trois parties bien distinctes.
Arcachon (haut) & Somme (bas)
Michel BARRABES
Patrick BALDASSARI
2008/2012
 Annélides Polychètes sédentaires (Sédentaires)
Annélides Polychètes sédentaires (Sédentaires)

Un peuplement de chétoptères
Chaque tube de chétoptère possède deux orifices.
Arcachon
22/06/2008


Enchâssé dans une fissure de la roche
En Méditerranée, où Chaetopterus s'observe solitaire ou en petit groupe, ce grand ver est présent sous les surplombs ou sous les pierres.
Jardin de Sausset (13), 17 m
22/09/2007


Tubes de chétoptères
Ces tubes sont encroûtés par des organismes épibiontes*.
Mimbeau, Arcachon (33), 6 m
09/05/2007


Sur une poche à huîtres abandonnée en Méditerranée
Sur cette poche à huîtres utilisée comme récif artificiel, on observe des tubes en nombre, assez fins, presque transparents à leur extrémité et dressés. Ils semblent tous morts car le corps des vers chétoptères reste caché à l'intérieur. La hauteur des tubes est ici d'environ 3 à 4 cm. La confusion avec des protules, dont les tubes sont moins dressés et bien plus épais, est possible en Méditerranée.
Marseille, 30 m
22/08/2010


Tube parcheminé
Le tube membraneux, résistant, souple, est formé d’épais feuillets superposés, blanchâtres, opaques, parcheminés. Bien que les descriptions parlent de tube non annelé, il y a bien des anneaux irréguliers visibles sur les parties peu recouvertes d'épibiontes. Ces anneaux positionnés plus ou moins en biais, sont sans doute dus aux différentes phases de croissance du tube.
Pointe de Carramassaige, île Riou, Marseille (13), 30 m
27/05/2007


Deux individus en zone ombragée en Méditerranée
Deux paires de tubes d'environ 6 à 8 cm, dans le coralligène en zone sombre, correspondant à deux individus.
La Ciotat (13), 20 m
10/07/2013


Animal extrait de son tube
Comme cet animal s'autotomise facilement, seule une partie est visible. En haut à droite, bordé d'orange : l'entonnoir buccal, puis en descendant, les 1ers segments avec les soies robustes et en dessous, la partie ventrale contenant l'intestin noirâtre. Ensuite, en remontant vers la gauche quelques segments postérieurs.
Mimbeau, Arcachon (33), 6 m
09/05/2007


Deux courts palpes filiformes
La partie antérieure du corps de ce ver, aplatie, avec deux palpes filiformes courts (en bas à gauche), est constituée de onze segments (bien visibles sur cette photo), dont neuf seulement sont sétigères (qui portent des soies*), et le tout forme une structure massive avec une bouche terminale en entonnoir.
Rq : il est très rare de pouvoir observer le corps de ce ver in situ car il est, la plupart du temps, caché dans son tube.
Les Tables, Bassin de Thau (34), 5 m
25/04/2015


Animal extrait de son tube (bis)
En bas à droite, bordé d'orange, l'entonnoir buccal et au-dessus les premiers segments. Juste avant le rétrécissement, on distingue un collier qui correspond aux notopodes aliformes.
Mimbeau, Arcachon (33), 6 m
09/05/2007


Tube de grand chétoptère
Après une tempête, de nombreux tubes coriaces et caoutchouteux sont présents dans les laisses de mer.
Sur l'estran de la plage de Dunkerque (59)
11/02/2016


Sur l'estran de la Somme
Sur l'estran dans une mare et pêché à l'épuisette, le corps mou n'était pas dans un tube (animal moribond ?).
Bois de Cise, Ault (80), estran
01/04/2012
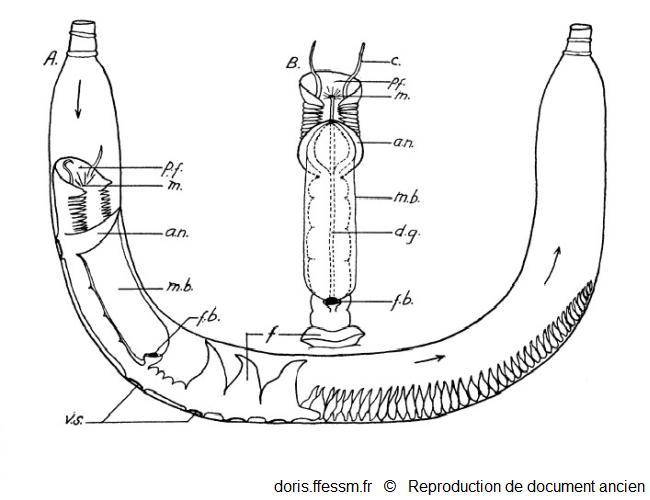
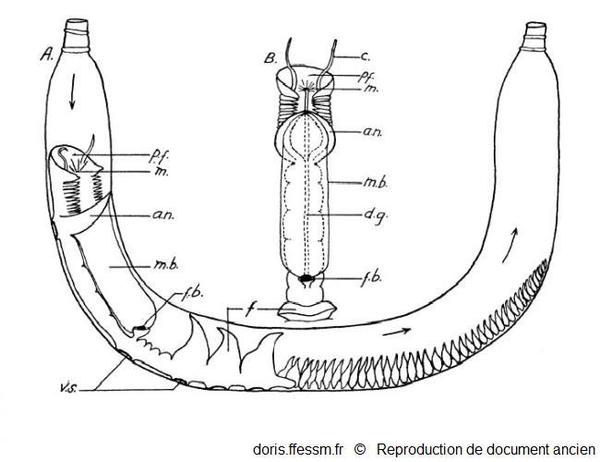
Chaetopterus variopedatus se nourrissant
A : Chaetopterus variopedatus dans son tube, se nourrissant.
B : Partie antérieure et dorsale du ver.
an ; notopode aliforme ; c : tentacule ; f : éventails ; fb : boulette de nourriture enroulée dans la cupule dorsale ; dg : sillon cilié dorsal ; m : bouche ; mb : filet de mucus ; pf : entonnoir buccal; vs : disques adhésifs.
Macginitie G.E., 1939, page 116, fig 1 modifiée
Reproduction de documents anciens
1939
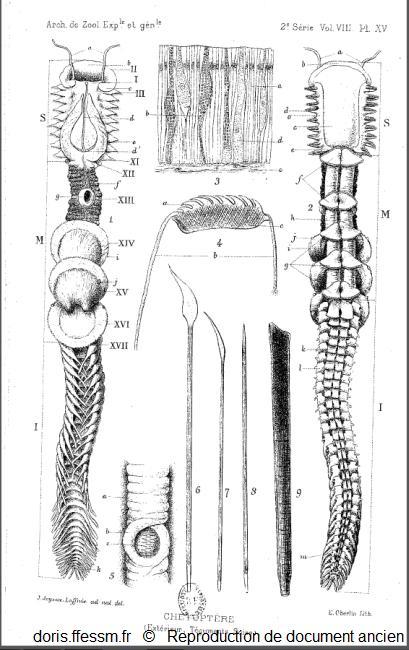
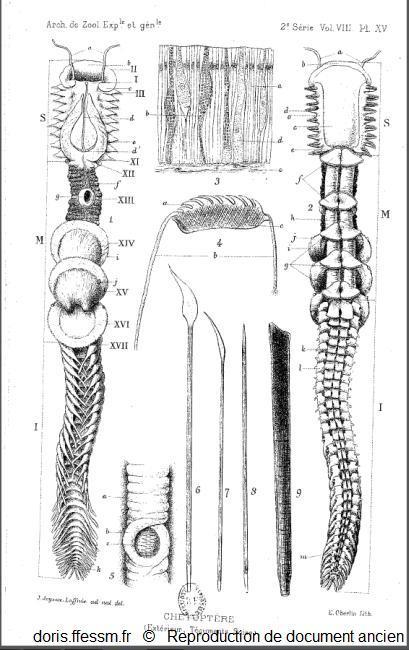
Planche sur le chétoptère.
A gauche, le chétoptère en vue dorsale et à droite en vue ventrale.
L'animal est représenté à demi-contracté sous l'aspect qu'il revêt au sortir du tube.
En haut, au milieu, une coupe de l'épiderme grossi environ 400 fois.
En dessous différentes soies.
Joyeux-Laffuie J. 1890 planche XV
Reproduction de documents anciens
1890
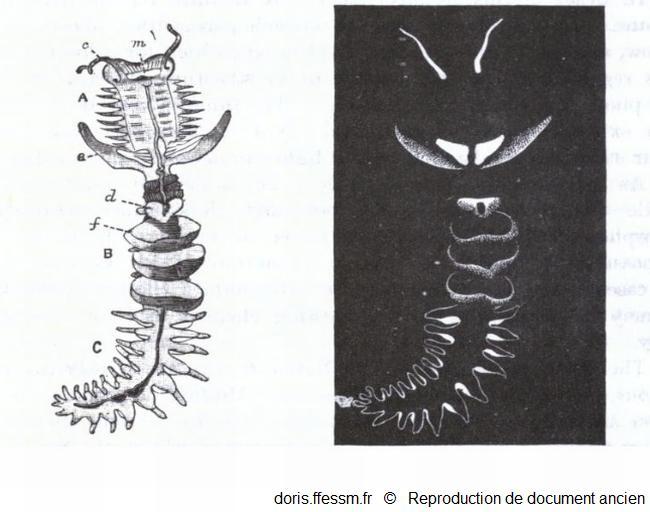
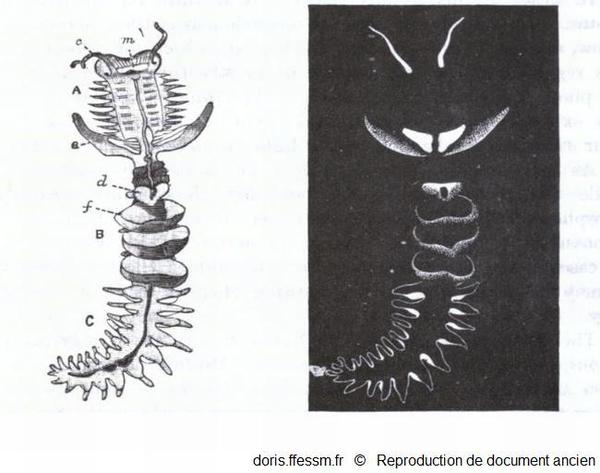
Bioluminescence
Grand chétoptère.
A gauche, l'animal entier avec ses 3 régions A, B, C ; c, tentacules ; d, cupule dorsale ; e, notopode aliforme ; f, éventail; m, bouche.
à droite, il est représenté dans le noir, après stimulation, pour montrer les parties bioluminescentes.
Benham W, 1895, p 295 fig 257
Reproduction de documents anciens
1895
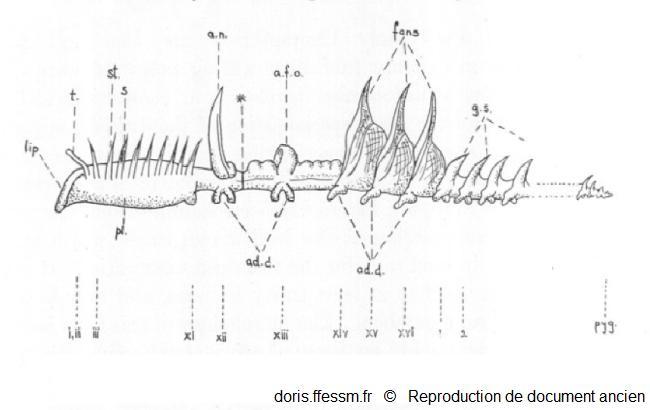
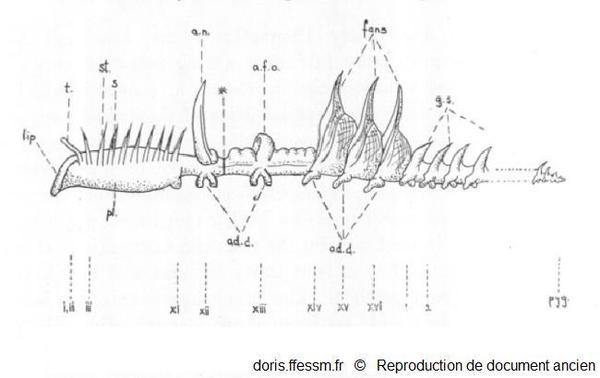
Schéma de l'organisation d'un grand chétoptère.
L'avant est à gauche, l'arrière à droite.
i - xvi - 1- 2, etc., numéro des segments ; pyg., pygidium* ; t, tentacule ; pl., plastron ; st, segment sétigère (porteur de soies*) ; s, grosses soies*, g.s, segment génital ; a.n, notopode aliforme ; a.f.o, cupule dorsale ; *, zone d'autotomie*; ad.d, disques adhésifs.
Berrill N.J. 1928, page 152 fig 1, modifiée
Reproduction de documents anciens
1928
Rédacteur principal : Yves MÜLLER
Vérificateur : Frédéric ANDRÉ
Responsable régional : Yves MÜLLER
Barnes R.D., 1965, Tube-building and feeding in Chaetopterid Polychaetes, Biological Bulletin, 129(2), 217-233.
Benham W., 1896, POLYCHAETE WORMS, in Harmer & Shipley THE CAMBRIDGE NATURAL HISTORY, 2, 239-341.
Berrill N.J.,1928, Regeneration in the polychaet Chaetopterus variopedatus, Nature, 119, 2998, 564-565.
De Blauwe H., 2001, Hypophorella expansa Ehlers, 1876 een algemeen mosdiertje in aangespoelde kokers van de perkamentkokerworm Chaetopterus variopedatus, De Strandvlo, 21(3), 102-104.
Enders H. E. ,1906, A study of the life history and habits of Chaetopterus variopedatus, Journal of Morphology ,20(3), 479-531.
Fauchald K., Jumars P.A., 1979, The diet of worms: a study of the polychaete feeding guilds. Oceanogr. Mar. Biol. Ann. Rev., 17, 193-284.
Flood P.R., Fiala-Medioni A., 1982, Structure of the mucous feeding of Chaetopterus variopedatus (Polychaeta), Marine Biology, 72, 27-33.
Gravier C., 1909, Sur la régénération de la partie antérieure du corps chez le chétoptère, Compte Rendu de l'Académie des Sciences Paris, 148, 365-367.
Gray I.E. 1961, Changes in abundance of the commensal crabs of Chaetopterus. Biological Bulletin, 120, 353-359.
Irvine S.Q., Chaga O., Martindale M., 1999, Larval ontogenic stages of Chaetopterus : Developmental heterochrony in the evolution of Chaetopterid Polychaetes, Biological Bulletin 197(3), 319-331.
Joyeux-Laffuie J.,1890, Etude monographique du Chétoptère (Chaetopterus variopedatus, Rénier) suivie d'une révision des espèces du genre Chaetopterus. Archives de Zoologie Expérimentale et Générale 2(8), 245-360 + pl XV-XX.
Macginitie G.E., 1939, The method of feeding of Chaetopterus, Biological Bulletin, 77, 115-118.
Martin N. Anctil M., 1984. Luminescence control in the tube-worm Chaetopterus variopedatus : role of nerve cord and photogenic gland, Biological Bulletin, 166, 583-593.
Riisgard H.U., 1989, Properties and energy cost of the muscular piston pump in the suspension feeding polychaete Chaetopterus variopedatus, Marine Ecology Progress Series, 56, 157-168.
Schaffner LC., 1990, Small-scale organism distributions and patterns of species diversity: evidence for positive interactions in an estuarine benthic community, Marine Biology Progress Series, 61, 107-117.
Shah D.U., Vollrath F., Porter D., Stires J., Deheyn D.D., 2014, Housing tubes from the marine worm Chaetopterus sp.: biomaterials with exceptionally broad thermomechanical properties, J. R. Soc. Interface, 11(20140525), 1-12.
Sumida B.H., Case J.F., 1983, Food recognition by Chaetopterus variopedatus (Renier): Synergy of mechanical and chemical stimulation, Marine Behaviour and Physiology, 9(4), 249-274.
Sweat L.H., .2010, Chaetopterus variopedatus (Renier, 1804), Smithsonian Marine Station at Fort Pierce.
Thompson M.L., Schaffner L.C., 2001, Population biology and secondary production of the suspension feeding polychaete Chaetopterus c.f. variopedatus: implications for benthic-pelagic coupling in lower Chesapeake Bay. Limnology and Oceanography, 46, 1899-1907.
Wang J-H., Kong J, Li, W., Molchanova V., Chikalovets I., Belogortseva N., Luk’yanov P., Zheng Y-T., 2006, Betagalactose-specific lectin isolated from the marine worm Chaetopterus variopedatus possesses anti-HIV-1 activity, Comp. Biochem. Physiol., C: Toxicol. Pharmacol., 142, 111-117.
Wells G.P., Dales R.P., 1951, Spontaneous activity patterns in animal behavior: the irrigation of the burrow in the polychaetes Chaetopterus variopedatus Renier and Nereis diversicolor O.F. Müller, Journal of the Marine Biological Association of the United Kingdom ,29, 661-680.
La page de Chaetopterus variopedatus dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.