Taille maximale documentée 60 cm, taille communément rencontrée 30 cm
Bande noire sur les flancs, de l’œil jusqu'à la fin de la 2e nageoire dorsale (dorsale molle)
Large tache noire ronde sur le pédoncule caudal
Bande grisâtre de la bouche aux yeux, initiant la bande courant sur le flanc
Deux barbillons blancs sous le menton
Parties épineuse et molle de la dorsale séparées
Barberin,
barbet rayé, barbillon rayé, rouget barberin, rouget-barbet barberin, poisson-chèvre à bande noire
Dash and dot goatfish, dot and dash goatfish, dot-dash goatfish, half and half goatfish, spotted golden goatfish (GB), Salmonete barberirio (E), Rote Meerbarbe (D), Streepkol-bokvis (Afrique du Sud)
Mullus barberinus Lacepède, 1801
Pseudupeneus barberinus (Lacepède, 1801)
Zones tropicales et subtropicales de l’océan Indien et du Pacifique Ouest et centre
Zones DORIS : ● Indo-PacifiqueCette espèce se rencontre dans les zones tropicales et subtropicales de l’océan Indien et de l'océan Pacifique Ouest et centre.
Dans le Pacifique, sa distribution du nord au sud s’étend du sud du Japon à l’Australie et à la Nouvelle-Calédonie. Vers l’est, on la trouve jusqu’aux îles Tonga.
L'espèce n’est pas signalée de la mer Rouge.
Parupeneus barberinus vit sur les fonds sableux ou sablo-détritiques* des lagons et des récifs, ainsi que dans les herbiers de phanérogames*. Il se rencontre généralement dans de petits fonds et dès le premier mètre, mais on peut le trouver jusqu’à 100 mètres de profondeur.
Description sommaire : surmulet de grande taille, qui peut atteindre 60 cm. Sa couleur, généralement gris pâle, rougit avec la profondeur. Il arbore une bande grisâtre de la bouche à l’œil et une bande noire sur les flancs de l’œil à l’aplomb de la dorsale molle (2e dorsale). Cette bande noire peut être surmontée d’une bande jaune dans le Pacifique. La tête est longue et pointue. Le menton porte deux barbillons blancs. La dorsale épineuse et la dorsale molle sont séparées. Les nageoires sont généralement translucides.
Description détaillée :
Le corps est moyennement fuselé et modérément comprimé latéralement. Sa hauteur (distance calculée à l’aplomb du troisième rayon dur de la dorsale) entre environ 3,3 à 3,7 fois dans sa longueur standard (longueur sans la queue). La taille maximale documentée est de 60 cm, la taille la plus communément rencontrée est de 30 cm.
La couleur générale est gris pâle à reflets bleutés. Une large bande noire part de l’œil, qu’elle traverse, et se prolonge en chevauchant la ligne latérale* jusqu’à l’aplomb de la partie postérieure de la deuxième nageoire dorsale. La couleur du corps fonce légèrement au-dessus de cette bande et peut s’éclaircir jusqu’au blanc en dessous. Cette bande, comme l’ensemble de la livrée, peut rougir quand l’individu prend de la profondeur. Certains individus du Pacifique arborent une bande jaune vif qui commence derrière les yeux et longe la limite supérieure de la bande noire en l’accompagnant sur toute sa longueur. Une large tache noire plus ou moins circulaire marque le pédoncule caudal au contact de la partie antérieure de la nageoire caudale. Cette tache peut devenir rouge foncé quand la livrée rougit. Les écailles des flancs peuvent être blanches à bleu pâle et sont bordées de gris beige plus ou moins jaunissant ou rougissant.
La tête est longue et pointue, avec un profil dorsal rectiligne entre le museau et la nuque. Le museau et les joues portent des écailles. La bouche est terminale. Les lèvres sont charnues, la lèvre supérieure est protractile*. Les yeux sont haut placés et de taille moyenne. Le menton porte deux barbillons blancs dont la longueur est comprise entre 1,4 et 1,6 fois dans celle de la tête. Une bande grisâtre plus ou moins diffuse part de la bouche et rejoint l’œil dans l’axe de la bande noire qui marque les flancs. Des lignes et tirets au dessin irrégulier, alternant le bleu pâle et le jaune, ornent toute la surface de la tête. Ces motifs réticulés sont souvent très discrets, mais on peut généralement observer au moins deux lignes bleues encadrant une ligne jaune qui partent de la bouche et rejoignent la partie supérieure de l’opercule* en passant sous l’œil.
Les parties épineuse et molle de la dorsale sont séparées par trois rangs d’écailles
La première dorsale est schématiquement triangulaire. Son premier rayon dur est très petit, le troisième est le plus long.
La dorsale molle et l’anale sont symétriques.
Les pelviennes sont de grande taille.
La nageoire caudale est fourchue.
Toutes les nageoires sont ordinairement translucides, mais des lignes horizontales alternant le bleu et le jaune pâle peuvent apparaître sur la dorsale molle et sur l’anale, de même que des écailles bleues sur les rayons de la caudale.
La livrée nocturne : cette livrée est très variable. La couleur de fond est blanche avec des plaques qui peuvent aller du brun rougeâtre au rose très pâle en passant par le rouge vif, qui est la teinte la plus fréquente. Dans la majorité des cas, trois selles* marquent le dos : l’une se trouve sous la première dorsale, une autre sous la deuxième dorsale et la dernière, plus petite, sur la partie antérieure du pédoncule caudal. Ces trois selles se rejoignent sur les flancs, sous la bande noire qui chevauche la ligne latérale. Cette bande noire peut être intacte ou très estompée, jusqu’à disparaître, de même que la bande grisâtre sur le museau et la tache noire présente sur le pédoncule caudal.
Une large plaque couvre le haut du museau jusqu’à occuper une partie de l’espace interorbital ; une autre, plus petite, se trouve sur la lèvre supérieure et est liée à la bande grisâtre allant de la bouche à l’œil. La nageoire dorsale épineuse porte de larges zones rouges ; la moitié inférieure de la dorsale molle est d’un gris très pâle parcouru de minces bandes translucides à jaunâtres. Les autres nageoires sont translucides.
Les juvéniles : le corps des juvéniles est plus élancé que celui des adultes (sa hauteur entre environ 4,6 fois dans la longueur standard), mais leur livrée ne diffère pas de la leur.
Parupeneus barberinus se nourrit principalement de jour, en fouissant le sédiment après avoir repéré une proie à l’aide de ses barbillons. Une étude menée à Lizard Island (Queensland, Australie) sur 66 individus montre que la diète* est influencée par les tailles. Les vers polychètes étant la proie principale pour toutes les tailles, des chercheurs ont observé que les individus de moins de 12 cm consommaient davantage d’ostracodes (crustacés de 0,5 à 2 mm) et de nématodes (vers ronds de 0.5 et 3 mm) que ceux dont la taille était plus grande, ces derniers leur préférant des bivalves. Quant à ceux dont la taille dépassait les 24 cm, leur diète hors vers polychètes était dominée par les bivalves et les crabes.
Il n’existe à notre connaissance et à la date de parution de cette fiche (02/2023) que deux études sur la reproduction de Parupeneus barberinus (Wahbeh and Ajiad 1985 et Longenecker et al. 2011), mais la première a été réalisée à Aqaba alors que l’espèce n’est pas signalée en mer Rouge. Nous n’en tiendrons pas compte du fait de l’incertitude taxonomique. La seconde, qui s’intéresse spécifiquement à l’examen des gonades*, a observé que le pourcentage de femelles sexuellement matures décroissait avec la taille moyenne des individus et que tous les individus de plus de 21 cm étaient des mâles, leur taille minimum à la première maturité sexuelle étant d’environ 14 cm (environ 12 cm pour les femelles). Ces éléments évoquent un hermaphrodisme* protogyne*, qui serait un cas unique chez les Mullidés, mais l’examen des gonades n’a pas pu apporter de preuves certaines à l’appui de cette hypothèse, et aucun individu intermédiaire entre les deux sexes n’a été observé. Ces résultats sont synthétisés dans une note de 2017 : les chercheurs en restent, pour le moment, à l'interprétation la plus parcimonieuse, à savoir que cette espèce présente un « hermaphrodisme juvénile » (aussi appelé hermaphrodisme rudimentaire ou gonochorisme tardif) : l’espèce serait gonochorique* chez les adultes mais les individus connaîtraient une phase hermaphrodite ne débouchant pas sur une possibilité de changement de sexe.
Pour le reste, les généralités concernant les espèces de Mullidés dont les comportements de reproduction ont été étudiés devraient s’appliquer aussi à P. barberinus. Ce sont les suivantes : les espèces sont gonochoriques*, la saison de reproduction se situe en saison chaude et donne lieu à des agrégations de ponte. Les gamètes* sont émis en pleine eau, les larves* sont donc pélagiques*. Les larves dérivent en surface et passent au stade juvénile avant de coloniser un récif. Cette métamorphose* amène l’apparition des barbillons et une mutation de la structure des yeux adaptée à la vie près du fond. Au moment de l’installation* les juvéniles descendent vers le substrat*.
Quand il chasse en fouissant le substrat, Parupeneus barberinus est souvent accompagné par des carnivores opportunistes plus ou moins nombreux (Labridés, Serranidés, Carangidés, notamment), qui cherchent à profiter des proies ou des détritus comestibles débusqués par son travail de fouissage* dans le sédiment.
Les Mullidés, entre autres P. barberinus, sont fréquemment parasités par des vers trématodes du genre Transversotrema. Ces vers se fixent notamment sur l’épiderme accessible entre les écailles présentes autour des nageoires. T. chevrarum et T. tragorum ont été trouvés sur l’espèce. Elle peut aussi être infectée par des vers du genre Haliotrema. Ces vers se fixent essentiellement sur les branchies*, la peau et les nageoires. Haliotrema alatum, H. australe et H. recurvatum ont été trouvés sur P. barberinus.
La caractéristique principale des Mullidés réside dans leurs barbillons équipés de cellules chémoréceptrices*. Ces barbillons sont à la fois indépendants et très mobiles. Deux systèmes musculaires et osseux distincts leur permettent de se mouvoir latéralement et verticalement. Leur extrémité est très souple. Les parties charnues des barbillons sont des ramifications du système gustatif et abritent des papilles équipées de chémorécepteurs* (cellules nerveuses capables d'identifier des substances chimiques). Elles s’organisent autour d’un rayon modifié issu de la membrane branchiostège* (attachée aux opercules et couvrant les branchies), qui leur donne leur solidité. Ces rayons se déplacent de la zone operculaire vers le menton au cours de la croissance des larves, les barbillons apparaissant chez les juvéniles prêts à mener une existence benthique*.
Le genre Parupeneus se distingue des autres genres de la famille des Mullidés par sa dentition : il n’a qu’une seule rangée de dents coniques sur chaque mâchoire, et pas de dents vomériennes* (le vomer est un os médian en avant du palais) ni palatines* (fixées sur les os du palais).
Parupeneus barberinus est généralement solitaire à l’âge adulte, mais les juvéniles grandissent en petits groupes comprenant souvent plusieurs espèces.
La première nageoire dorsale de P. barberinus comprend 8 rayons durs, la seconde 9 rayons mous. L’anale comprend 1 rayon dur et 7 rayons mous. La nageoire pectorale comprend de 16 à 18 rayons. La ligne latérale* comprend 27 où 28 écailles.
Le travail de fouissage* des Mullidés a pour conséquence une resuspension des particules organiques contenues dans le sédiment, qui peut profiter entre autres au plancton*, aux coraux et aux organismes suspensivores*. De plus, le mélange continuel des éléments composant le sédiment est un obstacle aux invasions algales. Ce travail est vigoureusement mené : il n’est pas rare d’apercevoir un nuage de suspensions de plus d’un mètre de haut et de deux mètres carrés de surface au-dessus d’un capucin adulte en train de traquer une proie dans le sable. A titre indicatif, une étude faite en mer Rouge montre que Parupeneus forsskali, moins puissant que P. barberinus, fouit chaque mètre carré de la zone d’étude 4,4 secondes par heure et peut creuser une tranchée de 10 à 15 cm de profondeur et de quelques décimètres de longueur avec son museau.
P. barberinus est l’une des espèces les plus communes de son genre. C’est aussi la plus grande espèce, non seulement de son genre, mais aussi de sa famille (les Mullidés).
L’espèce fait partie des cibles de la pêche commerciale. Elle est peu concernée par le commerce aquariophile du fait des volumes qu’elle requiert et de la menace qu’elle représente pour les petits poissons et les invertébrés.
Le statut de Parupeneus barberinus pour l’UICN* est LC (Least Concerned, traduit par « Préoccupation mineure »), ce qui signifie que les informations recueillies sur l’espèce ne permettent pas de la classer dans les autres catégories, notamment dans les trois qui alertent sur une menace (CR : en danger critique d’extinction, EN : en danger, VU : vulnérable). Fonction de quoi elle n’est pas actuellement concernée par des mesures de protection.
Capucin : le mot vient du nom d’un ordre religieux faisant partie du mouvement franciscain, les Frères mineurs capucins. Ce nom tient à leur robe de bure dotée d’une longue capuche, qu’ils nommaient d’un nom d’origine italienne, « le capuce ». Ces religieux se caractérisaient entre autres par le port d’une longue barbe, ce qui pourrait avoir motivé le nom français de ces poissons, tous doté de deux longs « barbillons » sous la lèvre inférieure.
On trouve la même inspiration pour le nom anglais de « goatfish » (poisson chèvre), employé pour toute la famille des Mullidés, en référence à la « barbiche » que peuvent avoir les chèvres sous le menton.
barberin : voir dans « Origine du nom scientifique, barberinus.
Parupeneus : le nom est composé de l’adjectif latin [par-], qui signifie « égal, pareil, apparié », et du nom Upeneus, nom de genre créé en 1829 par Cuvier et Valenciennes (Histoire Naturelle des Poissons, Tome troisième, p. 447), qui précisent : « nous avons cru convenable de distinguer ces poissons des Mulles ordinaires par un nom sous-générique, et nous avons choisi pour cela celui d‘upénéus, qui n’a point de signification fixe chez les anciens ». Ce nom désignait divers poissons chez les Grecs de l’Antiquité. Le nom de genre signifie donc « apparenté aux espèces du genre Upeneus ».
Le genre est nommé par Bleeker en 1863 pour classer quatre espèces appartenant auparavant au genre Upeneus. Il ne semble être décrit qu’en 1876 (Systema Percarum revisum, Pars II, Archives néerlandaises des sciences exactes et naturelles, vol. 11, p. 334), sans justification de son nom, mais avec la mention de l’espèce-type* : Parupeneus barberinus.
Le genre contient actuellement 32 espèces acceptées.
barberinus : l’espèce est décrite en 1801 par Lacépède, d’après les manuscrits de Commerson, dans Histoire naturelle des poissons (Tome troisième, pp. 383 et 406-408), sous le nom scientifique de Mullus barberinus et le nom commun de « mulle barberin ». Le mot « barberinus » est inconnu du dictionnaire latin de référence (Gaffiot) et l’adjectif « barberin » n’existe pas en français (sauf dans la désignation d’une variété de pomme, dite « barberine »). Le nom latin « barbus », dérivé de « barba » (barbe, qui s’employait indifféremment pour les êtres humains et les animaux) désigne le barbeau, poisson d’eau douce présentant quatre barbillons. Il est donc très probable que l’épithète spécifique renvoie aux barbillons de l’espèce.
La localité du type* se trouve « dans la mer voisine des Moluques, dont les habitants apportaient dans leurs barques de grands nombres d’individus de cette espèce au vaisseau sur lequel naviguait Commerson en septembre 1768 », écrit Lacépède. Les Moluques sont un archipel est-indonésien. Il ne semble pas possible de préciser davantage pour la localité du type*.
Numéro d'entrée WoRMS : 218660
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Chordata | Chordés | Animaux à l’organisation complexe définie par 3 caractères originaux : tube nerveux dorsal, chorde dorsale, et tube digestif ventral. Il existe 3 grands groupes de Chordés : les Tuniciers, les Céphalocordés et les Vertébrés. |
| Sous-embranchement | Vertebrata | Vertébrés | Chordés possédant une colonne vertébrale et un crâne qui contient la partie antérieure du système nerveux. |
| Classe | Actinopteri | ||
| Sous-classe | Neopterygii Teleostei | Néoptérygiens Téléostéens | Poissons à arêtes osseuses, présence d’un opercule, écailles minces et imbriquées. |
| Ordre | Mulliformes | Mulliformes | |
| Famille | Mullidae | Mullidés | Percoïdes possédant une paire de longs barbillons mentonniers. |
| Genre | Parupeneus | ||
| Espèce | barberinus |
 Poissons osseux posés sur le fond et « Agnathes »
Poissons osseux posés sur le fond et « Agnathes »

Bande latérale et tache noires
Le motif constitué par une bande noire sur les flancs suivie d’une tache noire sur le pédoncule caudal n’est pas spécifique à Parupeneus barberinus (on le retrouve par exemple chez P. macronemus et P. forsskali). Cependant, entre autres différences, c’est chez P. barberinus que la tache noire est au plus près de la base de la nageoire caudale.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
14/09/2019
 Poissons osseux posés sur le fond et « Agnathes »
Poissons osseux posés sur le fond et « Agnathes »

Tête
Ce gros plan permet de voir les fortes écailles qui garnissent le museau et quelques-uns des motifs alternés jaunes et bleus qui ornent la tête.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
14/09/2019


Nageoires
Les nageoires apparaissent généralement translucides. Mais la seconde dorsale et l’anale peuvent être colorées de lignes bleues et jaunes alternées, et la caudale peut apparaître bleu pâle du fait de la couleur des petites écailles qui couvrent les rayons.
Chez cet individu, ces couleurs sont à peine suggérées.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
14/09/2019


Livrée rouge
Il n’est pas rare de voir des livrées rouges quand la profondeur augmente.
Cet individu a été rencontré à 23 mètres.
Thai Koh Pa Yan, Thaïlande, océan Indien, 23 m
14/02/2007


Livrée nocturne
Comme chez les autres Mullidés, la livrée nocturne de P. barberinus associe des motifs rouges sur fond blanc.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT, de nuit
20/02/2017


Juvénile
Les juvéniles sont plus élancés que les adultes mais leur livrée est à peu près identique.
L’individu du bas de la photo est un juvénile du capucin à lignes blanches Parupeneus ciliatus
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
22/01/2012


Juvénile stressé
Ce juvénile arbore une livrée de camouflage qui signale son stress.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
02/06/2018


Fouisseur obstiné
On peut souvent repérer un capucin de loin, au nuage de poussière que son énergique travail de fouissage provoque.
L’individu photographié ici montre jusqu’où peut aller l’obstination du chasseur !
Passe en S, Mayotte (976), océan Indien, 10 m
08/01/2011

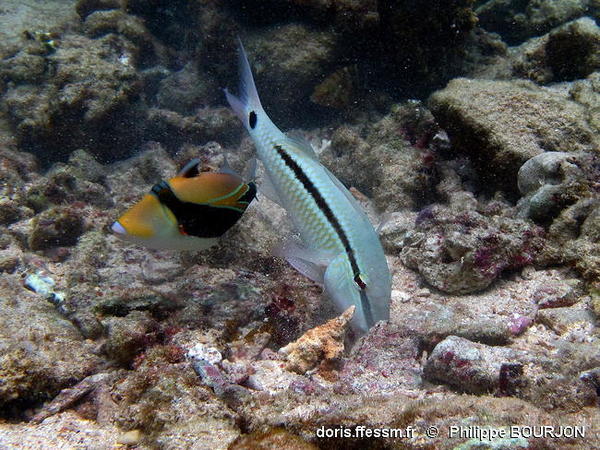
Fouineur têtu
Le capucin barberin explore principalement les fonds sableux à la recherche de nourriture. Mais il ne dédaigne pas les fonds sablo-détritiques, où son travail de fouissage est moins rentable et plus difficile que dans les fonds meubles.
Il est ici accompagné d'un baliste picasso à bandeau Rhinecanthus rectangulus.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
29/01/2015


Distribution : aux Maldives
Les Maldives font partie de la limite nord de la distribution de P. barberinus dans l’océan Indien (il n’est pas signalé de la mer Rouge).
Maagiri, Atoll de Malé, Maldives, océan Indien, 20 m
23/03/2014


Distribution : à Mayotte
L’espèce est présente dans les deux départements français de l’océan Indien : Mayotte et La Réunion.
Passe en S, Mayotte (976), océan Indien, 11 m
09/01/2010


Distribution : Madagascar
Cet individu a été photographié au large de Nosy Be, une petite île de la côte nord-ouest de Madagascar.
Nosy Be, Madagascar, océan Indien, 15 m
06/10/2017


Distribution : aux Philippines
L’espèce est présente dans les zones tropicales et subtropicales de l’ouest et du centre de l’océan Pacifique. Cet individu philippin en livrée nocturne a été rencontré dans les eaux de l’île Cabilao, dans l'archipel des Similan.
Cambaquiz1, Cabilao, Visayas centrales, Philippines, océan Pacifique, 20 m, de nuit
08/04/2017
Vidéo : Fouissage
Le capucin barberin se nourrit principalement de jour, en fouissant le sédiment après avoir repéré une proie à l’aide de ses barbillons.
Il est souvent accompagné par des carnivores opportunistes qui cherchent à profiter des proies ou des détritus comestibles débusqués par son travail de fouissage.
Apo Island, Philippines, océan Pacifique, 8 m
02/2018
Rédacteur principal : Philippe BOURJON
Vérificateur : Alain-Pierre SITTLER
Responsable régional : Alain-Pierre SITTLER
Gosline W.A., 1984, Structure, function, and ecology in the goatfishes (family Mullidae), Pacific Science, 38: 312-323.
Longenecker K., Langston R., Bolick H., Kondio U., 2011, Reproduction, Catch, and Size Structure of Exploited Reef-Fishes at Kamiali Wildlife Management Area, Papua New Guinea, Bishop Museum Technical Report (57), 169p.
Longenecker K. Langston R., Crane M., 2017, Hermaphroditism in the dash-and-dot goatfish Parupeneus barberinus, Journal of fish Biology, 90, 3, 1149-1152.
Lukoschek, V. and M.I. McCormick, 2001. Ontogeny of diet changes in a tropical benthic carnivorous fish, Parupeneus barberinus (Mullidae): relationship between foraging behaviour, habitat use, jaw size, and prey selection, Marine Biology, 138, 1099-1113.
McCormick M.I., 1993, Development and changes at settlement in the barbel structure of the reef fish, Upeneus tragula (Mullidae), Environmental Biology of Fishes, 37, 269-282.
Randall J.E., 2001, Mullidae. Goatfishes (surmulets), In: K.E. Carpenter and V. Niem (eds), The living marine resources of the Western Central Pacific, Vol. 5, Bony fishes part 3 (Menidae to Pomacentridae), pp. 3175-3200, Food and Agricultural Organization of the United Nations (FAO), Rome.
Randall J.E., 2004, Revision of the goatfish genus Parupeneus (Perciformes: Mullidae), with descriptions of two new species, Indo-Pacific Fishes, 36, 64 p.
Řehulková E., Justine J.-L., Gelnar M., 2010, Five new monogenean species from the gills of Mulloidichthys vanicolensis (Perciformes: Mullidae) off New Caledonia, with the proposal of Volsellituba n. g. and Pennulituba n. g. (Monogenea: Dactylogyridae), Systematic Parasitology, 75, 125-145.
Uiblein F., 2007, Goatfishes (Mullidae) as indicators in tropical and temperate coastal habitat monitoring and management, Marine Biology Research, 3, 5, 275–288.
Uiblein F., Heemstra P.C., 2010, A taxonomic review of the Western Indian goatfishes of the genus Upeneus (family Mullidae) with descriptions of four new species, Smithiana Bulletin, 11, 35–71.
Wahbeh M.I., Ajiad A., 1985, Reproductive Biology and Growth of the Goatfish, Parupeneus barberinus (Lacépède), in Aqaba, Jordan, Journal of Fish Biology, 26, 583-590.
Yahel R., Yahel G., Genin A., 2002, Daily cycles of suspended sand at coral reefs: a biological control, Limnology and Oceanography, 47,4, 1071-1083.
----------
La page de Parupeneus barberinus sur le site de référence de DORIS pour les poissons : FishBase
La page de Parupeneus barberinus dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.