Coquille presque circulaire, équivalve, équilatérale
Diamètre moyen de 13 à 25 mm
Coloration externe blanc laiteux
Valves lisses ornées de stries d’accroissement plus ou moins marquées
Umbo central
Crochets contigus et incurvés vers le côté antérieur
Deux dents cardinales bifides sur chaque valve
Une seule dent latérale dans chaque valve
Deux empreintes musculaires de forme différente
Ligne palléale en arc de cercle et continue
Lucine de Desmarest, loripes orbiculaire, petit ongle
Milkwhite moonshell, shiny moon clam (GB), Glänzende Mondmuschel (D), Melkwitte cirkelschelp (NL)
Loripes lacteus (Linnaeus, 1758) sensu Poli, 1791
Amphidesma lucinale Lamarck, 1818
Loripes lucinalis (Lamarck, 1818)
Loripes leucoma (W. Turton, 1822)
Lucina leucoma W. Turton, 1822
Arctoe lineolata Risso, 1826
Loripes desmarestii (Payraudeau, 1826
Lucina desmarestii Payraudeau, 1826
Lucina amphidesmoides Deshayes, 1832
Lucina lactoides Deshayes, 1846
Lucina luteola Deshayes, 1846
Lucina elata Locard, 1891
Loripes lacteus var. angulata Bucquoy, Dautzenberg & Dollfus, 1896
Loripes lacteus var. lenticularis Bucquoy, Dautzenberg & Dollfus, 1896
Manche, Atlantique Nord (centre et Est), Méditerranée et mer Noire
Zones DORIS : ● Europe (côtes françaises), ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ○ [Méditerranée française]Peu commune le plus souvent, cette lucine peut être abondante (plusieurs dizaines d’individus par m2) quand les conditions du milieu lui sont favorables.
Elle est présente sur la côte nord-est de l’Angleterre en mer du Nord, en Manche, de la côte sud du Royaume-Uni à la Bretagne. On la rencontre également en Atlantique Nord-Est, des côtes bretonnes au sud de la péninsule ibérique et le long des côtes africaines jusqu’au Sénégal. Elle fréquente les eaux des archipels de Madère et des Canaries ainsi que celles de la Méditerranée et de la mer Noire.
Cette espèce benthique* et endobionte* a une préférence édaphique* pour les sables fins ou les fonds de graviers plus ou moins vaseux, les prairies de zostères ou de posidonies (Posidonia oceanica) des étages médio- et infralittoral* jusqu’à 150 m de profondeur environ.
Elle est surtout présente dans des milieux réducteurs côtiers c’est-à-dire des biotopes* hypoxiques* (comme la vase noire présente près des émissaires d’eaux usées riches en hydrogène sulfuré ou sulfure d’hydrogène H2S).
Loripes orbiculatus possède une coquille presque circulaire, équivalve* et équilatérale*. Elle est convexe et solide, d’un diamètre moyen de 13 à 25 mm, jusqu’à 27 mm au maximum. Sa coloration externe est blanc laiteux, grisâtre ou légèrement teinté d’ocre. Les deux valves* sont lisses, ornées de stries plus ou moins marquées, généralement fines, indiquant les périodes successives d’accroissement. On remarque également de nombreuses et très fines lignes rayonnantes (seulement visibles à la loupe). On observe parfois un très mince périostracum*, teinté de beige ou jaunâtre. L’umbo*, central, est petit. Les crochets, assez saillants, sont contigus et incurvés vers le côté antérieur (prosogyres*). La lunule* est courte, assez profonde et cordiforme*. L’écusson* est absent et le ligament externe profondément encastré. La marge est lisse.
L’intérieur de la coquille est blanc mat. En observant la charnière hétérodonte*, on distingue sur chaque valve deux dents cardinales* discrètes, bifides*. Elles sont positionnées postérieurement dans la valve droite et antérieurement dans la valve gauche. Une seule dent latérale, antérieure et postérieure, est bien marquée dans chaque valve.
Le ligament* interne est corné, de couleur brun clair. Les muscles adducteurs* assurent la fermeture des valves en se contractant. L’empreinte musculaire antérieure, étroite et allongée, est linguiforme* ; la postérieure, plus large, est subovale. La ligne palléale*, empreinte du manteau à l'intérieur de la coquille, est en arc de cercle, parallèle au bord ventral et continue.
Le pied de l’animal est vermiforme, mince et allongé, bulbeux à son extrémité ; il fait plusieurs fois la longueur de la coquille. En plus de ses fonctions d’enfouissement, il forme, lorsque l’animal est enfoui, un tube renforcé par du mucus qui s’ouvre à la surface du sédiment.
Diplodonta rotundata (Montagu, 1803) : sa coquille est plus fine, plus globuleuse et moins parfaitement arrondie.
Lucinoma borealis (Linnaeus, 1767) : son diamètre est nettement plus grand (jusqu’à 40 mm) et ses côtes concentriques très marquées et bien régulières. Son périostracum* est brun foncé.
Chez les Lucinoides, le siphon* inhalant* a été perdu. Le pied vermiforme est utilisé pour construire un tube tapissé de mucus qui sert de siphon de substitution pour communiquer avec la surface. Le courant alimentaire et respiratoire entre antérieurement par ce passage et sort par le siphon exhalant* (voir schéma, photo 12).
Ce circuit d’eau lui permet d’assurer les fonctions de nutrition, de respiration et d’excrétion.
Les cils vibratiles qui garnissent les branchies* créent un courant d’eau qui rabat les particules alimentaires transitant à la surface du sédiment (bactéries, diatomées*, œufs et larves*, invertébrés du plancton*) vers les palpes* labiaux* puis vers la bouche et l’estomac. Ce dernier contient un petit bâtonnet de mucus solidifié, le stylet cristallin, qui recèle des enzymes* digestives. En tournant régulièrement grâce aux cils du sac gastrique, il participe à la désagrégation des particules alimentaires et facilite la digestion. A noter que ce stylet se dissout à chaque digestion avant de se reformer.
Des cellules endosymbiotiques*, appelées mucocytes, sécrètent du mucus dont le rôle est d’emballer et de transporter les particules alimentaires sur les branchies.
Dans les milieux vaseux, les conditions sont généralement toxiques pour la plupart des invertébrés en raison du niveau de sulfures qui proviennent de la décomposition anaérobie* de la matière organique par des bactéries sulfatées au fond des sédiments. D’autres bactéries endosymbiotiques des branchies, les bactériocytes, vont utiliser ce sulfure pour alimenter leur propre métabolisme et procurer à l’hôte des nutriments indispensables.
Loripes orbiculatus possède deux modes d’alimentation :
• Un mode « classique » chez les bivalves vivant enfouis comme Loripes orbiculatus. C’est un filtreur* suspensivore* microphage* c’est-à-dire que les cils vibratiles des branchies créent un courant d’eau qui aspire le phytoplancton* et les particules organiques par le tube muqueux propre aux lucinoidés. Ces aliments sont triés sur les branchies et enveloppés dans du mucus sécrété par des cellules spécialisées, les mucocytes. Cette nourriture hétérotrophe* est conduite, par les battements ciliaires, ensuite jusqu’aux palpes labiaux puis à la bouche et au tube digestif.
• Un mode particulier, de nombreuses bactéries sont capturées par des cellules spécialisées des branchies : les bactériocytes. Ces bactéries contiennent des enzymes* intervenant dans l’oxydation des composés soufrés comme l’hydrogène sulfuré ou sulfure d’hydrogène (H2S) présent dans les milieux réduits où la matière organique est incomplètement décomposée. Dans les milieux vaseux, les conditions sont généralement toxiques pour la plupart des invertébrés en raison du niveau de sulfures qui proviennent de la décomposition anaérobie* de la matière organique par des bactéries sulfatées au fond des sédiments.
Cette oxydation enzymatique de ces composés permet la synthèse de molécules riches en énergie (comme l’ATP ou Adénosine Tri Phosphate) qui sont utilisées pour réduire le dioxyde de carbone (le CO2) en carbone organique (la matière organique comme les glucides, les lipides et les protides). Ces bactéries sont uniquement présentes dans les branchies. Ces dernières jouent donc un double rôle : la respiration et la nutrition du mollusque.
Ces bactéries sont donc chimiautotrophes puisqu’elles produisent de la matière organique à partir de réactions chimiques minérales (contrairement à la photosynthèse qui nécessite de la lumière comme source d’énergie). Cette matière organique est ensuite transférée vers les différents organes de l’hôte comme le manteau et le pied.
Comme ces bactéries endocellulaires chimiosynthétiques assurent la plupart des besoins nutritionnels du mollusque, il s’agit donc d’une symbiose*.
L’animal fournit le logement et assure l’apport de nutriments (composés soufrés, dioxyde de carbone ...) et les bactéries fournissent de la matière organique.
Ces bactéries sont donc des endosymbiontes.
Loripes orbiculatus est également soupçonné de digérer ses propres symbiotes.
Ces bivalves sont donc considérés comme mixotrophes puisqu’ils peuvent compter sur une alimentation particulaire retenue sur les branchies et une alimentation fournie par les bactéries logées dans les branchiocytes.
D’ailleurs le tube digestif de ces mollusques est réduit mais tout à fait capable de digérer les particules nutritives qui y pénètrent.
Des changements de mode d’alimentation peuvent survenir suite à des modifications de l’offre alimentaire, ou lors de la reproduction ou du développement des individus en fonction de leur demande énergétique, la nourriture hétérotrophe étant plus gratifiante que les bactéries.
Les sexes sont séparés et il n’y a pas de dimorphisme* sexuel. Les spermatozoïdes* sont libérés dans l’eau de mer et fécondent les ovules* en pénétrant dans la cavité palléale des femelles (fécondation interne). Celles-ci produisent des masses d’œufs gélatineuses et transparentes d’un diamètre de 3 à 4 cm. Ces masses d’œufs sont connectées au tube muqueux de la femelle et éventuellement attachées aux feuilles des herbiers (Zostera sp. et Cymodocea sp.).
Les larves* sont enveloppées dans une structure fibreuse gélatineuse semblable à du collagène. Les larves trochophores* (après 8 jours) donneront des larves véligères* (après 12 jours) et ce seront des larves pédivéligères qui seront libérées et qui se métamorphoseront pour se poser sur le fond.
Les jeunes lucines n’acquerront les bactéries endosymbiotes qu’après la métamorphose*.
La période de ponte, assez brève, a lieu quand le seuil de température est atteint c’est-à-dire au printemps. Pour exemple, dans l’étang de Thau, la ponte a lieu à la fin du printemps et au début de l’été.
Chez les bivalves, à l’état adulte, les deux sexes ne sont pas en proportions égales. Chez Loripes orbiculatus on dénombre un peu plus de 64% de femelles.
Loripes orbiculatus vit en symbiose* avec des bactéries Candidatus Thiodiazotropha endoloripes oxydant le soufre.
Le nombre d'espèces de bivalves connues pour héberger des symbiotes* chimiosynthétiques est plus de vingt fois supérieur à celui des gastéropodes.
En Manche et en Atlantique Nord-Est , on note la présence d’un petit crustacé copépode ectoparasite* Hemicyclops cylindraceus (Pelseneer, 1929).
Dans la totalité de son aire de distribution, on observe l’existence de protozoaires* ectoparasite* Probovaria loripedes et endoparasite* Plagiospira crinila.
Le soufre présent dans les bivalves lucinides inhibe les taux d'ingestion d'un oiseau de rivage molluscivore (comme le bécasseau maubèche Calidris canutus (Linnaeus, 1758).
Les symbiotes de tous les Lucinidae, y compris Loripes orbiculatus, sont acquis dans le milieu environnant au cours du développement de l'animal, ce que l'on appelle la transmission horizontale.
Il est possible que les lucinides créent un environnement pour "cultiver" des symbiotes par le biais de leurs activités d'extraction de sulfures et de creusement en général.
Les bivalves lucinides peuvent apporter des quantités substantielles d'ammonium (NH4+) à l'écosystème*. Étant donné la préférence des herbiers marins pour cette source d'azote, la contribution des bivalves lucinides peut stimuler la productivité de ces importants écosystèmes.
En plus de ses fonctions d’enfouissement, le pied forme, lorsque l’animal est enfoui, un tube renforcé par du mucus qui s’ouvre à la surface du sédiment. Il va ainsi favoriser l’accès de l’eau au siphon* postérieur inhalant*. Il peut s’allonger parfois pour repousser les débris qui pourraient en obstruer l’ouverture.
Loripes orbiculatus est un bivalve dimyaire* anisomyaire* intégripallié*.
Cette espèce est comestible. Elle était récoltée (dans les zones salubres) et consommée en Italie notamment dans la région de Naples sous le nom vulgaire de Lupino. De saveur délicate elle entrait dans la composition de sauces appréciées des gourmets.
Ce mollusque bivalve est souvent rejeté en grand nombre sur les plages de la Manche et de l’Atlantique Nord-Est après un coup de vent.
Lucine : francisation de l’ancien nom de genre Lucina. En référence à la déesse latine de la lumière invoquée lors des accouchements, peut-être en raison de la blancheur immaculée de la coquille.
lactée : qui ressemble au lait par sa couleur blanche.
Loripes : substantif latin = qui a les pieds en lanières, en forme de bande. Le pied des animaux de ce genre est vermiforme, fin et allongé. Ce nom de genre a été créé par le naturaliste italien Giuseppe Saverio Poli (1745-1825).
orbiculatus : nom latin = orbiculaire, arrondi. Comme la forme de cette coquille.
Numéro d'entrée WoRMS : 875379
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Bivalvia / Lamellibranchia / Pelecypoda | Bivalves / Lamellibranches / Pélécypodes | Mollusques aquatiques, filtreurs, au corps comprimé latéralement. Coquille composée de 2 valves articulées disposées de part et d’autre du plan de symétrie. Absence de tête, de pharynx, de radula et de glande salivaire. |
| Sous-classe | Autobranchia | Autobranches | |
| Infra-classe | Heteroconchia | Hétéroconchie | |
| Subter-classe | Euheterodonta | Euhétérodonte | |
| Super ordre | Imparidentia | Imparidenties | |
| Ordre | Lucinida | Lucinides | |
| Super-famille | Lucinoidea | ||
| Famille | Lucinidae | Lucinidés | |
| Sous-famille | Lucininae | Lucininés | |
| Genre | Loripes | ||
| Espèce | orbiculatus |
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Bivalve blanchâtre aux coquilles quasi circulaires
Ces bivalves, de forme circulaire d'une vingtaine de mm, ont été trouvés par petit fond sous le sable de l'étang de Berre.
Notez que les espèces méditerranéennes de Lucinidae se ressemblent beaucoup.
Istres, étang de Berre (13), 2 m
31/05/2020
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Stries d'accroissement et périostracum
Les stries d’accroissement sont plus ou moins marquées. On remarque sur l'individu de droite un léger périostracum beige plus accentué vers la marge de la coquille.
Istres, étang de Berre (13), 2 m
31/05/2020


Parmi les zostères
Cette espèce benthique vit le plus souvent dans les prairies de zostères (Zostera marina) de l’étage médiolittoral inférieur.
Trébeurden (22), estran
04/03/2011


Umbo et crochets
L’umbo est central et les crochets sont incurvés vers le côté antérieur.
Trégastel (22), estran
31/01/2014


Stries d’accroissement et lignes rayonnantes
Les deux valves sont lisses, ornées de stries d’accroissement plus ou moins marquées et de nombreuses et très fines lignes rayonnantes.
Trébeurden (22), estran
05/02/2011


Empreintes musculaires et ligne palléale
L’impression (ou empreinte) musculaire antérieure (en bas sur la photo) est étroite et allongée, la postérieure est subovale. La ligne palléale est en arc de cercle, parallèle au bord ventral et continue.
Trébeurden (22), estran
05/02/2011
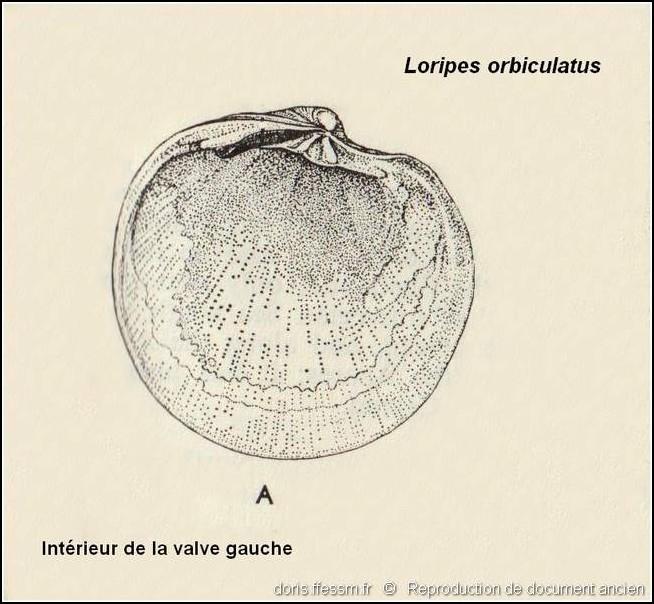
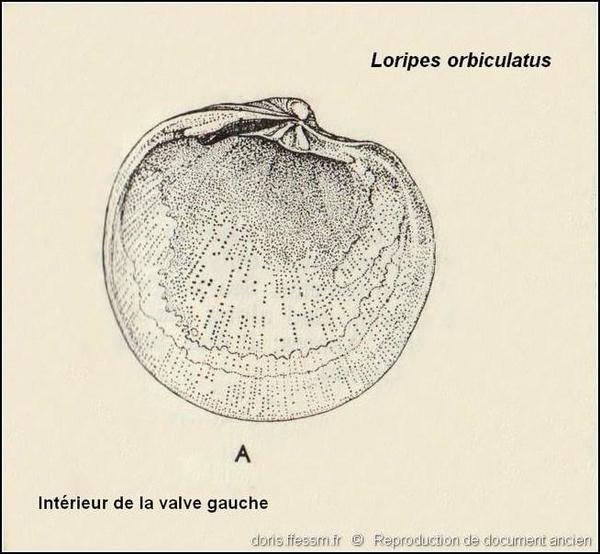
Intérieur de la valve gauche
Détails de l’intérieur de la valve gauche : charnière, empreintes musculaires, ligne palléale (exemplaire récolté dans le Sussex sur la côte sud de l’Angleterre).
Dessin ancien de N. Tebble dans l’ouvrage British Bivalve Seashells.
Reproduction de documents anciens
1976


Pied vermiforme
Le pied de l’animal est vermiforme, mince et allongé et fait plusieurs fois la longueur de la coquille.
Fig 1, planche 114 dans l'ouvrage "The genera of recent mollusca arranged according to their organization" de H. Adams et A. Adams. Vol. III, C1.
Reproduction de documents anciens
1858
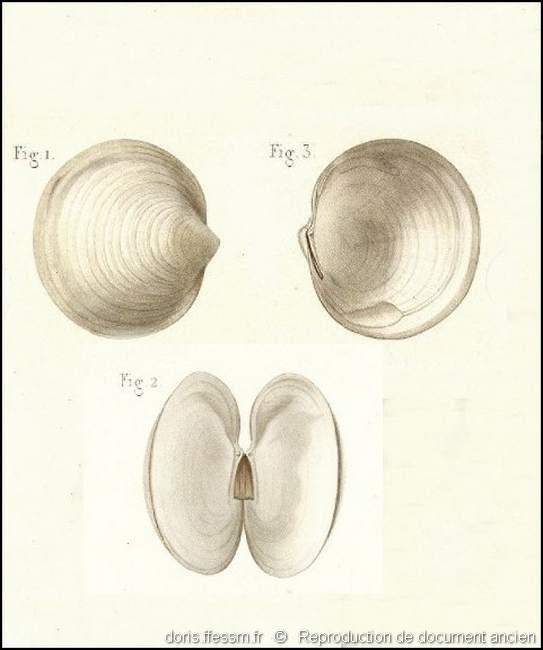
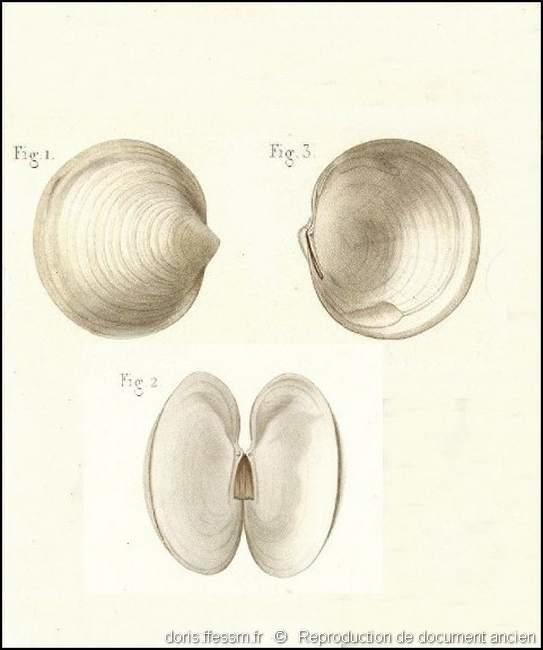
Extérieur et intérieur des valves
Lucina lactoides pl. 80, n° 1 à 3 dans l’ouvrage de G. P. Deshayes : « Exploration scientifique de l'Algérie. Histoire naturelle des Mollusques. Tome premier. Mollusques Acéphalés ».
On remarque sur la fig.2 le ligament interne corné et de couleur brun clair.
Reproduction de documents anciens
1846
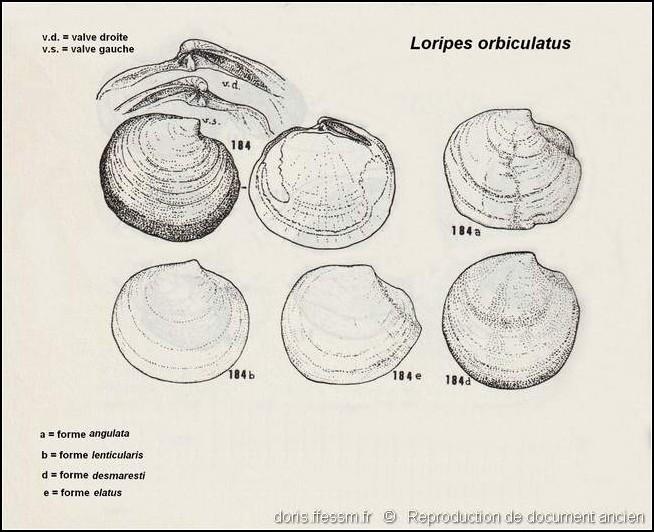
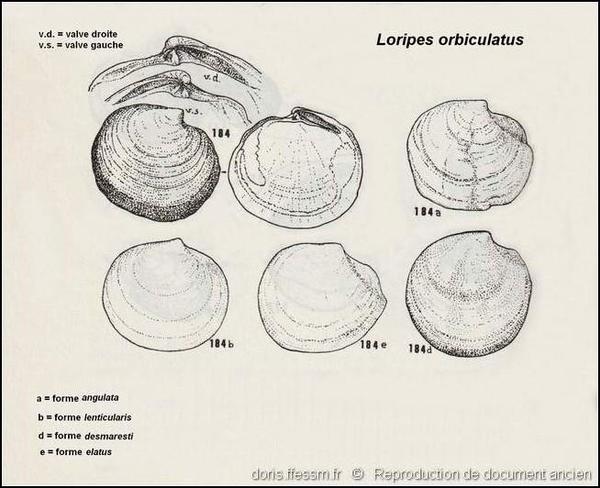
Différentes formes
Quelques formes de Loripes lacteus dont les noms, non reconnus, sont tous regroupés sous le nom de Loripes orbiculatus.
Dessins dans "Carta d'identità delle conchiglie del Mediterraneo" voL. II, partie 1 de P. Parenzan.
Reproduction de documents anciens
1974


Gravure ancienne
Les échantillons n° 1 à 4 ont été récoltés dans le Gard (30), les n° 5 à 9 au Croisic (44) et les n° 10 à 13 dans le golfe de Gabès (Tunisie).
Fig. n° 1 à 13 de la planche 89, dans l’ouvrage "Les mollusques marins du Roussillon" Tome II Pélécypodes de E. Bucquoy, Ph. Dautzenberg et G. Dollfus.
Reproduction de documents anciens
1887-1898
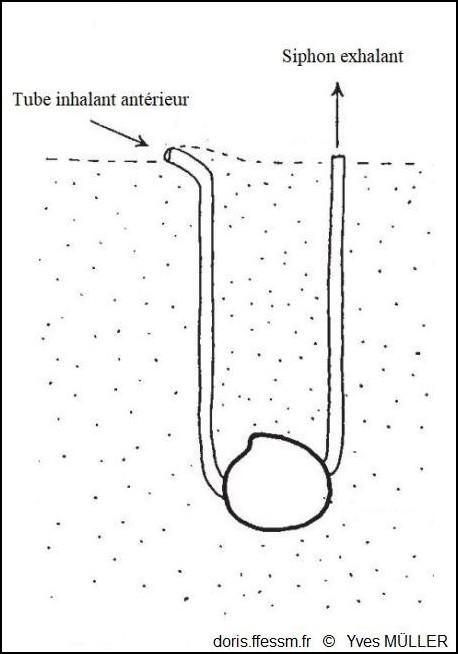
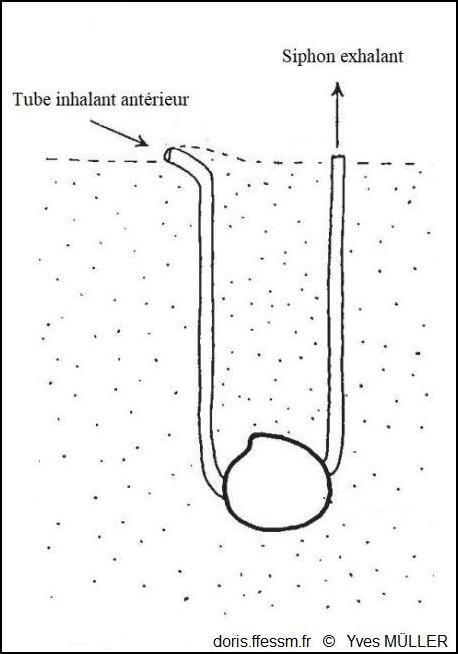
Dans le sédiment, une disposition originale !
Le tube muqueux inhalant antérieur a été formé par le pied car le siphon inhalant a été perdu au cours de l’évolution.
D’après J.A. Allen dans l’ouvrage « Function of the Foot in the Lucinacea (Eulamellibranchia) », 1953, fig. 2.
2024
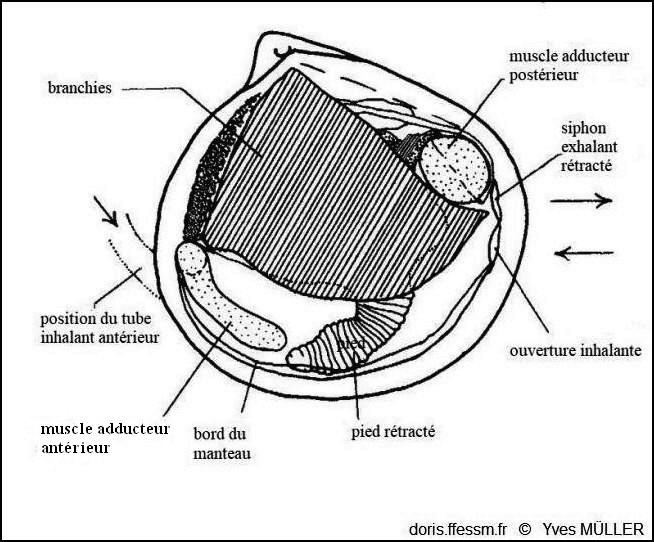
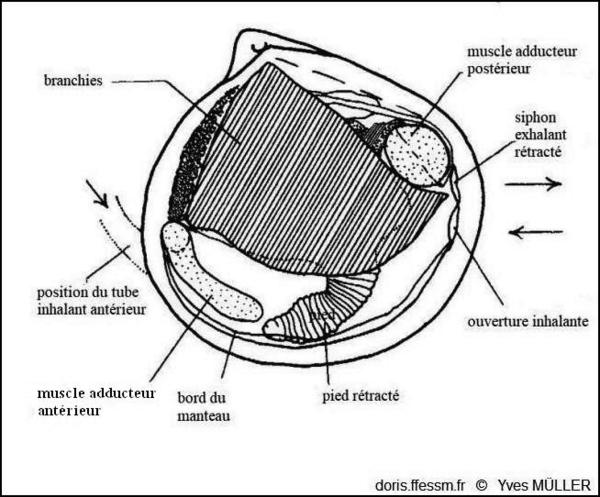
Anatomie
Anatomie de la valve droite de Loripes orbiculatus.
D’après J.A. Allen dans l’ouvrage « Function of the Foot in the Lucinacea (Eulamellibranchia) », 1953, fig. 1.
2024
Rédacteur principal : Philippe LE GRANCHÉ
Correcteur : Yves MÜLLER
Responsable régional : Philippe LE GRANCHÉ
Allen J.A., 1953, Function of the Foot in the Lucinacea (Eulamellibranchia), Nature, 171, 1117–1118.
Allen J.A., 1958, On the basic form and adaptations to habitat in the Lucinacea (Eulamellibranchia), Philosophical Transactions of the Royal Society of London, Serie B, Biological Science, 241(684), 421-484.
Cardini U., Bartoli M., Lücker S., Mooshammer M., Polzin J., Lee R. W., 2019, Chemosymbiotic bivalves contribute to the nitrogen budget of seagrass ecosystems, ISME Journal, Multidisciplinary Journal of Microbial Ecology, 13, 3131–3134.
Cardini U., Marin-Guirao L., Montilla L.M., Marzocchi U., Chiavarini S., Rimauro J., Quero G.M., Petersen J.M., Procaccini G., 2022, Nested interactions between chemosynthetic lucinid bivalves and seagrass promote ecosystem functionning in contaminated sediments, Frontiers in Plant Science, 13, 1-12.
Herry A, Diouris M, Le Pennec M.,1989, Chemoautotrophic symbionts and translocation of fixed carbon from bacteria to host tissues in the littoral bivalve Loripes lucinalis (Lucinidae), Marine Biology, 101, 305-312.
Hughes I.V., Girguis P.R., 2023, A molluscan class struggle: exploring the surprisingly uneven distribution of chemosymbiosis among two major mollusk groups, Frontiers in Marine Science, 10, 1167803, 1-10.
Johnson M.A., Diouris M., Le Pennec M.,1994, Endosymbiotic bacterial contribution in the carbon nutrition of Loripes lucinalis (Mollusca:Bivalvia), Symbiosis, 17, 1-13.
Johnson M., Fernandez C., 2001, Bacterial symbiosis in Loripes lucinalis (Mollusca: Bivalvia) with comments on reproductive strategy, Journal of Marine Biological, Association of United Kingdom, 81, 251-257.
Le Pennec M., Herry A., Diouris M., Moraga D., Donval A., 1988, Chimioautotrophie et nutrition chez les Lucinacea, bivalves littoraux de milieux reducteurs. II. Caractéristiques morphologiques des bacteries symbiotiques et modifications structurales adaptatives des branchies de l'hôte, Haliotis, 18,207-217.
Oortwijn T., de Fouw J., Petersen J.M., van Gils J., 2022, Sulfur in lucinid bivalves inhibits intake rates of a molluscivore shorebird, Oecologia, 199, 69-78.
Osvatic J., Windisch J., Yuen B., Hausl B., Polzin J., Petersen J., 2020, Chemosymbiotic lucinid clams modify the physical, chemical and biological characteristics of marine sediments globally, EGU General Assembly, 2020.
Pales-Espinosa E., Tanguy A., Le Panse S., Lallier F, Allam B., Boutet I., 2013, Endosymbiotic bacteria in the bivalve Loripes lacteus : localization, characterization and aspects of symbiont regulation, Journal of Experimental Marine Biology and Ecology, 448, 327-336.
Roques C., Grousset E., Troussellier M., Hermet S., Le Carrer J., Sar Ch., Caro A., 2020, A trade-off between mucocytes and bacteriocytes in Loripes orbiculatus gills (Bivalvia, Lucinidae): a mixotrophic adaptation to seasonality and reproductive status in a symbiotic species ?, Marine Biology, 167, 10, 1-34.
Rossi F., Colao E., Martinez M-J., Klein J., Carcaillet F., Callier M., De Wit R., Caro A., 2013, Spatial distribution and nutrition requirements of the endosymbiont-bearing bivalve Loripes lacteus in a Mediterranean Nanozostera noltii meadow, Journal of Experimental Marine Biology and Ecology, 440, 108-115.
Yuen B., Polzin J., Petersen J.M., 2019, Organ transcriptomes of the lucinid clam Loripes orbiculatus (Poli, 1791) provide insights into their specialised roles in the biology of a chemosymbiotic bivalve, BMC Genomics, 20, 820, 1-14.
Zauner S., Vogel M., Polzin J., Yuen B., Muβmann M., El-Hacen E-H. M., Petersen J., 2022, Microbial communities in developmental stages of lucinid bivalves, ISME Communications, 1-10.
La page de Loripes orbiculatus sur le site de référence de DORIS pour les mollusques : MolluscaBase
La page de Loripes orbiculatus dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.