Corps fusiforme et musculeux, manteau de 15 à 25 cm de longueur voire plus
Tête entourée de 8 bras avec 2 rangées de ventouses et 2 tentacules
2 gros yeux
Extrémité des tentacules en massue avec 4 rangées de ventouses, les ventouses médianes plus grandes
Nageoires se rejoignant à l’extrémité du corps s’étendant sur les 2/3 de la longueur du manteau
Changements de couleur rapides
Seul le mâle adulte peut présenter des marques colorées (pourpres) longitudinales fusiformes sur les côtés antérieurs du manteau
Encornet, calmar commun, calmar ;
Manche : calamar (Boulogne), cornet (Saint Valéry-sur-Somme, Barfleur), soquet (Saint Vaast), tifelek (Brest) ;
Atlantique : seiche anglaise (île de Ré), seiche rouge, lançaoù (Arcachon), cornet, corniche (Bayonne), chipiloua (Saint-Jean-de-Luz) ;
Méditerranée : calamar (Port-Vendres), glaougeau, glaouchoou (Sète), glaougeau, taouteno, toutene, toutène, toutenou, touteno (Provence), taut (Nice), supion (midi de la France).
European squid, squid, long-finned squid, sea arrow, inkfish, common squid, cape Hope squid (GB), Calamaro comune, totariello, calamaro, calamaro verace, calamaretto, totano gentile, calamaio, celinar (I), Gewöhnlicher Kalmar, roter gemeiner Kalmar, gewöhnlicher Kalmar, gemeiner Kalmar (D), Calamar, calamars (E, Catalan), Lura txibia (Galician), Txipiroiak (Basque), Lula-vulgar, lula-comum (Pt), Pijlinktvis, gewone pijlinktvis (NL), Europæisk loligo (DK), Oktapodi, chtapodis, kalamâri, kαλαμάρι (Grec), Srèdizemnomorskiy kalmar, severniy kalmar, kalmar (Russe), Scuid (Ecossais, Gaëlique), Kalamar, bülbülye kalmarya (Turc, Malte), Kalmar (Algérien, Bulgare), Sobbeit totanu (Egyptien), Habbar (Lybien), Mettik, mattiq (Marocain, Tunisien), Ulignja, lignja, kalmari, kallamari (Albanais), Krakatice (Tchèque), Kałamarnice, kalmar pospolity (Polonais), calmar (Roumain), Kalmáry (Slovaque), Lignji.(Slovène), Smokkfiskur (Icelandais), Kalmari (Finnois), Kalamari (Chypre).
Sepia loligo Linnaeus, 1758
Loligo pulchra Blainville, 1823
Loligo rangii Ferussac, 1835
Loligo berthelotii Vérany, 1839
Loligo neglecta Gray, 1849
Loligo breviceps Steenstrup, 1862
Loligo mediterranea Targioni-Tozzetti, 1869
Loligo affinis Lafont, 1871
Loligo microcephala Lafont, 1871
Mer du Nord, Manche, Atlantique Est, Méditerranée
Zones DORIS : ● Europe (côtes françaises), ○ [Méditerranée française], ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]Cette espèce est présente dans l’est de l'océan Atlantique, soit en mer du Nord, dans l’ouest de la Baltique, autour des îles Britanniques, sur les côtes françaises, à Madère, jusqu’à la Namibie (20°S). Elle est présente également en Méditerranée occidentale et orientale et en Adriatique.
Espèce néritique* semipélagique* démersale* qui habite la région circumlittorale dans les eaux tempérées. Elle vit de la surface jusqu’en haut du talus continental, mais plutôt dans des eaux de moins de 100 m de profondeur sur des fonds de sable grossier, de vase et d’autres, voire sur des herbiers. L‘encornet européen est présent dans des eaux de 12,5 °C à 20 °C avec une salinité de 30 ‰ (ou psu) en Atlantique nord et 38 ‰ (ou psu) en Méditerranée occidentale. Il peut supporter des eaux à plus faible salinité comme en mer Baltique.
Le manteau* de cette espèce est fusiforme et musculeux, son extrémité postérieure est arrondie (mais en vue dorsale l'extrémité postérieure apparaît pointue par la jonction des 2 nageoires).
La tête avec 2 gros yeux porte 8 bras avec des ventouses et 2 tentacules*. Les 8 bras portent deux rangées de ventouses (sans crochets) sur toute leur longueur.
Chez le mâle adulte, le bras ventral gauche est modifié en bras copulateur, le bras hectocotyle* (avec transformation des ventouses en papilles sur 1/4 à 1/3 de son extrémité).
Les 2 tentacules ne sont visibles que lors de la capture des proies ou chez
l'animal mort.
Les nageoires en position dorsolatérale forment un losange couvrant les 2/3 de la longueur du manteau à partir de l’arrière. Leurs bords postérieurs sont légèrement concaves.
Les yeux sont recouverts d’une mince membrane cornéenne transparente (caractéristique de l’ordre des Myopsides).
La longueur du manteau est la mesure de longueur utilisée chez ces animaux (la tête et les tentacules ne sont pas pris en compte dans cette mesure). Le manteau mesure 15 à 25 cm de longueur mais peut atteindre 30 à 40 cm voire plus chez les mâles.
L’animal change de couleur rapidement, le dessus du manteau peut être rouge vif avec des points bordés de couleurs vives lorsque les chromatophores* sont en pleine expansion. Des iridescences bleu-vert sont visibles sur la partie postérieure du manteau.
Seul le mâle adulte peut présenter des marques (flammes) colorées (pourpres) longitudinales fusiformes sur les côtés antérieurs du manteau.
Le genre Loligo comprend environ vingt espèces qui vivent dans toutes les mers ; seules deux espèces sont présentes dans l’est de l’Atlantique et en Méditerranée.
La seconde espèce est : Loligo forbesii Steenstrup, 1856, ou encornet veiné. Il est très proche de L. vulgaris mais la surface ventrale et les côtés du manteau* portent des marques (flammes) longitudinales de couleur orangé-rouge formées par les chromatophores*. Ces marques sont plus grandes, plus nombreuses et plus intensément colorées que chez L. vulgaris et sont présentes chez les deux sexes. Le bras ventral gauche (hectocotyle*) porte des papilles* (des ventouses modifiées) sur le tiers de son extrémité.
La longueur du manteau des mâles peut atteindre 90 cm et 40 cm chez les femelles. Mais la taille commune est de 20 à 40 cm de longueur. Les nageoires en losange couvrent les ¾ de la longueur du manteau. Les yeux sont plus grands et les ventouses des 2 rangées médianes de la massue tentaculaire sont de la même taille que celles des autres rangées.
La denticulation des anneaux cornés des ventouses des bras permet aussi de distinguer les deux espèces : 20 dents pour L. vulgaris, 7 à 8 dents pour L. forbesii.
Dans la zone Atlantique Nord-Ouest il y a : Loligo pealei Lesueur, 1821, et en Afrique du Sud : Loligo reynaudii d'Orbigny [in Férussac & d'Orbigny], 1839-1841.
D'autres calmars sont également présents dans notre région :
Des Loliginidés comme :
Alloteuthis media (Linnaeus, 1758) et Alloteuthis subulata (Lamarck, 1798) sur la même fiche : chez ces espèces l’extrémité postérieure du manteau est très pointue. Les Alloteuthis sont souvent confondus avec les jeunes Loligo.
Des Ommastrephidés comme :
Illex coindetii (Vérany, 1839) : le manteau est long et étroit plus large à l’extrémité antérieure. Les nageoires disposées à l’extrémité du manteau forment un cœur un peu évasé. L'extrémité postérieure apparaît ainsi pointue. L’extrémité en massue des deux tentacules porte de petites ventouses disposées en 8 rangées longitudinales. C’est une caractéristique du genre Illex car les autres Ommastrephidés n’ont que 4 rangées de ventouses à cet endroit.
Six autres espèces d'Ommastrephidés sont présentes dans l’Atlantique Nord-Est. Les représentants de cette famille (sauf le genre Illex) possèdent 4 rangées longitudinales de petites ventouses sur les massues des tentacules.
Les Loliginidés sont des prédateurs actifs jouant un rôle important dans le réseau trophique*.
Les calmars capturent leur proie en faisant jaillir les deux tentacules* munis de ventouses (uniquement sur les massues) et la ramènent dans la couronne des bras pour la maintenir. Leur bec corné (bec de perroquet) sert à déchiqueter la proie. Leur salive contient des substances neurotoxiques* (et de très nombreux enzymes et des neurotransmetteurs). La radula* sert à convoyer la nourriture.
L’identification des proies consommées est possible (mais délicate car il y a peu de restes solides), par l’étude du contenu stomacal, grâce aux otolithes* des poissons (qui sont bien préservés dans l’estomac faiblement acide), aux vertèbres et aux écailles, aux becs des céphalopodes et des fragments des exosquelettes des crustacés.
L. vulgaris se nourrit de poissons téléostéens bathypélagiques* comme des Gadidés (Micromestius poutassou, Merluccius merlucius), pélagiques*, des Clupéidés (Sardina pilchardus), des Carangidés (Trachurus trachurus), d’autres céphalopodes et également des poissons benthiques (Ammodytidés, Blennidés, Callionymidés, Gobiidés) et des annélides polychètes.
En Méditerranée, les grands individus de l'encornet européen consomment de préférence des espèces côtières comme des Sparidés et des Gobiidés. Les individus de petite taille se nourrissent plutôt d'organismes vivant sur le fond.
Le cannibalisme serait occasionnel.
Les jeunes encornets, peu après l’éclosion, capturent des larves* de crustacés et des crevettes de très petite taille.
Les céphalopodes sont des gonochoriques* stricts, ce qui signifie que les sexes sont séparés. Chaque individu ne se reproduit qu’une fois en fin de vie (semelparité*).
Chez le mâle, les spermatozoïdes sont enfermés dans une structure très élaborée, le spermatophore*. Celui-ci est un tube chitineux* étroit que le mâle passe à la femelle au moyen d’un bras modifié, l’hectocotyle*. Un mâle possède de nombreux spermatophores qu'il transmet à la femelle, lors de l'accouplement.
Ces accouplements ont en commun un caractère plus ou moins agressif, tournant souvent à la violence.
Le mâle de L. vulgaris saisit la femelle par la tête (accouplement en tête à tête) et dépose ses spermatophores sur la membrane buccale de sa partenaire. A cet endroit les spermatophores se dévaginent. Les spermatozoïdes libérés pénètrent dans la bourse copulatrice (réceptacle séminal) de la femelle où ils sont immobilisés par un liquide sécrété par des cellules spéciales de l'épithélium* de cette bourse. Les spermatozoïdes sont gardés dans la bourse copulatrice et, au moment de la ponte, les œufs sont fécondés quand ils passent devant la bouche dans la cavité formée par les bras.
La ponte a lieu toute l’année avec deux pics saisonniers (correspondant à des cohortes différentes). Le moment de ces pics varient selon les régions. La fécondité dépend de la taille de la femelle, du nombre et de la taille des spermatophores du mâle.
Les œufs de 2,2 mm x 1,6 mm sont disposés dans un cordon ou cartouche (une capsule gélatineuse). Dans chaque cordon de 6 à 16 cm de longueur, il y a 50 à 130 œufs et une femelle peut déposer 30 à 60 cordons. La « gelée » entourant les œufs, sécrétée par les glandes nidamentaires de la femelle, serait moins transparente et brillante que chez L. forbesii,
En général, les pontes sont attachées à des supports fixes, certaines fois sous des surplombs, dans des endroits où l’eau circule pour l’oxygénation, dans des eaux côtières, sur des fonds sableux ou vaseux entre 15 et 80 m de profondeur. Des pontes ont été observées sur des objets flottants. Les femelles de L. vulgaris, qui peuvent pondre plusieurs fois, ont tendance à déposer leurs cordons là où d'autres femelles de la même espèce ont déjà pondu, constituant ainsi parfois d'immenses amas de cordons.
Après un développement embryonnaire de 3 à quelques semaines selon les conditions environnantes, les petits qui éclosent ressemblent à des adultes, bien qu’ils ne mesurent que 2 à 3 mm de longueur du manteau* et mènent une vie planctonique* individuelle, (le corps est en position oblique à 45°) pendant 2 à 3 mois. Le passage de la vie planctonique à une vie plus ou moins benthique* a donc lieu avant que les animaux n'aient atteint l'âge de deux à trois mois.
Par l’analyse des statolithes (concrétions calcaires paires situées dans la tête, présentant des stries d’accroissement), la durée de vie des individus est estimée à 10 à 16 mois et la ponte est la phase terminale du cycle de vie d’un individu.
L’encornet européen est grégaire. Ce calmar vit en bancs de plusieurs individus de taille relativement proche.
Comme tous les animaux sauvages, les calmars sont des hôtes intermédiaires ou définitifs de parasites. Loligo vulgaris est un hôte intermédiaire important pour le nématode parasite Anisakis simplex afin de finir son cycle chez des prédateurs comme les mammifères marins.
Le copépode Pennella varians a été trouvé sur les branchies et diverses espèces de vers dans l'estomac, et le tube digestif, comme des cestodes (Scyphophyllidium pruvoti, Phyllobothrium loliginis), des trématodes Icancistrum loliginis et le nématode Filaria loliginis.
Le polychète Capitella hermaphrodita vit sur les enveloppes externes des capsules d'œufs et les mange sans attaquer les œufs.
Les calmars, comme les seiches, possèdent deux façons de se déplacer.
Lors de leur fuite en arrière, les calmars (ainsi que les seiches et les poulpes) peuvent éjecter un nuage d’encre afin de perturber ou leurrer l’agresseur.
Les rapides changements de couleurs sont assurés par l’expansion des chromatophores* (cellules pigmentées) présentes sur tout le corps. Au repos, les chromatophores sont petits et grands quand ils sont étendus. Quand les fibres musculaires des chromatophores cessent de se contracter, le chromatophore revient à son état (petit) initial.
La rigidité du corps est en partie assurée par une mince lame chitineuse* transparente présente dorsalement presque droite et un peu dilatée à la partie supérieure, la plume (ou gladius). Cette structure correspond à la base chitineuse d'une coquille régressée dont la calcification a été perdue.
Les jeunes individus, plus particulièrement, effectuent des migrations verticales quotidiennes liées à l’alimentation. Ils restent près du fond pendant la journée puis se dispersent dans la colonne d’eau pendant la nuit.
Les populations de l'Atlantique Nord-Est hivernent dans les eaux plus profondes au large des côtes françaises puis migrent plus au nord de mai à juin-juillet, dans la mer du Nord pour frayer. Une migration similaire, du golfe de Gascogne et des eaux plus méridionales vers la Manche se produit probablement également. Les migrations vers le sud ont lieu à l'automne.
En Méditerranée occidentale, les calmars européens migrent vers des eaux plus profondes à la fin de l'automne ; les plus gros individus commencent leur migration vers les côtes dès janvier et février, suivis en été par les plus petits.
Bien que vivant normalement près du fond, l’animal peut monter en pleine eau, notamment en chassant des proies.
Les Loligo sont des espèces comestibles faisant l'objet d'une pêche occasionnelle ou ciblée, intense et réglementée (chalut de fond, chalut pélagique, filets, lamparos, lignes). Le maintien des populations semble satisfaisant.
Les céphalopodes ont tendance à concentrer rapidement les métaux lourds (ou éléments traces métalliques) et autres substances toxiques dans leurs tissus, ce qui joue un rôle important dans la bioaccumulation* de ces polluants chez les prédateurs marins et a des implications pour la consommation humaine. Des niveaux élevés de cadmium et de mercure sont souvent enregistrés dans les tissus des céphalopodes, mais uniquement dans la glande digestive (qui ne se consomme pas). Il n’y a aucune accumulation de métaux dans les tissus muculaires (le manteau qui se mange).
Les calmars font partie des réseaux trophiques* marins. Des becs de Loliginidae ont été identifiés dans les contenus stomacaux de mammifères marins et de poissons prédateurs :
La baleine à bec commune (Hyperoodon ampullatus), le dauphin commun (Delphinus delphis ), le dauphin rayé (Stenella coeruleolba), le grand dauphin (Tursiops truncatus), le dauphin à flancs blancs de l'Atlantique (Lagenorhynchus acutus), l’épaulard ou orque (Orcinus orca), le globicéphale noir (Globicephala melas), le dauphin de Risso (Grampus griseus), le marsouin (Phocoena phocoena), le cachalot pygmée (Kogia breviceps), le grand cachalot (Physeter macrocephalus), le phoque gris (Halichoerus grypus), le phoque veau marin (Phoca vitulina), des poissons comme la morue franche (Gadus morhua) et la baudroie (Lophius piscatorius), la grande sériole (Seriola dumerili), l’espadon (Xiphias gladius), le sabre (famille des Trichiuridés) et même un oiseau, le grand labbe (Catharacta skua).
Les calmars possèdent des axones (fibres nerveuses des neurones) géants qui peuvent avoir un diamètre de 1,5 mm. Ces axones permettent une transmission de l’information nerveuse optimale et rapide aux muscles, ce qui permet une locomotion performante.
Ces axones géants ont été observés par L.W. Williams en 1909 et redécouverts par J.Z. Young en 1939. Cette caractéristique particulière a permis l'étude du fonctionnement des messages nerveux par Sir A. Huxley et Sir A. Hodgkin (tous les deux prix Nobel en 1963 pour ces travaux).
Les calmars sont répartis dans deux ordres : les Myopsides et les Œgopsides, selon la présence (Myopsides) ou l’absence (Œgopsides) d’une membrane cornéenne transparente couvrant l’œil. Les Loliginidés sont des Myopsides.
Calmar est l'appellation utilisée par les naturalistes.
Calamar : du latin [calamus] = calame, roseau. La plume (ou gladius) étant, comme le roseau, taillée pour l'écriture dans l'Antiquité. Ce terme est, de nos jours, davantage utilisé sur les étalages des poissonniers et en gastronomie.
Encornet : nom littéral qui exprime la forme du manteau*.
Loligo : du latin [lolligo] = seiche, calmar, nom utilisé par Pline, repris et modifié par le naturaliste allemand Johann Gottlieb Schneider (1750-1822) en 1784, puis en 1798 par le naturaliste Jean Baptiste de Lamarck (1744-1829) pour établir les caractéristiques du genre.
vulgaris: du latin [vulgaris] = ordinaire, commun, banal.
Numéro d'entrée WoRMS : 140271
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Cephalopoda | Céphalopodes | Yeux complexes, coquille interne, externe cloisonnée ou absente, cavité palléale musclée, siphon musculeux, tentacules ou bras (munis de ventouses). |
| Sous-classe | Coleoidea | Coléoïdes | Ventouses sur les bras, au nombre de 8 au moins. Bras hectocotyle chez le mâle pour le transfert des spermatophores. 2 branchies, 2 néphridies, une coquille interne ou vestigiale, des chromatophores, une poche à encre, un grand cerveau. |
| Super ordre | Decapodiformes | Décapodiformes / Decabrachia | Céphalopodes à 8 bras et 2 tentacules de chasse. |
| Ordre | Myopsida | Myopsides | Calmars possédant une membrane cornéenne transparente recouvrant l'œil. Les tentacules et les bras portent des ventouses mais jamais de crochets. Cet ordre comprend 2 familles (dont les Loliginidés) et peu d'espèces mais ces dernières sont pour la plupart côtières et donc plus familières. |
| Famille | Loliginidae | Loliginidés | Calmars côtiers et peu profonds. Certaines espèces tolèrent de faibles salinités. Les nageoires se rejoignent à l'extrémité postérieure du corps et peuvent s'étendre sur une partie ou sur toute la longueur du manteau. Les bras portent généralement 2 rangées de ventouses et les massues tentaculaires en portent 4 rangées. Le bras inférieur gauche est généralement modifié chez les mâles adultes (bras hectocotyle). |
| Genre | Loligo | ||
| Espèce | vulgaris |
 Céphalopodes
Céphalopodes

La taille d'une main
La taille courante d'un calmar (hors tentacules), varie de 20 à 30 cm. Certaines espèces peuvent être plus grandes.
Commentaires du photographe : ce calmar était seul, fortement attiré par la lumière de nos lampes de plongée, et très mobile (hélas pour les photos).
Colera (Espagne), Punta Negra, environ 15 m, de nuit
15/07/2014
 Céphalopodes
Céphalopodes

Bouquet multicolore
Du fantomatique à l'obscur, les calmars jouent à merveille de leur palette chromatique.
Antibes (06), 17 m, de nuit
21/10/2007


Rétro propulsion
Position de manœuvre, posture de chasse, cette attitude est pour le moins "calmardière".
Antibes (06), 10 m, de nuit
24/08/2008


Belle prise
Très vorace, le calmar s'en prend même aux proies presque aussi grandes que lui. Ici une athérine.
Antibes (06), 7 m, de nuit
27/07/2006


De nuit dans l'herbier
La nuit, les calmars privilégient les herbiers de posidonies pour la chasse aux crustacés et autres petites proies.
Antibes (06), 7 m, de nuit
04/11/2007


En train de pondre
Il n'est pas rare de trouver des pontes au plafond d'anfractuosités. Voici la maman en action.
Callelongue, Marseille (13), de nuit
21/02/2018


Sur la plage
Sur la plage, à marée basse, on peut voir ces amas de cordons gélatineux. Ce sont les pontes qui ont été décrochées de leur support. Si la ponte est âgée, on peut observer avec une loupe les jeunes calmars avec leurs chromatophores.
Sur la plage à marée basse, Leffrinckoucke (59)
07/06/06
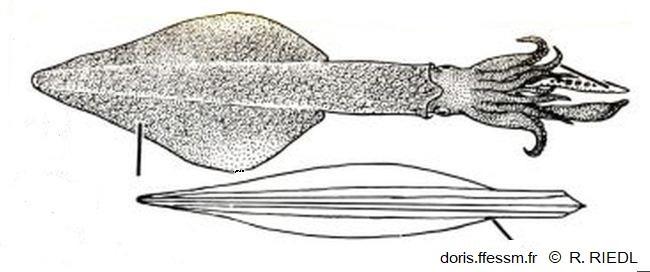
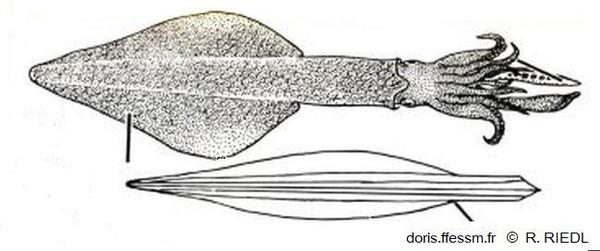
Dessin de l'encornet européen et de sa plume
La seule partie du corps assurant
une certaine rigidité est la plume (ou gladius), structure transparente chitineuse.
Dessin extrait de la planche 135 page 386 de Riedl
Reproduction de documents anciens
1983


Juvénile
Un jeune calmar vient d'éclore. Une mosaïque de disques colorés, les chromatophores, parsème son manteau.
Observation en laboratoire, ex-situ.
Bretagne, en laboratoire
2007
Vidéo : Loligo vulgaris
Les marques longitudinales sur le
côté du manteau sont bien visibles chez ce spécimen.
Anse de Bertheaume, Plougonvelin (29), 9m, de nuit
25/07/2002


Dessin de Loligo vulgaris
Dessin de G. Jatta, 1896, pl. 3, fig. 1
Reproduction de documents anciens
1896
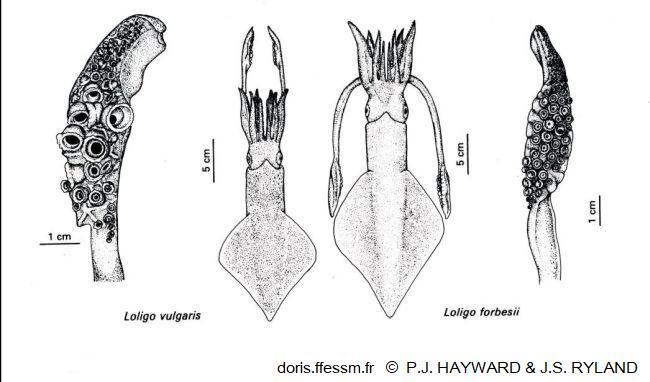
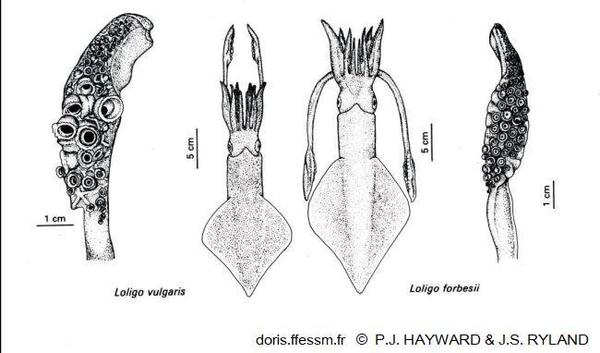
Comparaison de Loligo vulgaris et Loligo forbesii
La longueur du manteau est plus importante chez le second et ses nageoires couvrent une plus grande longueur de ce manteau. Les massues des tentacules ont de plus grandes ventouses chez L. vulgaris.
Dessin extrait de la planche 13-18 page 791 de Hayward & Ryland 1990
Reproduction de documents anciens
1990
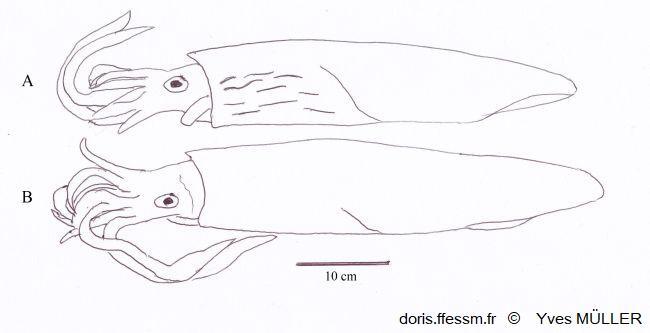
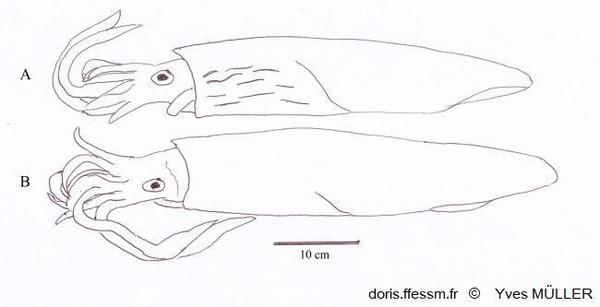
Comparaison de Loligo vulgaris et de Loligo forbesii
Apparence externe de deux grands mâles de :
A – Loligo forbesii montrant sur l’avant et le côté du manteau les marques (flammes) colorées et nombreuses, présentes chez les deux sexes.
B – Loligo vulgaris chez lequel de telles marques peuvent être présentes, moins nombreuses et uniquement chez les mâles (comme sur la vidéo présentée).
Schéma effectué d’après une photographie de Andy Lucas in Jereb & al, 2015, page 140, fig. 12.4
14/01/2022
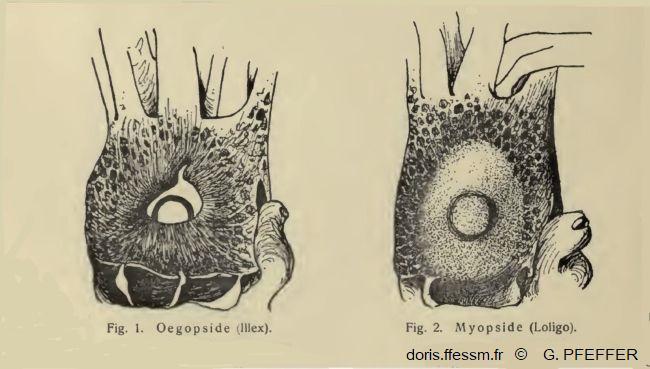
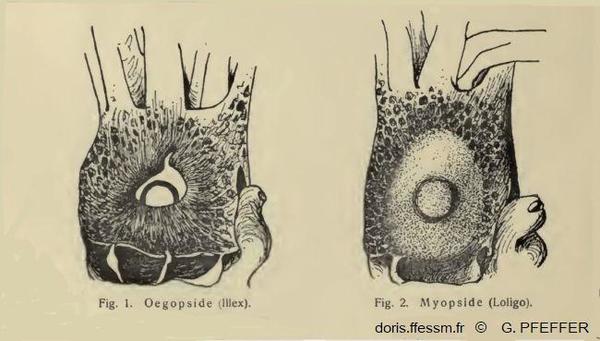
Comparaison de l'œil chez les Myopsides et les Œgopsides
Fig. 1 : Tête de Illex vue du côté droit, l'œil n'est pas recouvert d'une membrane cornéenne transparente. Ordre des Œgopsides.
Fig. 2 : Tête de Loligo vue du côté droit, l'œil est recouvert d'une membrane cornéenne transparente. Ordre des Myopsides.
Les calmars sont répartis dans deux ordres : les Myopsides et les Œgopsides, selon la présence ou l’absence d’une membrane cornéenne transparente couvrant l’œil. Les Loliginidés sont des Myopsides.
D'après deux dessins de G. Pfeffer 1901, IV, page 10.
Reproduction de documents anciens
1901


Plume ou gladius de calmar
C'est ce qui reste d'un calmar après disparition des tissus. Cette structure correspond à une coquille régressée à l'état d'une lamelle chitineuse, elle assure la rigidité du corps de l'animal.
Au fond de la forme 4, Dunkerque (59), 8 m
16/02/07
Rédacteur principal : Yves MÜLLER
Rédacteur : Michel PEAN
Vérificateur : Laure BONNAUD-PONTICELLI
Responsable régional : Yves MÜLLER
Boletzky S. von.,1998, Cephalopod eggs and egg masses Oceanography and Marine Biology Annual Review, 36, 341–371.
Boletzky S. von., 1987, On egg and capsule dimensions in Loligo forbesi (Mollusca: Cephalopoda) : A note, Vie et Milieu, 37(3/4), 187-192.
Guerra A., Rocha F.,1994, The life history of Loligo vulgaris and Loligo forbesi (Cephalopoda: Loliginidae) in Galician waters (NW Spain), Fisheries Research, 21(1–2), 43-69.
Hastie L.C., Pierce G.J., Wang J., Bruno I., Moreno A., Piatkowski U., Robin J.P., 2009, Cephalopods in the north-eastern Atlantic: species, biogeography, ecology, exploitation and conservation, Oceanography and marine biology : an annual review, 47, 111–190.
Holme N.A., 1974, The biology of Loligo forbesi Steenstrup (Mollusca: Cephalopoda) in the Plymouth area, Journal of the Marine Biology Association of the United Kingdom, 54, 481-503.
Jatta G., 1896, I Cefalopodi, Monographie N°23, Atlante di 31 tavole, Fauna und Flora des Golfes von Neapel und der Angrenzenden Meeres-Abschnitte heraugegeben von der Zoologischen Station zu Neapel.
Jereb P., Allcock A.L., Lefkaditou E., Piatkowski U., Hastie L.C., Pierce G.J., 2015, Cephalopod biology and fisheries in Europe II species accounts, ICES International Council for the Exploration of the Sea Cooperative Research Report N° 325, 376p.
Mangold-Wirz K., 1963, Biologie des Céphalopodes bentiques et nectoniques de la Mer Catalane, Vie et Milieu, Supplément 13, 285 p.
Mangold Wirz K., Boletzky S. von, 1987, CEPHALOPODES in Fischer W., Bauchot M-L., Schneider M., 1987, FICHES FAO D’IDENTIFICATION DES ESPECES POUR LES BESOINS DE LA PECHE (REVISION 1). MEDITERRANEE ET MER NOIRE, ZONE DE PECHE 37. VOLUME 1. VEGETAUX ET INVERTEBRES , CEE, FAO, Rome, 760p.
Naef A., 1921-1925, Cephalopoda part I, (vol.1), fascicle 1, Fauna and flora of the bay of Naples, Smithsonian Institution and the National Science Foundation, Washington, D.C.304 p.
Pierce G.J., Hastie L.C., Boyle P.R., Santos B., 1994, Diets of squid Loligo forbesi and Loligo vulgaris in the northeast Atlantic, Fisheries Research, 21, 149-163.
Pfeffer G., 1901-1911, IV Die Cephalopoden2 Bd. III Dolioliden, Salpen, Appendicularien, Ascidienlarven, IV Pteropoden, Cephalopoden, V Gastropoden, Acephalen in Brandt K. A. H. & Apstein C. NORDISCHES PLANKTON, ZOOLOGISCHER TEIL, Lipsius & Tischer 1-4, 5-10,11-21, 23-29, 31-47, 1-8, 9-116, 1-36, 37-55.
Sweeney M.J., Roper C.F.E., Mangold K.M., Clarke M.R., Boletzky S. von., 1992, « Larval » and juvenile Cephalopods : a manual for their identification, Smithsonian Institution Press, 282 p.
Tinbergen L.,Verwey J., 1945, Zur Biologie von Loligo vulgaris, Archives Néerlandaises de Zoologie, 7(1-2), 213-286.
La page de Loligo vulgaris dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.