Taille maximale documentée 40 cm, tailles supérieures à 22 cm communément rencontrées
Corps vu de dessus : oblong, pyriforme avec bords du manteau enroulés, ovale large quand bords déroulés
Bosse centrale mamelonnée longue et large
Massue des rhinophores orientée vers l’arrière
Branchies sans fourreau commun
Coloration très variable : rouge, rose, orange (avec ou sans taches plus claires, blanches ou jaunes)
Danseuse espagnole (utilisé par défaut pour toutes les espèces du complexe Hexabranchus)
Spanish dancer (GB), Spanische Tänzerin (D), Spaanse danseres (néerlandais) (noms utilisés par défaut pour toutes les espèces du complexe Hexabranchus)
Doris lacera Cuvier, 1804
Doris flammulatus Quoy & Gaimard, 1832
Doris marginata Quoy & Gaimard, 1832
Doris marginatus Quoy & Gaimard, 1832
Hexabranchus marginatus (Quoy & Gaimard, 1832)
Heptabranchus burnettii A. Adams, 1848
Heptabranchus burnettii A. Adams, 1848
Hexabranchus adamsii Gray, 1850
Doris sumptuosa Gould, 1852
Doris superba Gould, 1852
Hexabranchus sumptuosa (Gould, 1852)
Hexabranchus superba (Gould, 1852)
Doris gloriosa Kelaart, 1858
Hexabranchus gloriosus (Kelaart, 1858)
Aethedoris indica Abraham, 1877
Hexabranchus orbicularis Abraham, 1877
Hexabranchus anaiteus Bergh, 1878
Hexabranchus faustus Bergh, 1878
Hexabranchus punctatus Bergh, 1905
Indo-Pacifique, mer Rouge
Zones DORIS : ● Indo-PacifiqueHexabranchus lacer est documenté en mer Rouge et dans les zones tropicales et subtropicales de l’océan Indien et du Pacifique Ouest et centre.
Sur la bordure ouest de l’océan Indien, on la trouve du nord au sud du golfe d’Oman au nord de l’Afrique du Sud. Vers l’est, elle est documentée jusqu’en Malaisie en passant par les Comores, Madagascar, les Mascareignes*, les Maldives, les Seychelles, l‘Inde et la Thaïlande.
Sur la bordure ouest du Pacifique, on la trouve du sud du Japon à l’Australie ; vers l’est sa distribution s’étend jusqu’en Polynésie Française en passant par la Nouvelle-Calédonie et la plupart des îles présentes dans cette partie de l’océan Pacifique.
N.B. : le genre Hexabranchus a été révisé en 2023 (Tibiriçá et al) à partir de données moléculaires (ADN), anatomiques et morphologiques. Avant cette étude, la majeure partie de la communauté scientifique ne reconnaissait que deux espèces : H. sanguineus dans l’Indo-Pacifique et H. morsomus dans l’Atlantique. La révision a réparti ce que ses auteurs appellent le « complexe sanguineus » en cinq espèces différentes : H. aureomarginatus, H. giganteus, H. lacer, H. sandwichensis, et H. sanguineus. Elle situe trois d’entre elles (H. giganteus, H. lacer et H. sanguineus) dans tout le domaine indo-Pacifique, mer Rouge incluse. Les deux autres sont cantonnées au Pacifique Nord : H. aureomarginatus est endémique d’Hawaï et H. sandwichensis est présent à Hawaï et dans l’atoll Johnston.
Les adultes fréquentent les fonds détritiques*, sablo-détritiques ou
rocheux des plates-formes récifales et des côtes exposées. La distribution
verticale de l’espèce va de 1 m à, au moins, 42 m.
Les juvéniles sont fréquemment
trouvés dans la zone de balancement des marées ou par très petits fonds.
L’espèce semble éviter les zones de coraux vivants.
Description succincte : c'est un nudibranche de grande taille (jusqu’à 40 cm) dont les extensions latérales du manteau* sont habituellement enroulées autour d’une bosse dorsale mamelonnée longue et large. Ces extensions ne se déploient qu’en cas de danger, ou pour nager dans la colonne d’eau. Le patron de couleur est très variable : la couleur dominante peut être rouge, rose ou orange, avec ou sans taches plus claires à blanches, de taille et emplacement variables. Quand elles sont déployées, les extensions latérales du manteau montrent une bande blanche au profil très irrégulier qui entoure la bosse centrale ; puis vient une bande rouge à laquelle peut succéder une couronne rosée ou violacée éventuellement striée de rouge. La bande marginale est alors généralement blanche, mais elle peut être rouge. La massue des rhinophores* est orientée vers l’arrière, et les branchies* ne sont pas entourées d’un fourreau commun.
Description détaillée :
Le corps de ce grand nudibranche vu de dessus est oblong à légèrement pyriforme* quand les extensions latérales du manteau sont enroulées, et presque circulaire quand elles sont exposées. Le notum* présente une bosse centrale mamelonnée longue et large autour de laquelle la bordure du manteau* est enroulée quand l’animal n’est pas inquiété. Cette bosse est longitudinalement oblongue et de section arrondie. L’un des spécimens étudiés par les auteurs de la révision du genre mesure 40 cm ; les tailles supérieures à 22 cm sont communément rencontrées.
Les extensions latérales du manteau sont lisses avec des bords ondulés quand elles sont déployées. Elles sont étroites en partie antérieure de la tête et deviennent graduellement plus larges sur les côtés pour rétrécir à nouveau en partie postérieure.
La partie lamellée des rhinophores (la "massue"), en forme de pomme de pin, est orientée vers l’arrière et peut porter de 40 à 50 lamelles ; les hampes sont hautes et fortes, leur fourreau est très court.
Le nombre de branchies* est souvent supérieur à sept. Elles sont multipinnées*. Ces branchies n’ont pas de fourreau commun, ce pourquoi elles sont contractiles mais pas rétractiles. Elles sont organisées en cercle autour de la papille anale, qui est blanche et surélevée par un petit mamelon à droite duquel se trouve le pore rénal.
Le pied est large, mais moins que le manteau et il est presqu’aussi long ; on peut parfois observer sa partie postérieure dépassant de celle du manteau. Les organes génitaux mâles et femelles sont situés sous le manteau du côté avant droit. Deux tentacules oraux digités longs et larges sont placés de part et d’autre de la bouche.
Les auteurs de la révision distinguent trois morphes géographiquement répartis et dont les patrons de couleur diffèrent légèrement. Le morphe 1 est localisé dans l’ouest et le centre du Pacifique (incluant la Polynésie Française), le morphe 2 se rencontre à l’ouest de cet océan jusqu’aux îles Marshall, et le morphe 3 se trouve en mer Rouge et dans l’ouest de l’océan Indien jusqu’aux Maldives.
N.B. : l’espèce ayant été décrite en 2023, les descriptions qui suivent sont basées sur les planches de 16 à 20 photos par morphe proposées par les descripteurs, dont la majorité vient de sites en ligne d’amateurs spécialisés (le reste concerne les spécimens étudiés par les auteurs), et sur leurs descriptions très générales. L’échantillon et les informations sont donc trop limités pour être exhaustifs ; en conséquence, il existe probablement des aspects non documentés de l’espèce. Par ailleurs, les auteurs signalent que tous ses morphes n’ont pas pu être collectés.
Les points communs entre les patrons de couleur de ces morphes sont les suivants : pour la bosse centrale, la couleur de fond va du rouge à l’orange en passant par le rose. Ces couleurs sont plus ou moins densément mouchetées par une multitude de points blancs à jaunes (plus rarement rouges) généralement groupés en taches de taille variable et disposés aléatoirement. Le morphe 2 a généralement un aspect plus brouillé à cause du nombre et de la petite taille de ces marques, et chez lui le bord du manteau enroulé le long de la bosse centrale est souvent largement marqué de zones jaunes. Chez certains individus sexuellement matures des trois morphes, les marques blanches sont estompées jusqu’à leur donner l’apparence d’une couleur uniforme (forme appelée « sombre » par les auteurs), et chez d’autres des zones plus sombres que la couleur de fond, de taille variable, peuvent être présentes (forme appelée « nuageuse » par les auteurs). Des individus à couleur dominante blanche sont signalés dans les morphes 2 et 3, mais ils sont rares.
La base de la bosse centrale peut être colorée par un motif ondulé blanc qui apparaît, quand les extensions latérales sont déployées, comme la partie visible de la large bande blanche qui marque leur base. Une bande rouge succède à cette bande blanche ; chez certains individus des morphes 1 et 3, elle peut être bordée par une large bande submarginale rose à violine agrémentée de multiples stries rouges issues de la bande précédente. La bande marginale est blanche dans les morphes 1 et 2, et rouge ou blanche chez les grands adultes du morphe 3.
Les faces ventrales : celle du morphe 1 est d’une couleur orange à rouge densément mouchetée de points blancs. Celle du morphe 2 est de la couleur dominante du corps mouchetée de points rouges avec de nombreuses taches claires à blanches de forme très irrégulière aléatoirement distribuées. Celle du morphe 3 est de la couleur du corps, en version plus claire ou pas, avec de nombreuses taches claires à blanches aléatoirement distribuées. Dans les trois morphes, les bordures du manteau sont identiques à ce qu’elles sont sur la face dorsale. Les couleurs et motifs de la face ventrale se retrouvent sur les bords du pied, parfois en version affadie pour ce qui concerne la couleur, et ses bords portent un liseré jaunâtre à orange. Le dessous du pied est quant à lui de couleur uniforme. Ces couleurs se retrouvent aussi, points blancs inclus, sur les faces supérieure et inférieure des deux larges tentacules oraux.
Les branchies présentent généralement une version très claire à translucide de la couleur dominante avec des pointes souvent marquées de blanc et un rachis arborescent translucide à blanc veiné de rouge.
Les rhinophores ont une massue rouge, rose ou orange et les lamelles sont bordées de blanc. La hampe est blanche à points roses dans le morphe 1. Elle est rose à points blancs dans les morphes 2 et 3. Le fourreau est blanc à marge orange.
Dans sa distribution et dans la mesure où elle n’est pas présente à Hawaï (où se trouvent les deux espèces endémiques Hexabranchus aureomarginatus et H. sandwichensis), H. lacer ne peut être confondue qu’avec H. sanguineus et H. giganteus.
Hexabranchus sanguineus : parmi les différences avec H. lacer et ce, dans les quatre lignées de H. sanguineus établies par les auteurs de la révision du genre (voir la fiche concernée), le manteau de H. sanguineus n’est pas mamelonné et la massue des rhinophores est moins large. Du point de vue du patron de couleur, les lignées 3 et 4 peuvent prêter à confusion. Toutefois, chez les individus de la lignée 3 (localisée en Polynésie française), la massue des rhinophores est généralement jaune orangé à orange avec une hampe translucide plus ou moins teintée parsemée de points blancs groupés en rosettes ; dans la lignée 4, localisée dans l’ouest du Pacifique, les rhinophores sont orange et leur hampe est parsemée de points blancs.
Hexabranchus giganteus : cette espèce peut atteindre 70 cm avec une taille communément rencontrée de 50 cm. Sa distribution verticale va jusqu’à au moins 40 m. On la trouve en mer Rouge, dans l’ouest de l’océan Indien et dans le Pacifique Ouest. Les individus de taille inférieure à la moyenne de l’espèce peuvent donc être confondus avec de grands individus de H. lacer. Les différences les plus faciles à repérer sont 1) la bande marginale du manteau blanc jaunâtre à jaune, 2) les rhinophores fins et recourbés vers l’arrière, qui évoquent des cornes de chèvre ; leur massue plus longue et plus fine de couleur blanche, jaune ou beige en fonction de la couleur dominante et leur hampe uniformément blanche à jaunâtre avec un fourreau de même couleur, et 3) le rachis blanc à translucide des branchies, avec ou sans taches de la couleur du corps sur la base.
Pour simplifier : si l’individu à identifier a une bosse centrale mamelonnée (versus lisse), il ne peut pas s’agir d’H. sanguineus. Et s’il n’a pas des rhinophores fins en forme de cornes de chèvre, ce n’est pas non plus H. giganteus. Le seul candidat dans la distribution, Hawaï et l’atoll Johnston exclus, est alors H. lacer (ou une espèce inconnue).
La diète* de cette espèce très récemment décrite n’est pas encore documentée. Mais il est très probable que comme les deux espèces généralement admises avant la révision du genre (H. sanguineus et H. morsomus) elle se nourrisse essentiellement d’éponges.
La biologie de la reproduction n’est pas documentée pour cette espèce à la date de parution de cette fiche (02/2024). Toutefois, les nudibranches doridiens dans leur globalité sont hermaphrodites* simultanés (chaque individu produit des gamètes* des deux sexes et chacun est à la fois inséminateur et inséminé). Les organes génitaux se trouvent du côté droit de la partie antérieure du corps ; les individus voulant s’accoupler se placent donc en position tête-bêche.
La ponte d’Hexabranchus lacer se présente comme un ruban ondulé rose à rouge, relativement haut (il peut mesurer environ 4 cm) et enroulé en spirale. Le ruban est fixé sur le substrat* et, quoique d’une couleur très visible, il n’est jamais dissimulé. Les larves* sont pélagiques*.
Aspects des juvéniles :
Les caractéristiques partagées par les juvéniles de trois morphes sont les suivantes.
La partie postérieure du pied dépasse souvent largement celle du manteau, et cette extrémité est susceptible de porter des taches de la même couleur que les taches marginales ou centrales présentes sur le manteau.
Chez les très jeunes juvéniles, le manteau est nettement plus large en partie antérieure et ses bords ne sont pas enroulés le long de la bosse centrale.
Chez les juvéniles de taille moyenne, les bords du manteau commencent à s’ourler, la hampe des rhinophores est translucide (la massue peut varier en couleur), de même que les branchies (le rachis arborescent peut varier en couleur).
Chez les grands juvéniles, les bords du manteau sont enroulés.
Pour ce qui concerne les couleurs :
Morphe 1 : le petit juvénile est blanc cassé plus ou moins translucide, avec des marques beige pâle diffuses sur la bosse centrale. Il présente une esquisse de ligne submarginale blanche et une fine ligne marginale de même couleur entre lesquelles se distribuent à intervalles irréguliers des taches rouges plus ou moins rondes. La massue des rhinophores est blanche à pointe rouge. Le rachis des branchies est orange. Chez le grand juvénile, les marques beiges sont plus grandes, plus nombreuses, plus foncées et parfois coalescentes. Les taches en bordure du manteau sont violet foncé, elles sont aussiplus nombreuses. Les rhinophores et les branchies ne changent pas. Quel que soit l’âge, il n’y a pas de taches rouges sur la bosse centrale.
Morphe 2 : mêmes caractéristiques générales que le précédent mais avec une ligne submarginale beaucoup plus nette, une bande bleuissante en partie antérieure de la tête et des taches violettes, présentes aussi sur la bosse centrale.
Morphe 3 : le petit juvénile a le corps blanchâtre plus ou moins translucide, avec une ligne submarginale et une ligne marginale blanches, et des taches violettes entre ces lignes ainsi que sur la bosse centrale. La massue des rhinophores est blanche à pointe orange ; le rachis des branchies porte un début de marquage orange. Chez le grand juvénile, la bosse centrale est mouchetée de points blancs et porte des marques beiges à marron plus ou moins coalescentes, elles-mêmes marquées de points blancs. La massue des rhinophores est orange, leur hampe translucide est marquée de points blancs. Le rachis des branchies est orange. Chez les plus vieux juvéniles, une bande orange translucide marque le pourtour de la tête.
Juvéniles ressemblants :
H. sanguineus :
- Les juvéniles de la lignée 1 (mer Rouge et rarement ouest de l’océan Indien) ne sont pas documentés.
- Ceux de la lignée 2 (ouest de l’océan Indien) sont d’un gris plus ou moins translucide, la marge du manteau est blanche et il n’y a pas de ligne submarginale. Les rhinophores sont de la même couleur que le manteau jusqu’à la moitié de la massue, sa pointe est orange. Les branchies sont orange avec un rachis translucide.
- Les juvéniles de la lignée 3 (Polynésie française) ne sont pas documentés.
- Ceux de la lignée 4 (Pacifique Ouest) sont identiques à ceux de la lignée 2 à deux différences près : la couleur de fond peut aussi être jaune ou grise, et les deux couleurs sont mouchetées de blanc.
H. giganteus : les juvéniles sont d’un gris très pâle à bleuâtre avec des taches rose pâle diffuses. La bande marginale est blanche à jaunâtre. Les rhinophores sont orange avec une hampe rouge, et les branchies sont de couleur rouille avec un rachis arborescent blanc.
La crevette nettoyeuse Zenopontonia rex (ex- Periclimenes imperator), dont la relation commensale* avec Hexabranchus sanguineus est bien documentée, fréquente aussi H. lacer. Chez H. sanguineus on la trouve le plus souvent parmi les branchies et elle reste sur son hôte même pendant qu’il nage. Elle passe alors sous le manteau et se place dans le sillon formé par la jonction du pied et d’une extension latérale en maintenant ses pinces et ses antennes tendues devant elle. Il est probable que ces comportements ne varient pas en fonction de l’espèce-hôte et qu'on les retrouve dans sa relation commensale avec H. lacer.
La radula* est large et bilobée, avec une bande étroite dépourvue de dents à la jonction des deux lobes. Les lobes portent de nombreuses rangées de dents en forme d’hameçon orientées vers l’intérieur. Les formules radulaires* documentées sont très variables : elles vont de 30 à 51 rangs de dents avec de 36 à 69 dents par rang sur les côtés droit et gauche, et aucune dent au milieu.
Pour sa défense contre des prédateurs, Hexabranchus lacer semble disposer d’un premier argument dissuasif : dès que l‘animal est inquiété, il déroule les extensions latérales de son manteau, ce qui, outre le fait de plus que doubler sa surface précédente, expose soudainement des couleurs rouges et blanches très contrastées. Ces couleurs sont probablement aposématiques* (destinées à prévenir le prédateur que la proie représente un danger pour lui). Il pourrait y avoir un second argument d’ordre chimique, en supposant une stratégie identique à celle documentée chez H. sanguineus. Une étude menée dans les îles Marshall (Pawlik et al., 1988), montre que cette dernière est protégée contre les prédateurs par des métabolites* dérivés des éponges dont elle se nourrit. Ces métabolites sont concentrés sur sa face dorsale, la plus exposée aux morsures. En conditions expérimentales, les auteurs ont observé que le labre Thalassoma lunare et le pagure Dardanus megistos, tous deux carnivores, rejetaient les morceaux de tissu dorsal prélevés sur le nudibranche et se nourrissaient des morceaux de calamar qui leur étaient proposés en même temps. Les auteurs ont montré que les pontes du nudibranche étaient également protégées par ces métabolites, ce qui explique sans doute que les géniteurs ne cherchent jamais à les dissimuler.
Cette espèce est capable de nager grâce à des ondulations dorso-ventrales qui impriment aux extensions latérales du manteau un mouvement régulier lui permettant de se maintenir dans la colonne d’eau et d’avancer. Quand l’animal nage, les deux moitiés latérales du pied se rejoignent pour former une sorte de carène*.
La partie antérieure du manteau est déroulée quand l’animal se déplace,
L’espèce semble essentiellement nocturne. Elle se cache le jour dans les anfractuosités du milieu ou sous un débris corallien.
Les tissus des espèces du genre Hexabranchus ne contiennent pas de spicules*. Les spicules ingérés après la consommation d’éponges sont éliminés avec les fèces*.
La divergence génétique entre Hexabranchus lacer et H. sanguineus est très forte, et du point de vue anatomique il y a une différence dans l’appareil reproducteur : le canal déférent* (spermiducte*) est court et rectiligne chez H. sanguineus alors qu’il est long et spiralé chez H. lacer.
Aucune différence génétique, anatomique ou comportementale n’a été trouvée entre les trois morphes de H. lacer. Cependant, l’existence de ces différents morphes pourrait susciter des recherches ultérieures, notamment pour savoir s’ils s’inscrivent dans un processus de spéciation*. Par exemple, les auteurs de la révision ont observé plusieurs paires d’individus en train de se reproduire, et ils ont remarqué que les morphes 1 et 2 ne s’appariaient jamais et semblaient donc en situation d’isolement reproductif, ce qui est caractéristique d’une espèce à part entière.
La famille des Hexabranchidés est monogénérique, ce qui signifie qu’elle ne comprend qu’un genre (Hexabranchus). Elle diffère de toutes les familles de nudibranches doridiens par l’absence de fourreau autour des branchies des espèces qui la composent.
Danseuse espagnole : ce nom commun a été donné à Hexabranchus sanguineus, en référence aux mouvements imprimés à leur robe par les danseuses de flamenco, que les mouvements de nage de l’espèce évoquent. Le flamenco est une expression artistique originaire d’Andalousie, en Espagne. Dans la mesure où H. lacer nage de façon identique, ce nom lui convient aussi.
lacérée : traduction de l’épithète spécifique (voir l’origine du nom d’espèce).
En l’absence de nom vernaculaire* disponible, ce nom est une proposition DORIS.
Hexabranchus : ce nom est composé du mot grec [hex], qui signifie six, et du nom latin [branchia], qui désigne des branchies, les ouïes des poissons ou la gorge de l’homme.
Le genre est décrit en 1828 par le naturaliste allemand Christian Gottfried Ehrenberg (1795-1876) dans Animalia evertebrata exclusis Insectis (in Symbolae physicae, seu icones et descriptiones Mammalium, Avium, Insectorum et animalia evertebra, quae ex itinere per Africam borealem et Asiam occidentalem studio nova aut illustrata redierunt, series prima). Dans sa description (en latin), le descripteur note que les branchies sont « souvent six », ce qui justifie le choix du nom du genre.
L’espèce-type* est Hexabranchus praetextatus (actuellement H. sanguineus).
Le genre contient actuellement six espèces.
lacer : cet adjectif latin signifie « mutilé, déchiré, mis en pièces ». Il provient de la Doris lacera, premier nom de l’espèce, décrite par Cuvier en 1804 dans son Mémoire sur le genre Doris (Annales du Muséum d'Histoire Naturelle, Paris, Tome 4, pp. 453-465). Cuvier y écrit que les bords de son manteau sont « tellement découpés qu’ils semblent avoir été déchirés ». Le spécimen que Cuvier a examiné, représenté à la fin du Mémoire dans la planche 1, figure 1, présente effectivement de nombreuses échancrures, probablement exagérées, sur le bord des extensions latérales de son manteau. Cuvier n’explique pas le choix de l’épithète spécifique, mais le rapport avec les bords du manteau « déchirés » de l’animal est explicite.
L’adjectif « lacer » est masculin, son féminin est « lacera ». L’accord se faisant avec le nom de genre, le genre Doris, créé par Linné en 1758, est un nom féminin, d’où la Doris lacera de Cuvier ; Hexabranchus est masculin, d’où Hexabranchus lacer.
La localité du type* est l'île de Timor, la plus grande des petites îles de la Sonde, dans l’archipel indonésien.
Numéro d'entrée WoRMS : 1571927
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Gastropoda | Gastéropodes | Mollusques à tête bien distincte, le plus souvent pourvus d’une coquille dorsale d’une seule pièce, torsadée. La tête porte une ou deux paires de tentacules dorsaux et deux yeux situés à la base, ou à l’extrémité des tentacules. |
| Sous-classe | Heterobranchia | Hétérobranches | |
| Super ordre | Nudipleura | Nudipleures | |
| Ordre | Nudibranchia | Nudibranches | Cavité palléale et coquille absentes chez l’adulte. Lobes pédieux souvent absents aussi. Respiration cutanée, à l’aide de branchies, de cérates ou d’autres appendices. Tête portant une ou deux paires de tentacules, les tentacules postérieurs ou rhinophores peuvent parfois être rétractés dans des gaines. Principalement marins ou d’eau saumâtre. |
| Sous-ordre | Doridina | Doridiens | Corps aplati. Anus dorsal entouré complètement ou partiellement par des branchies de remplacement ramifiées qui peuvent être rétractées (voire absentes). Mangeurs d’éponges, habituellement armés de spicules calcaires internes. |
| Famille | Hexabranchidae | Hexabranchidés | Corps mou. Tentacules buccaux en larges lames aplaties. Rhinophores rétractiles et branchies contractiles. |
| Genre | Hexabranchus | ||
| Espèce | lacer |
 Gastéropodes Opisthobranches
Gastéropodes Opisthobranches

Morphe 2
Nous n’avons malheureusement pas de photos du morphe 1, nous commencerons donc par le morphe 2. L’une de ses caractéristiques réside dans la présence fréquente de larges zones jaunes sur le bord des extensions latérales enroulées le long de la bosse centrale. Une autre caractéristique est l’aspect brouillé des couleurs de cette bosse, lié au nombre des petites taches de formes et de couleurs diverses qui y sont dispersées aléatoirement.
Archipel des Bangka, Sulawesi Nord, Indonésie, océan Pacifique, 12 m
07/04/2010
 Gastéropodes Opisthobranches
Gastéropodes Opisthobranches

Morphe 3
Aux dires des descripteurs, le morphe 3 serait caractérisé par des taches blanches à jaunes plus nettes que le morphe 2, et par le fait que la bande marginale des extensions latérales du manteau peut être blanche ou rouge, ce qui n’est pas très utile pour l’identification d’après photo. Cependant, il a le grand avantage d’être le seul documenté dans l’ouest de l’océan Indien…
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
14/12/2016


Forme « sombre »
Ce que les descripteurs appellent « forme sombre » tient au fait que chez certains grands individus des trois morphes les pigments blancs sont couverts par des pigments foncés, ce qui leur donne l’apparence d’une couleur uniforme.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
05/04/2015


Forme « nuageuse »
Les descripteurs nomment « forme nuageuse » le patron de couleur de la bosse dorsale qui comporte des zones plus sombres que la couleur de fond, comme on le voit chez ce bel individu.
Nouméa, Nouvelle-Calédonie (988), océan Pacifique, 2 m
30/01/2009


Juvéniles
Nous n’avons pas de photos du juvénile du morphe 1 (se reporter à la fiche).
A) Petit juvénile (morphe 2) : les bords du manteau ne sont pas enroulés. Les rhinophores sont bicolores. On trouve de grosses taches violettes entre les lignes marginales et submarginale et sur la bosse centrale.
B) Petit juvénile (morphe 3) : les bords du manteau ne sont pas enroulés. Les rhinophores sont bicolores. On trouve des taches violettes petites et peu nombreuses entre les lignes marginales et submarginale et sur la bosse centrale.
C) Grand juvénile (morphe 3) : les bords du manteau sont enroulés. Les rhinophores sont monochromes. La bosse centrale a un patron de couleur qui annonce celui des adultes, mais elle présente encore des taches rouges à violettes qu’on retrouve aussi sur les bords du manteau.
A) Pulau Hoga, Archipel de Tukang Besi, Sulawesi Sud Est, océan Pacifique, 13 m
B) & C) Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
Lindsay WARREN
Philippe BOURJON
A) 20/10/1999 : B) 02/04/2021 ; C) 27/12/2014


Les rhinophores
Il n’y a pas de différences notables dans les rhinophores des morphes 2 et 3. Leurs massues sont roses avec des lamelles bordées de blanc et leurs hampes sont roses à points blancs, avec un fourreau de même patron dont la bague terminale est jaune mouchetée de blanc.
Dans le morphe 1 (dont nous n’avons pas d'image), la hampe est blanche à points roses.
Haut : Sulawesi Nord, Indonésie, océan Pacifique, 12 m
Bas : Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
Alain-Pierre SITTLER
Philippe BOURJON
07/04/2010 & 14/12/2016


Les branchies
Les branchies n’ont pas de fourreau commun. Leur couleur est généralement une version très claire à translucide de la couleur dominante avec des pointes souvent marquées de blanc et un rachis arborescent translucide à blanc veiné de rouge.
Le mamelon blanc placé approximativement en leur centre porte la papille anale.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
14/12/2016

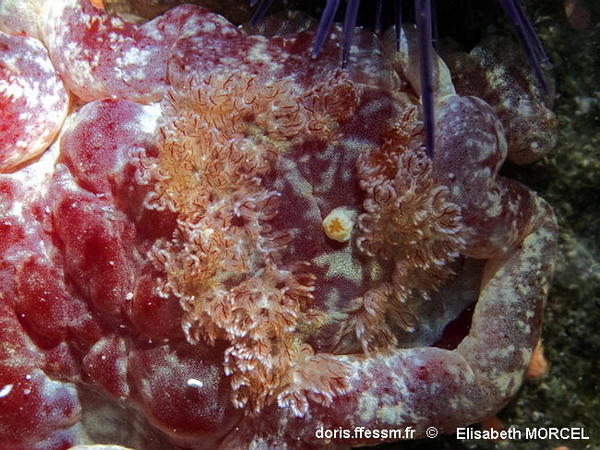
Papille anale
L’orifice de la papille anale, située au centre des panaches branchiaux, est en forme d’étoile.
Il est ici ouvert, probablement après défécation.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
18/04/2015


Tentacules oraux digités et pied
Les tentacules oraux sont de très grande taille. Ils sont digités et placés de part et d’autre de la bouche.
Le pied est puissant et arbore des couleurs identiques à celles de la face inférieure des extensions latérales du manteau, auxquelles s’ajoute un liseré blanc jaunâtre. Le dessous du pied est de couleur uniforme, avec un liseré plus large.
L’animal est ici en train de grimper sur un doigt ganté qui avait été placé devant lui.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
05/07/2021


Nage
A. Nage « normale » : l’individu évolue dans la colonne d’eau grâce à des ondulations dorso-ventrales qui impriment aux extensions latérales du manteau un mouvement régulier.
B. Nage sur le dos : en cas de nécessité, l’espèce sait aussi nager sur le dos.
C. Nage verticale : cet instantané est pris pendant la montée dans la colonne d’eau. Il permet de voir les deux moitiés latérales du pied qui se rejoignent pendant la nage pour former une sorte de carène.
A. & C. : Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
B. Sulawesi Nord, Indonésie, océan Pacifique, 8 m, de nuit
Philippe BOURJON
Alain-Pierre SITTLER
A. & C. 05/04/2015 ; B. 06/04/2010


Face dorsale très mamelonnée
Chez cet individu, les mamelons habituellement assez discrets de la bosse dorsale sont particulièrement hauts et séparés les uns des autres.
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
14/12/2016


Extensions du manteau mal enroulées
Cet individu n’a pas pris le temps d’enrouler complètement les extensions latérales de son manteau, ce qui permet d’apprécier la magnifique bande blanche qui les borde.
Archipel des Bangka, Sulawesi Nord, Indonésie, océan Pacifique, 12 m
07/04/2010


Parapodes !?
Urgence, ou un brin de fainéantise ? Cet individu a placé les extensions latérales de son manteau dans la position qui est habituellement celle des parapodes, repliés sur le dos, chez les espèces qui en disposent (par exemple : les lièvres de mer, les élysies...).
Lagon de l'Ermitage, La Réunion (974), océan Indien, 1,5 m, en PMT
05/07/2021


Partie antérieure du manteau
La partie antérieure du manteau est déroulée quand les individus se déplacent. On distingue quelques-unes des digitations des tentacules oraux, probablement au travail à la recherche d’éponges.
Sulawesi Nord, Indonésie, océan Pacifique, 9 m
06/04/2010


Signal d'alarme
Le déploiement des extensions latérales du manteau est un signal d’alarme destiné à un éventuel prédateur. Cette manœuvre donne plus du double de sa surface précédente au nudibranche, et expose soudainement des couleurs violemment contrastées. Ces couleurs sont probablement destinées à informer l’agresseur qu’il serait dangereux de manger la proie envisagée.
Archipel d'Alor, Petites îles de la Sonde, Indonésie, océan Pacifique, 9 m, de nuit
07/04/2008


Vol de jour
L'espèce étant essentiellement nocturne, il est rare de voir un individu nager en journée. Celui-ci a probablement été inquiété par une tentative de prédation dans son abri.
Mayotte (976), océan Indien, en PMT
10/11/2019


Commensalisme
La relation commensale entre la crevette nettoyeuse Zenopontonia rex et Hexabranchus sanguineus est bien documentée, mais elle ne l’était pas encore avec H. lacer. Voilà qui est fait !
Une relation commensale est profitable pour l’un des partenaires et sans inconvénient pour l'autre.
Bali, Indonésie, océan Pacifique
2011
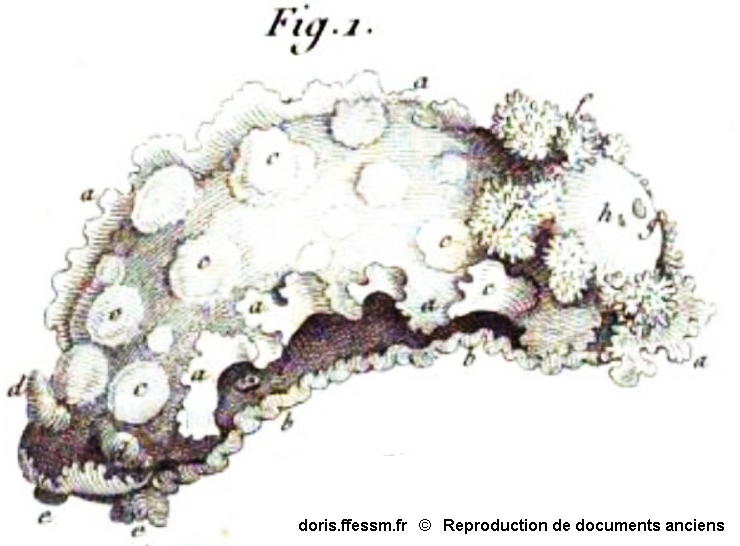
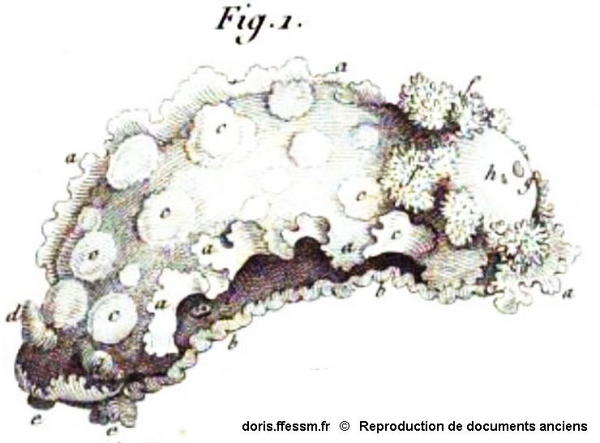
Doris lacera Cuvier, 1804
Ce dessin est de Georges Cuvier, le premier descripteur de l’espèce sous le nom de Doris lacera. Ce nom latin signifie littéralement « doris lacérée », et il est justifié par les échancrures probablement exagérées qu’on voit sur la marge des extensions latérales du manteau (signalées par des petits « a » dans le dessin).
Extrait de : Mémoire sur le genre DORIS, par G. Cuvier. In Annales du Museum d’Histoire Naturelle, par les professeurs de cet établissement, Tome quatrième, An XII (1804).
Reproduction de documents anciens
1804
Rédacteur principal : Philippe BOURJON
Vérificateur : Alain-Pierre SITTLER
Responsable régional : Alain-Pierre SITTLER
N.B. : la description de l’espèce datant de
2023, il n’y a pas, à la date de publication de cette fiche (02/2024), d’autre
référence spécifique que l’article portant révision du genre (Tibiriçá et al. 2023). En dehors de cet
article, la liste de références suivante a été élaborée à partir de
travaux sur d’autres espèces du même genre ayant à un titre ou un autre un
rapport avec le contenu de la fiche.
Francis M.P., 1980, Habitat, food and reproductive activity of the nudibranch Hexabranchus sanguineus on Tongatapu Island, The Veliger, 22(3), 252-258.
Pawlik J.R., Kernan M.R., Molinski T.F., Harper M.K., Faulkner D.J., 1988, Defensive chemicals of the Spanisch dancer nudibranch Hexabranchus sanguineus and its egg ribbons: macrolides derived from a sponge diet, Journal of experimental Marine Biology and Ecology, 119, 2, 99-109.
Shoup J.B., 1972, Notes on the Behavior of Periclimenes imperator Bruce, an Ectocommensal on the Dorid Nudibranch Hexabranchus marginatus Quoy & Gaimard (Decapoda, Palaemonidae), Crustaceana, 23, 1, 109-111.
Tibiriçá Y., Pola M., Pittman C., Gosliner T.M., Malaquias M.A., Cervera J.L., 2023, A Spanish dancer? No! A troupe of dancers: a review of the family Hexabranchidae Bergh, 1891 (Gastropoda, Heterobranchia, Nudibranchia), Organisms Diversity & Evolution, 46p.
Valdés A., 2002, How many species of Hexabranchus (Opisthobranchia : Dorididae) are there?, Molluscan Research, 22, 289-301.
----------
La page d'Hexabranchus lacer dans l'Inventaire National du Patrimoine Naturel : inexistante au 04/02/2024.
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.