Coquille fine, équivalve mais inéquilatérale (asymétrique) de 25 à 35 mm de longueur
Sommets en avant de la ligne médiane
Marge antérieure faiblement crénelée, marge postérieure lisse
Ligament court
A l’intérieur des valves, cannelures de la marge jusque sous les sommets
Coque
Olive green cockle, lagoon cockle, brackish cockle (GB), Muia arsella, cocciola gianca (I), Berberecho verde (E), Ovale Herzmuschel, Lagunen-Herzmuschel, Brackwasser-Herzmuschel (D), Brackwatermossel, brackwatercockle (NL), Stribet hjertemusling, Lamarcks hjertemusling (Danois)
Cardium glaucum Bruguière, 1789, Cardium glaucum Poiret, 1789, Cerastoderma glaucum (Poiret, 1789), Cardium elongatum Montagu, 1803, Cardium clodiense Brocchi, 1814, Cardium rhomboides Lamarck, 1819, Cerastoderma rhomboides (Lamarck, 1819), Cardium zonatum T. Brown, 1827, Cardium radula Deshayes, 1835, Cardium ovale G. B. Sowerby II, 1840, Parvicardium ovale (G. B. Sowerby II, 1840), Cardium eichwaldi Reeve, 1845, Cardium eichwaldii Reeve, 1845, Cardium fragile Reeve, 1845, Cardium (Cerastoderma) lamarckii Reeve, 1845, Cardium belticum Reeve, 1845, Cardium lamarcki Reeve, 1845, Cardium lamarckii Reeve, 1845, Cerastoderma lamarcki (Reeve, 1845), Cardium tenue Leach, 1852, Cardium umbonatum S. V. Wood, 1853, Cardium ornatum Eichwald, 1855, Cardium isthmicum Issel, 1869, Cerastoderma isthmicus (Issel, 1869), Cardium mareoticum Pallary, 1912, Cardium bengasiensis Kaltenbach, 1943, Cardium coefiensis Kaltenbach, 1943.
Et au moins 30 sous-espèces et variétés.
Atlantique Nord-Est, Manche et Méditerranée
Zones DORIS : ● Europe (côtes françaises), ○ [Méditerranée française], ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]Cerastoderma glaucum est présente dans l’Atlantique Nord-Est, de la Norvège en passant par la mer Baltique, jusqu’au Maroc et surtout en Méditerranée. Elle est également présente en mer Noire et en mer Caspienne.
Comme cette espèce a longtemps été confondue avec Cerastoderma edule, sa distribution est imparfaitement connue.
Cerastoderma glaucum (autrefois sous le nom C. lamarcki) vit enfouie, peu profondément dans les sédiments (sable grossier ou fin propre, vase sable vaseux ou vase sableuse), localement abondante, dans des zones abritées comme les lagunes (les étangs de la côte méditerranéenne française), les marais salants non soumis à la marée et la partie basse des estuaires.
Elle supporte des salinités comprises entre 15 et 40 ‰ (ou PSU, 1 PSU correspond à 1 g de sel sec par kg d'eau), parfois même entre 4 à 60 ‰. C. glaucum est plus euryhaline* que C. edule.
Elle peut également résister à de courtes périodes de températures élevées (45 °C).
Dans ces milieux extrêmes, elle remplace, C. edule.
Cerastoderma glaucum possède une coquille fine, équivalve* mais inéquilatérale* (asymétrique) de 25 à 35 mm de longueur (jusqu’à 45-50 mm). Les sommets sont en avant de la ligne médiane. Chaque valve* porte 22 à 28 côtes radiales au profil arrondi, plus anguleux dans la partie postérieure. Les espaces entre les côtes sont aussi larges que les côtes. A l’avant et au milieu, la présence de barres transversales fines et rapprochées disparaît avec l’âge.
La marge antérieure est faiblement crénelée et la marge postérieure est lisse.
Le ligament est court. La charnière de la valve droite porte deux dents cardinales* et une dent latérale antérieure et une postérieure, comme la valve gauche. La ligne palléale* est continue sans sinus*.
Les côtes, à l’intérieur de la valve, forment des cannelures qui vont de la marge jusque sous les sommets.
La coquille extérieure est blanche, jaunâtre ou verdâtre avec des zones brun foncé.
Le périostracum*, souvent persistant est brun-verdâtre.
L’intérieur des valves est blanc avec une zone brune dans la partie postérieure (voire la totalité de l’intérieur).
Les siphons*, courts, sont très proches morphologiquement de ceux de C. edule. En comparant les siphons des deux espèces, il apparaîtrait que les tentacules*, souvent de couleur beige, bordant les siphons de C. glaucum soient moins abondants et moins longs, que ceux de C. edule. Entre les tentacules on observe des petits points bruns ou rougeâtres.
Cerastoderma glaucum est très proche de C. edule. Les deux espèces ont longtemps été confondues du fait de la grande variabilité de forme, couleurs et sculptures des côtes. La forme asymétrique, la coquille fine, les sommets décalés vers l’avant, la marge postérieure lisse, le ligament plus court, et les cannelures se prolongeant jusque sous les sommets sont des caractéristiques qui permettent de distinguer C. glaucum de C. edule ).
C. glaucum est lagunaire et C. edule est estuarienne et plus typiquement marine.
Cerastoderma glaucum est un suspensivore* filtreur* opportuniste qui se nourrit de phytoplancton* et de matières organiques en suspension.
L’eau, entrée par le siphon* inhalant*, passe sur les branchies* où les particules alimentaires (et l’oxygène) sont retenues dans du mucus et est rejetée par le siphon exhalant*.
Les sexes sont séparés, il n’y a pas de différence visible entre les sexes. Les mâles sont sexuellement matures pour une longueur de coquille de 13 mm et de 14 mm pour les femelles (en général, la deuxième année). La formation des gamètes* a lieu au début du printemps et la libération des ovules* et des spermatozoïdes* libérés dans l’eau de mer se fait de mai à juillet. La fécondation* a lieu en pleine eau.
Des œufs planctoniques* éclosent des larves* trochophores* planctotrophes* qui se transformeront après environ 2 semaines en larves véligères*. Ces véligères mènent une vie planctonique* pendant 2 à 3 semaines (11 à 30 jours selon la température de l'eau) puis subissent une métamorphose* en juvéniles.
Ces juvéniles se fixent, temporairement, par des filaments de byssus*, à des algues filamenteuses (comme Chaetomorpha linum, Ruppia spiralis et plus rarement Zostera ou Potamogeton).
Quand ils mesurent quelques millimètres de long (0,5 à 10 mm), ces juvéniles rejoignent le fond et s’enfouissent dans les quelques centimètres supérieurs du sédiment.
Cette espèce vit entre 2 et 5 ans.
Les coques sont très souvent victimes de parasites* qui peuvent leur être plus ou moins néfastes. On trouve notamment des protozoaires* ciliés vivant dans l'eau de la cavité palléale.
Cependant les plus fréquents sont des petits vers appartenant à l'embranchement des Plathelminthes.
Ces petits vers ont des cycles de vie complexes. En effet, ils parasitent souvent des mollusques bivalves pour se reproduire avant de rejoindre leur hôte définitif (un autre invertébré).
Parmi les endoparasites* larvaires*, on note : Asymphylodora demeli Markowski, 1935, Bucephalus minimus (Stossich, 1887) Nicoll, Gymnophallus choledochus Odhner, 1900,Gymnophallus fossarum Bartoli, 1965, Gymnophallus rebecqui Bartoli, 1983, Himasthla elongata (Mehlis, 1831) Dietz, 1909, Himasthla quissetensis (Miller & Northup, 1926) Stunkard, 1934, Lepocreadium pegorchis (Stossich, 1901) Stossich, 1904, Monorchis parvus Looss, 1902, Paratimonia gobii Prévôt & Bartoli, 1967.
Ces parasites, comme chez C. edule altèrent le comportement fouisseur des individus parasités et donc facilitent la prédation afin d’arriver dans l’hôte définitif du cycle parasitaire.
Les coquilles vides constituent un site de choix pour les pontes de Pomatoschistus microps.
Cerastoderma glaucum existe sous deux formes, une variété typique à coquille fine que l'on trouve dans les habitats lagunaires saumâtres et une variété à coquille un peu plus épaisse que l'on trouve dans les estuaires.
Lors d’une baisse soudaine de la salinité, l’animal ferme sa coquille.
De nombreux organismes se nourrissent de coques : la crevette grise (Crangon crangon) et le gobie tacheté (Pomatoschistus microps) consomment les individus les plus jeunes, les crabes enragés (Carcinus maenas) consomment toutes les tailles. Il en est de même pour de nombreux oiseaux, comme l'huîtrier-pie (Haematopus ostralegus), le bécasseau sanderling (Calidris alba), le bécasseau maubêche (Calidris canutus), le pluvier argenté (Pluvialis squatarola), le chevalier gambette (Tringa totanus), l'eider à duvet (Somateria mollissima), le goéland cendré,(Larus canus) et la harelde boréale (Clangula hyemalis).
Cerastoderma glaucum, en raison de la grande variabilité de la forme de la coquille, possède un grand nombre de noms synonymes et de sous-espèces et variétés (au moins 56).
Autrefois, en Corse, elle était très exploitée notamment sur les berges des étangs de la côte orientale (Diana, Urbinu, ...). De nos jours, sa récolte reste très marginale de la part des pêcheurs professionnels ou amateurs. Dans beaucoup de régions, elle ne serait pas exploitée commercialement contrairement à C. edule.
Selon certains auteurs, comme Rygg (1970), C. glaucum, espèce d’eau saumâtre, aurait évolué à partir d’une population de C. edule, en Méditerranée, isolée des populations de l’Atlantique, pendant la crise de salinité messinienne (assèchement de la Méditerranée dû à la fermeture de Gibraltar de - 5,96 à - 5,33 millions d’années à la fin du Miocène).
La forme asymétrique (allongement de la partie postérieure de la coquille) serait une adaptation à la vie dans des substrats* mous (vase), alors que dans un substrat plus ferme (sable), la coquille est pratiquement symétrique comme chez C. edule.
La taille minimale de capture et de débarquement des coques sur la façade méditerranéenne est de 2,7 cm et de 3 cm sur la façade atlantique. Consultez les arrêtés des régions concernées.
Coque glauque : du latin [concha] = coquille et de la couleur du périostracum*.
Cerastoderma : selon Repetto & al (2011), ce nom de genre est composé du mot grec [cerastes] = vipère à cornes et du mot grec [derma] = peau. Le naturaliste italien Guiseppe Saverio Poli (1746-1825) a utilisé le genre Cerastes pour décrire uniquement les parties molles de l'animal qui "habite toutes les coques". L'animal lui rappelait un petit serpent à cornes au "pied très long" et aux "deux courts siphons". En 1795, Poli introduisit de nouveaux genres en accolant le nom relatif aux genres de parties molles, qu'il avait inventé auparavant, au mot derma.
glaucum : du latin [glaucum] = glauque, c’est-à-dire d’un vert tirant sur le bleu. Selon Poiret (1789), " la couleur de la coquille est glauque mouchetée de verdâtre sur toutes les parties antérieures ".
Cette espèce a été décrite, avec le même nom d’espèce, la même année, en 1789, par les naturalistes français Jean Guillaume Bruguière (1750-1798) et l’abbé Jean Louis Marie Poiret (1755-1834). De ce fait à qui attribuer cette espèce ?
La date de publication de Poiret est inconnue alors que celle de Bruguière est juin 1789. En vertu du Code de zoologie, la date de publication de Poiret est le 31 décembre. Par conséquent Bruguière en est l’auteur.
Numéro d'entrée WoRMS : 138999
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Bivalvia / Lamellibranchia / Pelecypoda | Bivalves / Lamellibranches / Pélécypodes | Mollusques aquatiques, filtreurs, au corps comprimé latéralement. Coquille composée de 2 valves articulées disposées de part et d’autre du plan de symétrie. Absence de tête, de pharynx, de radula et de glande salivaire. |
| Sous-classe | Autobranchia | Autobranches | |
| Infra-classe | Heteroconchia | Hétéroconchie | |
| Subter-classe | Euheterodonta | Euhétérodonte | |
| Super ordre | Imparidentia | Imparidenties | |
| Ordre | Cardiida | Cardiides | |
| Super-famille | Cardioidea | ||
| Famille | Cardiidae | Cardiidés | Coquille fermée en forme de cœur. Côtes radiales fortes avec parfois présence de longs tubercules. Bord des valves crénelé. |
| Sous-famille | Lymnocardinae | ||
| Tribu | Cerastodermatini | ||
| Genre | Cerastoderma | ||
| Espèce | glaucum |
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

in situ
Dans 50 à 80 cm d'eau à marée haute.
Retenue d'eau de Poulafret, Paimpol (22)
1/03/2015
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Valve droite
La coquille est asymétrique (allongée postérieurement).
Retenue d'eau de Poulafret, Paimpol (22)
03/04/2025


Vue des sommets
L'avant est en haut. Le ligament est court.
Retenue d'eau de Poulafret, paimpol (22)
03/04/2025



Dans un étang saumâtre
Les deux siphons sont en extension. Le siphon inhalant, muni de tentacules, est plus allongé.
Sur la coquille, on observe un petit gastéropode (Peringia ulvae ?) et à droite un petit isopode.
Etang de l'Estomac, Fos-sur-Mer (13), 1 m, de nuit
18/02/2023


Vue des siphons de Cerastoderma glaucum
Les deux siphons sont vus de dessus. Le siphon inhalant est à droite.
Présence de tentacules autour des deux orifices.
Forme VII, port du Havre (76)
11/11/2014


Orientation : partie postérieure en haut, valve gauche à gauche;; Les cannelures partent de la marge jusque sous les sommets.
L'arrière est en haut. Les cannelures partent de la marge jusque sous les sommets.
Retenue d'eau de Poulafret, Paimpol (22)
03/04/2025


Détail de la charnière
Orientation : partie postérieure en haut, valve gauche à gauche. Les dents cardinales et latérales sont visibles.
Retenue d'eau de Poulafret, Paimpol (22)
03/04/2025
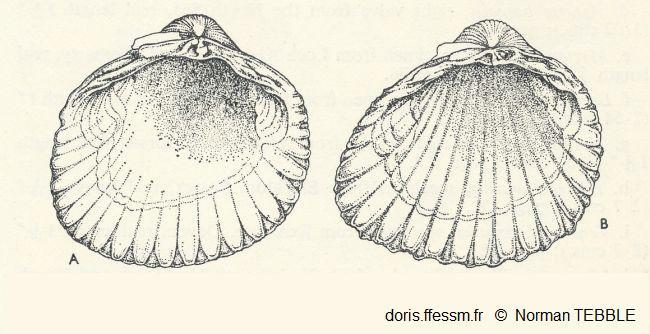
Comparaison Cerastoderma edule/C. glaucum
Vue de l'intérieur de la valve gauche de A : Cerastoderma edule, B : C. glaucum. Chez cette dernière les cannelures vont jusque sous les sommets.
Fig. 55 page 105, N. Tebble (1966)
Reproduction de documents anciens
1966
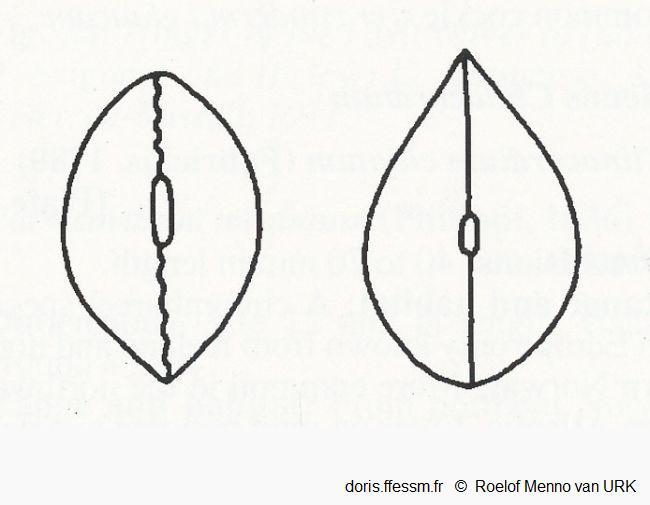
Vues dorsales de Cerastoderma edule et de C. glaucum
Schéma grossier des coquilles de Cerastoderma edule (à gauche), C. glaucum (à droite), l'extrémité postérieure est en haut des figures.
Notez la différence de longueur du ligament, la ligne (presque) droite où les valves fermées se rejoignent chez C. glaucum, et l'extrémité postérieure arrondie de C. edule. Chez cette dernière il y a une certaine variation de l'extrémité antérieure qui peut être légèrement plus aigüe que l'extrémité postérieure (comme figuré ici), les deux extrémités peuvent être arrondies ou légèrement aigües.
D'après la figure 2 page 102 de R.M. van Urk (1973)
Reproduction de documents anciens
1973


Comparaison de Cerastoderma edule et de glaucum
Les caractéristiques des deux coquilles sont présentées dans ce tableau.
D'après le tableau pp104-105 de R.M. van Urk (1973)
Reproduction de documents anciens
1973
Rédacteur principal : Yves MÜLLER
Vérificateur : Philippe LE GRANCHÉ
Responsable régional : Yves MÜLLER
Ansell A.D., Barnett, P.R.O., Bodoy, A., Masse, H., 1981, Upper temperature tolerances of some European Mollusca III. Cardium glaucum, C. tuberculata and C. edule, Marine Biology, 65, 177-183.
Barnes R.S.K., 1973, The intertidal lamellibranchs of Southampton Water, with particular reference to Cerastoderma edule and C. glaucum, Proceedings of the Malacological Society of London, 40, 413-433.
Barnes R.S.K., 1994, The brackish-water fauna of Northwestern Europe, an identification guide to brackish-water habitats, ecology and macrofauna for a field workers, naturalists and students,, Cambridge University Press, 287p.
Boyden C.R., Russel P.J.C., 1972, The distribution and habitat range of the brackish water cockle (Cardium (Cerastoderma) edule) in the British Isles, Journal of Animal Ecology, 41, 719-734.
Boyden C.R., 1971, A Comparative Study of the Reproductive Cycles of the Cockles Cerastoderma edule and C. glaucum, Journal of the Marine Biological Association of the United Kingdom, 51(3), 605-622.
Boyden C.R., 1972, Behaviour, survival and respiration of the cockles Cerastoderma edule and C. glaucum in air, Journal of the Marine Biological Association of the United Kingdom, 52, 661-680.
Brock V., 1979, Habitat selection of two congeneric bivalves, Cardium edule and C. glaucum in sympatric and allopatric populations, Marine Biology, 54, 149-156.
Brock V., Christiansen G., 1989, Evolution of Cardium (Cerastoderma) edule, C. lamarcki and C. glaucum: studies of DNA-variation, Marine Biology, 102, 505-511.
Bruguière J.G., 1789-1792, Encyclopédie méthodique ou par ordre de matières. Histoire naturelle des vers, volume1, Paris: Pancoucke. Pp. i-xviii, 1-344.
Labourg P.J., Lasserre G., 1980, Population Dynamics of Cerastoderma glaucum in an artificial lagoon of the Arcachon region, Marine Biology, 60, 147-157
Malham SK, Hutchinson TH, Longshaw M., 2012, A review of the biology of European cockles (Cerastoderma spp.), Journal of the Marine Biological Association of the United Kingdom, 92(7), 1563-1577.
Nikula R., Väinölä R. 2003, Phylogeography of Cerastoderma glaucum (Bivalvia: Cardiidae) across Europe: a major break in the Eastern Mediterranean, Marine Biology, 143, 339–350.
Nossier M.A., 1986, Ecophysiological responses of Cerastoderma edule (L.) and C. glaucum (Bruguière) to different salinity regimes and exposure to air, Journal of Molluscan Studies, 52(2), 110–119.
Rygg B., 1970, Studies on Cerastoderma edule (L.) and Cerastoderma glaucum (Poiret), Sarsia, 43, 65-80.
Urk R.M. van.,1973, Systematical Notes on Cardium edule L. and Cardium glaucum Brug. in the Netherlands, I. Basteria, 37, 95-112.
Verskuil R., 1989, De recente Europese Cardiidae, Vita Marina, 247-278.
La page de Cerastoderma glaucum dans l'Inventaire National du Patrimoine Naturel : INPN
La page de Cerastoderma glaucum sur le site de référence de DORIS pour les mollusques : MolluscaBase
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.