Souvent, seule l’ouverture circulaire (de 4,5 mm jusqu’à 40 mm de diamètre) de la coquille est visible
Coquille profondément encastrée dans un massif corallien
Opercule de chitine, circulaire, concave, brun
Si coquille visible : tube allongé dont le diamètre croît avec la longueur
Tête, pied et tentacules de couleur crème à brun pâle
En milieu récifal indopacifique, aucun autre vermétidé à ouverture aussi large ne combine encastrement corallien et opercule concave
Grand vermet, vermet géant (ce dernier est également celui de Thylacodes grandis)
Great wormsnail, great worm shell (GB), Horndeckel-Wurmschnecke (D)
Serpula maxima Sowerby, 1825
Dendropoma maximum (G. B. Sowerby I, 1825)
Siphonium maximum (G. B. Sowerby I, 1825)
Vermetus giganteus Quoy & Gaimard, 1834
Indopacifique tropical, mer Rouge
Zones DORIS : ● Indo-Pacifique, ○ [Mer Rouge]Ceraesignum maximum est largement distribué dans l'Indopacifique tropical, de l'océan Pacifique Est à la mer Rouge.
Les signalements atlantiques anciens correspondent à des confusions avec d’autres Vermetidés.
Ceraesignum maximum vit parmi des régions côtières dans la zone de balancement des marées et en dessous sur des substrats* durs (comme les récifs coralliens) avec un fort hydrodynamisme. Cette espèce est souvent solitaire mais peut être abondante dans certaines zones.
Elle est dominante dans les récifs extérieurs de la mer Rouge.
Espèce typique des zones à fort hydrodynamisme, où elle exploite efficacement la turbulence pour l’alimentation par mucus.
Souvent, seule l'ouverture circulaire (de 4,5 mm jusqu’à 36 mm de diamètre, voire 40 mm) de la coquille est visible. Celle-ci est alors profondément encastrée dans un massif corallien ou couverte d’épifaune*. L’extérieur de la coquille est rarement visible en raison de son recouvrement par le corail. Cette coquille peut dépasser une trentaine de centimètres de longueur. Toutefois on peut, parfois, observer cette coquille particulière de ce mollusque gastéropode. Elle est semblable à celle d’une annélide tubicole calcaire. C’est un tube allongé dont le diamètre croît avec la longueur. La surface extérieure est mate, blanche sur la surface columellaire*, fauve pâle sur le dos. Elle est ornée de faibles stries transversales, voire des côtes* espacées, hautes inclinées vers l’avant. Des stries spirales et trois carènes* sont présentes. On peut observer à l’intérieur de l’ouverture un anneau rose pâle diffus sur un fond blanc à crème.
La coquille est fermée par un opercule* de chitine*, circulaire, proportionnel à la taille de la coquille, en forme de soucoupe profonde et concave, brun ou transparent. Sa surface extérieure est parfois incrustée d’épifaune*. La surface intérieure est lisse et brillante, à l’exception de la zone d’attache du muscle qui porte des crêtes concentriques hautes et rapprochées. Ces dernières sont l'origine de l’aspect d’une empreinte digitale.
Quand ils sont visibles les premiers tours de spire* sont enroulés en spirale (comme chez les autres gastéropodes) puis les tours deviennent irréguliers et la coquille tend à être droite perpendiculairement à la surface extérieure du corail qui sert de substrat*.
Les tête, pied* et tentacules* sont de couleur crème à brun pâle. La surface dorsale de la tête (à l’exception des tentacules) est noir d’encre. Le mufle et les tentacules sont courts et le pied petit. La paire de tentacules pédieux est située entre le mufle et le pied.
Il existe plusieurs espèces de vermets (environ 140), mais seulement quelques espèces tropicales atteignent un grand diamètre d’ouverture de la coquille.
Toutefois la distinction ne devrait pas poser de difficultés :
Les vermets, gastéropodes sessiles* tubicoles* sont souvent confondus avec des annélides polychètes vivant dans un tube calcaire comme ceux de la famille des Serpulidés. Seules les espèces vivant en milieu corallien nous intéressent ici.
Ceraesignum maximum est un suspensivore* original. Il sécrète un filet de mucus produit par la glande pédieuse*. Ce filet sort par l’interstice entre le rebord de la coquille et le bord de l’opercule*. Ce filet est appliqué au substrat* et sa forme est maintenue, même dans les zones turbulentes, par de fins fils produits probablement par les tentacules* pédieux.
Ce filet de mucus peut mesurer jusqu’à 8 cm de diamètre, mais par l’agitation des vagues il peut être plus allongé. Il est produit en permanence et reste étalé pendant 20 à 40 minutes. L’animal, en deux minutes, ingère le filet.
Le filet de mucus retient du plancton*, des détritus et de petits organismes benthiques*.
Les particules de plus de 2 mm, comme les fragments de coquilles ou les morceaux d'algues, ne sont pas ingérées mais s'accumulent derrière le bord supérieur de l'opercule jusqu'à ce qu'elles soient détachées par les mouvements de l'eau.
Il arrive, par les mouvements de l’eau, que des morceaux d'algues s’accrochent au filet et l'arrachent du substrat.
Les filets de plusieurs individus proches peuvent s’emmêler.
La turbulence de l’eau semble nécessaire pour stimuler la sécrétion de mucus.
Le vermet produit, à peu près toutes les 20 minutes, des boulettes fécales, par lots, ovoïdes ou en forme de cigare. Ces dernières sont consommées par des détritivores*.
Comme la plupart des mollusques gastéropodes, le vermet possède une radula* incolore à brune.
Les sexes sont séparés (on parle de gonochorisme*) chez Ceraesignum maximum (comme chez la plupart des gastéropodes non hétérobranches). Il n’y a pas de dimorphisme* sexuel. Bien que classée comme gonochorique, la variation du sex-ratio* avec la taille suggère un hermaphrodisme* protandrique* possible. Plus la taille du corps augmente plus on compte de femelles. Le mâle ne possède pas de pénis.
Les femelles pondent 1 à 58 capsules ovigères* ovoïdes, transparentes, pédonculées* d’environ 4 à 6 mm de longueur et de 1,5 mm de largeur contenant chacune 73 à 571 œufs. Ces capsules sont accrochées par leur pédoncule* à la paroi interne de la coquille dans la cavité palléale*. Les embryons présents sont à différents stades de développement.
Les larves* véligères* planctotrophes* éclosent et nagent activement pendant plusieurs semaines dans le plancton* avant de se métamorphoser* en réponse à des signaux provenant d’algues coralliennes et de rejoindre, alors, un fond qui leur convient.
Les vermets juvéniles sont mobiles et portent des coquilles enroulées en spirale (dans un plan comme chez les planorbes).
La longue phase larvaire explique la large distribution géographique de l’espèce.
Cette espèce est souvent solitaire mais peut être abondante dans certaines zones : 22 individus par m² en mer Rouge et jusqu’à 520 par m² à Guam.
Ceraesignum maximum est souvent associé à diverses espèces de coraux.
Ces associations peuvent être considérées comme compétitives, puisque les coraux et les gastéropodes se chevauchent dans leur utilisation des ressources. Les deux organismes dépendent des mouvements de l'eau pour l'apport de nourriture, les échanges gazeux et la reproduction, et sont donc en concurrence pour le substrat* sur lequel ils se développent.
Les polypes des scléractiniaires comme Stylophora pistillata, Pocillopora damicornis , Pocillopora verrucosa , Acropora spp. et l'hydrozoaire Millepora dichotoma peuvent être recouverts en partie par le filet de mucus. Ce qui entraîne des anomalies morphologiques au niveau des polypes* (une petite taille et une forme lisse et aplatie).
Le filet de mucus qui recouvre le corail est parfois si épais et si dense que des bulles de gaz sont piégées sous le filet.
A Moorea (Polynésie française) Ceraesignum maximum colonise par exemple le scléractiniaire Porites lobata en même temps que d’autres organismes comme Lithophaga laevigata (un bivalve foreur) et Spirobranchus giganteus.
Les coquilles vides sont souvent occupées par des blennies
Ceraesignum maximum est incapable de sortir de sa coquille.
La croissance linéaire de la coquille est assez rapide et ainsi permet au vermet d'échapper à la prolifération des coraux et donc de conserver un accès à la nourriture.
Ceraesignum maximum semble apprécier des zones dénudées pour s'installer avec succès sur les récifs,
Dans le lagon, peu profond de Moorea (Polynésie française) deux espèces de gastéropodes muricidés Mancinella armigera et Menathais tuberosa ont été observés se nourrissant de Ceraesignum maximum. Des masses de capsules ovigères de muricidés ont même été déposées dans des coquilles de vermetidés.
Le muscle columellaire* très puissant permet à l'animal de se rétracter au fond de son tube.
Les coquilles vides constituent des micro-habitats durables pour la faune récifale.
En fortes densités, leurs coquilles volumineuses peuvent participer de manière significative à l'accrétion des roches récifales sur le platier extérieur. L'accrétion calcaire qu'ils produisent fabrique parfois de larges dalles, appelées " trottoirs à vermets". Ces formations sont utilisées comme indicateurs paléo-environnementaux.
Les coquilles fossiles de C. maximum dans des falaises émergées suggèrent qu'elles constituent un élément important de l'estran* récifal depuis au moins 70 000 ans.
Ceraesignum maximum est une source alimentaire traditionnelle en Polynésie.
Le bord de l'ouverture est souvent tranchant et peut occasionner des coupures.
Comme les filets de mucus déployés ont des effets néfastes notables sur les coraux et que de nombreux poissons mangeurs de mollusques, de mucus ou de plancton* évitent les filets de mucus chargés de plancton, des tests (Klöppel & al., 2013) ont montré qu'il existe aux moins deux composés actifs produits par ces vermets.
Grand vermet tropical : Ceraesignum maximum est la plus grande espèce de vermet (avec un opercule*) dans sa vaste aire de répartition indopacifique.
Ceraesignum : du latin [cera] = cire et [signum] = signe, pour la texture de la surface intérieure de l'opercule* qui ressemble à l'empreinte d'un doigt dans la cire. Ce nom de genre est neutre en latin. Il a été donné par Rosemary E. Golding, Rüdiger Bieler, Timothy A. Rawlings & Timothy M. Collins en 2014.
maximum : du latin [maximum] = très grand.
Dendropoma : l'ancien nom de genre très utilisé, du grec [dendron] = arbre (soit ramifié) pour la face inférieure de l'opercule et du grec [poma] = couvercle, opercule.
Numéro d'entrée WoRMS : 766307
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Gastropoda | Gastéropodes | Mollusques à tête bien distincte, le plus souvent pourvus d’une coquille dorsale d’une seule pièce, torsadée. La tête porte une ou deux paires de tentacules dorsaux et deux yeux situés à la base, ou à l’extrémité des tentacules. |
| Sous-classe | Caenogastropoda | Caenogastropodes | |
| Ordre | Littorinimorpha | Littorinimorphes | |
| Super-famille | Vermetoidea | Vermetoides | |
| Famille | Vermetidae | Vermétidés | Coquille fixée à un substrat (roche, coraux, mollusques) tubulaire à enroulement lâche et irrégulier commençant ppar un premier tour spiralé, une ouverture ronde souvent pourvue d'une fente, une couche interne brillante, un opercule corné, de taille réduite ou absent. Ils vivent souvent en colonies. D'après Lindner 2011:80. |
| Genre | Ceraesignum | ||
| Espèce | maximum |
 Gastéropodes à coquille unique : escargots subaquatiques et assimilés (ex. Prosobranches et Hétérobranches/Pulmonés)
Gastéropodes à coquille unique : escargots subaquatiques et assimilés (ex. Prosobranches et Hétérobranches/Pulmonés)

Mucus, fèces, tube et opercule
L'opercule* concave et l'extrémité du tube sont les seules parties visibles.
Passe en S, Mayotte (976).
14/04/2008
 Gastéropodes à coquille unique : escargots subaquatiques et assimilés (ex. Prosobranches et Hétérobranches/Pulmonés)
Gastéropodes à coquille unique : escargots subaquatiques et assimilés (ex. Prosobranches et Hétérobranches/Pulmonés)


Un spécimen non encastré
La coquille en forme de tube et encroûtée par différents organismes est visible.
El Quseir, Egypte
11/2006


Filet de mucus
L'opercule* est légèrement soulevé en haut à droite et permet au filet de mucus de sortir.
Passe en S, Mayotte (976).
12/04/2008


Trois individus
Chaque tube affleure juste à la surface du corail.
Passe en S, Mayotte (976).
11/04/2008


Deux individus
Ils sont rétractés dans leur tube.
Moalboal, île de Cebu, Philippines, 10 m
11/02/2008



Corail très colonisé
Un exemple de forte densité.
Île de Bunaken, Sulawesi du Nord, Indonésie, 10 m
26/11/2012
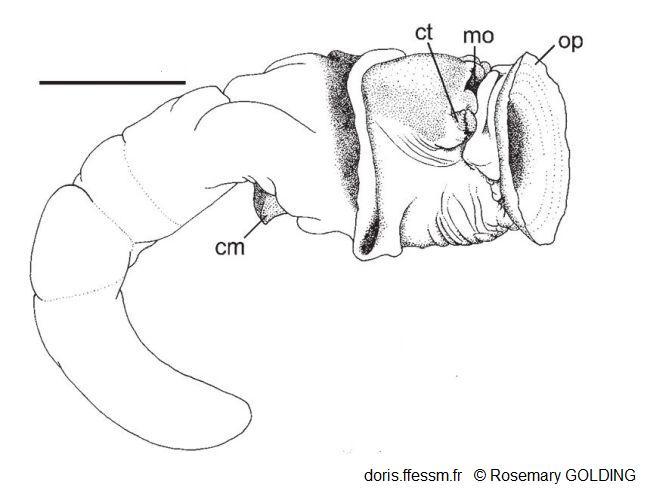
Corps d'un petit spécimen hors de son tube
Probablement mâle.
cm = muscle columellaire
ct = tentacule céphalique
mo = bouche
op = opercule
La barre mesure 5 mm
Dessin N°262 p.67, Guam, R. Golding, 2014
Reproduction de documents anciens
2014
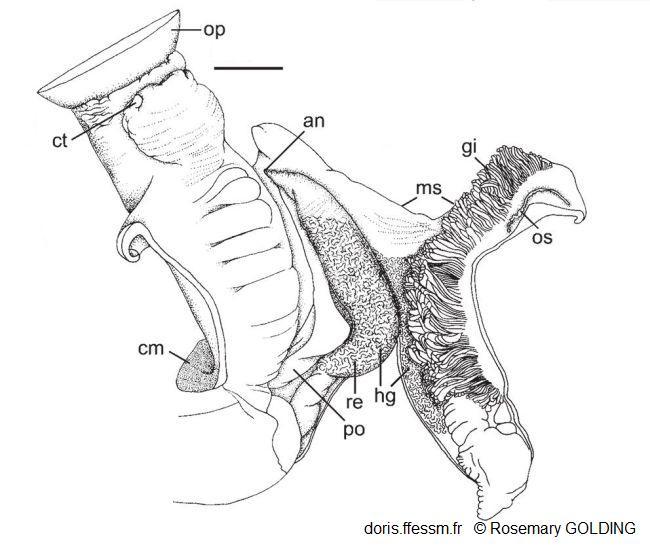
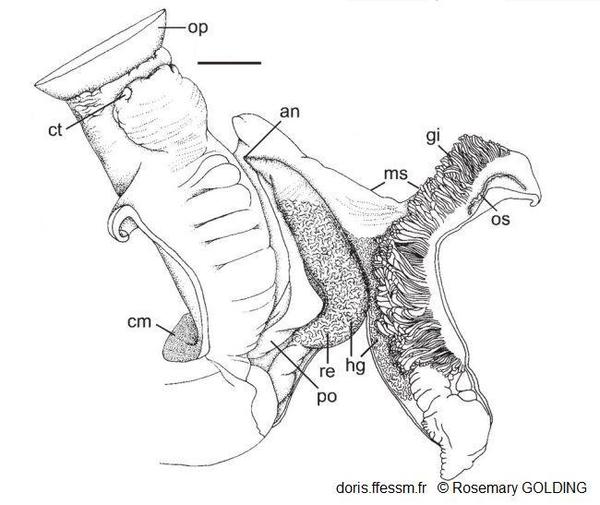
Corps antérieur et cavité palléale d'une femelle
an = anus
cm = muscle columellaire
ct = tentacule céphalique
gi = branchie
hg = glande hypobranchiale
ms = fente du manteau
op = opercule
po = oviducte palléal
re = rectum
La barre mesure 20 mm
Dessin N°263 p. 67, Herald Cay, Mer de Corail, côte nord-est de l'Australie, Rosemary Golding, 2014
Reproduction de documents anciens
2014
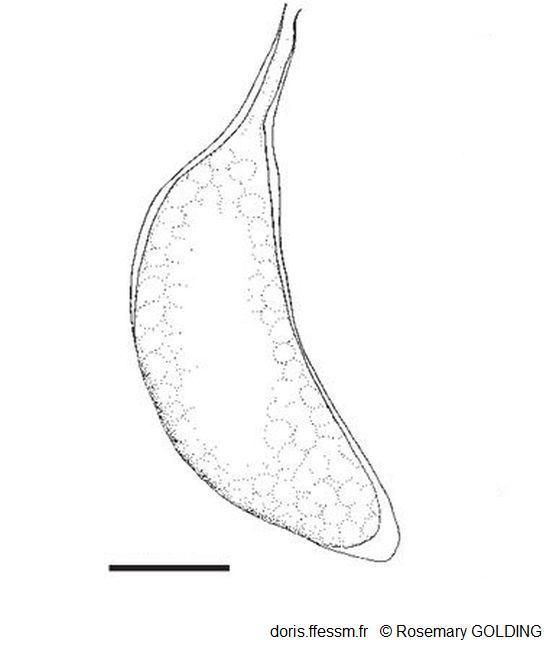
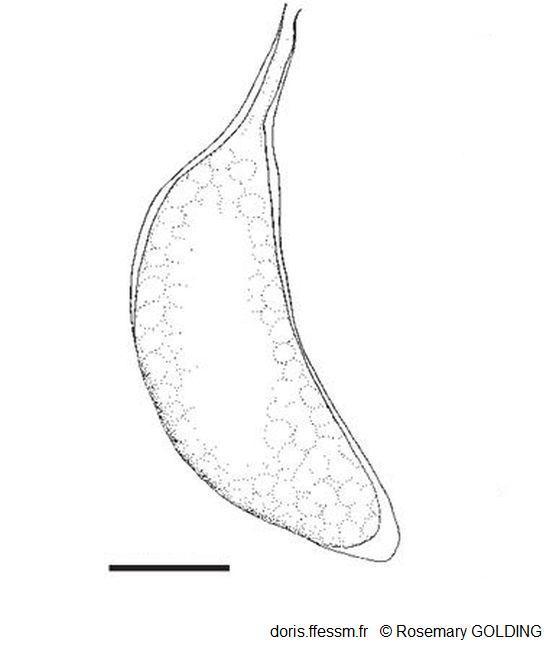
Une capsule ovigère
Cette capsule ovigère pédonculée* contenait des embryons à un stade de développement précoce.
La barre mesure 1 mm
Dessin N°266 p. 67, Rosemary Golding, 2014
Reproduction de documents anciens
2014
Rédacteur principal : Yves MÜLLER
Vérificateur : Philippe LE GRANCHÉ
Responsable régional : Yves MÜLLER
Brown A.L., Zill J., Frazer T.K., Osenberg C.W., 2014, Death and life: Muricid snails consume the vermetid gastropod, Dendropoma maximum, and use empty shells for reproduction, Reef Site Coral reefs, 33, 497.
Brown A.L., Frazer T.K., Shima J.S., Osenberg C.W., 2016, Mass mortality of the vermetid gastropod Ceraesignum maximum, Coral Reefs 35, 1027–1032.
Gagern A., Schürg T., Michels NK., Schulte G., Sprenger D., Anthes N., 2008, Behavioural response to interference competition in a sessile suspension feeder, Marine Ecology Progress Series, 353,131–135.
Golding R. E., Bieler R., Rawlings T. A., Collins T. M., 2014, Deconstructing Dendropoma: a systematic revision of a world-wide worm-snail group with descriptions of new genera (Caenogastropoda: Vermetidae), Malacologia, 57(1), 1-97.
Hadfield M.G., Kay E.A, Gillette M.U., Loyd M.C., 1972, The Vermetidae (Mollusca: Gastropoda) of the Hawaiian Islands, Marine BioIogy, 12, 81-98.
Hughes RN., Lewis AH., 1974, On the spatial distribution, feeding, and reproduction of the vermetid gastropod Dendropoma maximum, Journal of Zoology, 172, 531–547.
Kappner I., Al-Moghrabi S.M., Richter C., 2000, Mucus-net feeding by the vermetid gastropod Dendropoma maxima in coral reefs, Marine Ecology Progress Series, 204, 309–313.
Klöppel A., Brümmer F., Schwabe D., Morlock G.,
2013, Detection of bioactive compounds in the mucus nets of Dend
ropoma maxima, Sowerby 1825 (Prosobranch Gastropod Vermetidae, Mollusca), Journal
of Marine Biology, 2013,283506, 9p.
Mörch O. A. L. 1861, Review of the Vermetidae pt. I. Proceedings of the Zoological Society of London for 1861, 145-181.
Morton J.E., 1965, Form and function in the evolution of the Vermetidae, Bulletin of the British Museum (Natural History), Zoology, 11(9), 585–630.
Philipps N.E., Shima J.S., 2010, Reproduction of the vermetid gastropod Dendropoma maximum (Sowerby, 1825) in Moorea, french Polynesia, Journal of Molluscan Studies, 75(2), 133-137.
Philipps N.E., 2011, Where are larvae of the vermetid gastropod Dendropoma maximum on the continuum of larval nutritional strategies? Marine Biology, 158(10), 2335-2342.
Philipps N.E., Shima J.S., Osenberg C.W., 2014, Live coral cover may provide resilience to damage from the vermetid gastropod Dendropoma maximum by preventing larval settlement, Coral reefs,33, 1137-1144.
Quoy J. R. C., Gaimard J. P., 1832-1835, Voyage de la corvette l'Astrolabe: exécuté par ordre du roi, pendant les années 1826-1827-1828-1829, sous le commandement de M. J. Dumont d'Urville. Zoologie. 1: i-l, 1-264; 2(1): 1-321 [1832]; 2(2): 321-686 [1833]; 3(1): 1-366 [1834]; 3(2): 367-954 [1835]; 4 [1833]; Atlas (Mollusques): pls 1-93 [1833] ...etc. In: Dumont d'Urville, J.; 1834, Voyage de Découvertes de l'Astrolabe. Paris, J. Tastu, Éditeur-Imprimeur., 294-296.
Scaps P., Denis V., 2008, Can organisms associated with live scleractinian corals be used as indicators of coral reef status? Atoll Research Bulletin, 566, 1–18.
Shima J.S., Osenberg C.W., Stier A.C., 2010, The vermetid gastropod Dendropoma maximum reduces coral growth and survival, Biology Letters, 6(6), 815–818.
Shima J.S., McNaughtan D., Strong A., 2015, Vermetid gastropods mediate within-colony variation in coral growth to reduce rugosity, Marine Biology, 162, 1523-1530.
Shima J.S., Phillips N.E., Osenberg C.W., 2016, Variation in the growth and survival of the tropical vermetid gastropod Ceraesignum maximum is driven by size, habitat, and density, Marine Biology, 163, 84.
Shima JS., Phillips NE., Osenberg CW., 2013, Consistent deleterious effects of vermetid gastropods on coral performance, Journal of Experimental Marine Biolohgy and Ecolology, 439,1–6.
Shima JS., McNaughtan D., Strong AT., 2015, Vermetid gastropods mediate within-colony variation in coral growth to induce a flat tened colony morphology, Marine Biology, 162, 1523–1530.
Smalley T.L.,1984, Possible effects of intraspecific competition on the population structure of a solitary vermetid mollusc, Marine Ecology Progress Serie, 14,139–144.
Sowerby I, G. B., 1825, A catalogue of the shells contained in the collection of the late Earl of Tankerville: arranged according to the Lamarckian conchological system: together with an appendix, containing descriptions of many new species- London, vii + 92 + xxxiv pp.
Yonge CM., 1932, Notes on feeding and digestion in Pterocera and Vermetus, with a discussion on the occurrence of the crystalline style in the Gastropoda, Scientific Reports/ Great Barrier Reef Expedition (British Museum (Natural History) 1(10), 259-281.
Yonge CM., Iles E. J., 1939, On the mantle cavity, pedal gland and evolution of mucous feeding in the Vermetidae. Annals and Magazine of Natural History, Series 11, 3,17, 536-556.
Zvuloni A., Armoza-Zvuloni R., Loya Y., 2008, Structural deformation of branching corals associated with the vermetid gastropod Dendropoma maxima, Marine Ecology Progress Serie, 363,103–108.
La page de Ceraesignum maximum dans l'Inventaire National du Patrimoine Naturel :INPN
La page de Ceraesignum maximum dans MolluscaBase
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.