Zoïdes cylindriques de petite taille (<1cm)
Zoïdes plus ou moins transparents
En petits bouquets lâches ou en grosses touffes denses
8 tentacules par zoïde
Stolon reliant les zoïdes
Stolon de diamètre plus étroit que les zoïdes
Creeping bryozoan (GB)
Bowerbankia gracilis Leidy, 1855
Bowerbankia caudata (Hinchs, 1877)
Cosmopolite des mers tempérées
Zones DORIS : ● Europe (côtes françaises)Amathia gracilis est présente dans l'ensemble de l’Atlantique, dans le Pacifique Nord-Est (côtes d'Amérique du Nord), sur les côtes du Chili, en Nouvelle-Zélande et en Australie. Elle est également présente en Méditerranée (Grèce et Égypte).
Compte tenu de l’existence probable d’un complexe d’espèces, la distribution exacte de Amathia gracilis au sens strict reste à préciser.
Cette espèce se rencontre par petits fonds. Elle est très tolérante aux variations de salinité (on peut donc la trouver dans les mares intertidales*) et également eurytherme*. Cette tolérance écologique explique sa fréquente présence dans les zones portuaires et les milieux perturbés.
Amathia gracilis est connue pour être une « salissure » (ou fouling*) marine dans les zones portuaires. Les colonies se fixent sur de nombreux supports (coquillage, pierres, algues, etc.).
Amathia gracilis forme des colonies discrètes de zoïdes* cylindriques, de moins d’un centimètre de haut en extension, plus ou moins transparents, de couleur brun clair, reliés entre eux par un stolon* se divisant de manière irrégulière. Le diamètre des zoïdes est compris entre 0,07 mm et 0,13 mm. Le diamètre du stolon est nettement inférieur à celui des zoïdes. Ceux-ci peuvent être solitaires ou regroupés par 2 ou 3 le long du stolon.
Des colonies en touffes denses peuvent aussi exister (A.cf gracilis sp.1 de Hans de Blauwe, 2025).
Le lophophore* comporte 8 tentacules.
Certains zoïdes possèdent une sorte de « queue » du côté proximal* (qui avait conduit à désigner sous le nom de Bowerbankia caudata les individus présentant cette particularité).
Les embryons, présents notamment en fin d’été, sont roses ou jaunes et visibles par transparence.
En raison des différences génétiques entre les populations d’Europe et d’Amérique, et des différences morphologiques entre les embryons roses et jaunes, Amathia gracilis est aujourd’hui considérée comme un complexe d’espèces. Une révision taxonomique est nécessaire.
Amathia gracilis peut être confondue avec d’autres espèces du genre Amathia ou Bowerbankia.
La distinction entre ces espèces repose sur la forme et la disposition des zoïdes*, sur le diamètre relatif du stolon* et sur le nombre de tentacules* du lophophore*.
Victorella pavida vit en eau saumâtre, elle forme un gazon lâche sans véritable bouquet, les zoïdes sont disposés en chaîne le long des stolons, le lophophore porte 8 tentacules.
Valkeria uva forme de très petites touffes de quelques zoïdes, le stolon est ramifié de façon lâche, le lophophore porte 8 tentacules.
Comme chez tous les bryozoaires, la nutrition est assurée par la capture de particules alimentaires, notamment du phytoplancton*, par les tentacules* du lophophore*. La sortie du lophophore est assurée par une augmentation de la pression du liquide interne, phénomène obtenu grâce à la compression musculaire.
Une fois la gaine du lophophore dévaginée, un mouvement pendulaire et circulaire des tentacules ciliés* composant le panache de ce lophophore va permettre le brassage de l'eau environnante et favoriser ainsi la capture des micro-organismes composant le régime alimentaire de la colonie.
Ce sont dits filtreurs* actifs c'est-à-dire des filtreurs suspensivores* et microphages*. Les diatomées* (algues unicellulaires) et les bactéries sont la base de l'alimentation de ce type de bryozoaire.
La croissance de la colonie se fait par bourgeonnement* périphérique de nouvelles zoécies* (= zoïdes* ; kénozoïdes* = stolons* et autozoïdes*).
La reproduction est sexuée et la colonie est hermaphrodite* protandre*. Les colonies fonctionnent d’abord comme mâles avant de produire des zoïdes femelles. Il n’y a pas de synchronisation de la reproduction au sein d’une même colonie, où l’on pourra donc trouver à la fois des zoïdes mâles et femelles.
Les œufs produits par un zoïde sont incubés dans le fourreau tentaculaire après dégénérescence du lophophore*. Cette dégénérescence s’accompagne d’une modification du cœlome*, avec apparition d’un nouvel organe, la gouttière ciliée, destinée à favoriser l’ovulation et l’oviposition. Chaque zoïde n’incube qu’un œuf à la fois. Après fécondation, la larve* se développe dans le zoïde pendant quelques jours (13 à 14 jours à 12,5 °C), puis il y a émission de la larve en forme de tonneau, ciliée et lécithotrophique*, qui va être dispersée par les courants.
L’émission de la larve est induite par la lumière (en laboratoire, on arrive facilement à provoquer l’émission des larves arrivées à maturité en maintenant les colonies dans le noir pendant une douzaine d’heures puis en les exposant à la lumière). Un autre œuf viendra alors, presque immédiatement, prendre la place de la larve émise. Les larves sont phototactiques, bien qu’elles soient dépourvues d’yeux. Après une courte vie (quelques heures) dans la colonne d'eau, la larve va se fixer sur un substrat* adéquat et se métamorphoser* en un zoïde primaire ou ancestrule*. Celui-ci bourgeonnera deux à trois zoïdes, qui bourgeonneront eux-mêmes en émettant de longues digitations creuses, les stolons, à partir d'un kénozoïde* souche.
La production de larves favorise ainsi la dispersion de l’espèce et le peuplement de nouveaux substrats*.
La période de reproduction sexuée s’étend de fin avril à octobre, avec un pic d’émission des larves en mai-juin, puis en septembre-octobre.
Le genre Bowerbankia, auquel était précédemment rattachée Amathia gracilis a été récemment (Waeschenbach & al., 2015) considéré comme un synonyme de Amathia.
Il est probable que Amathia gracilis recouvre en réalité un complexe d’espèces, les individus aux embryons jaunes étant une espèce différente des individus aux embryons roses, qui présentent certaines caractéristiques morphologiques différentes.
Cette situation est typique de nombreux bryozoaires ctenostomes à morphologie simple.
Des expérimentations conduites sur des plaquettes test dans différents ports égyptiens ont montré que Amathia gracilis n’est pas une espèce pionnière, mais apparaît sur des plaquettes immergées, selon les ports, entre 8 et 12 mois, au milieu de nombreuses autres espèces.
Amathie gracile : le nom français proposé est une transcription en français du nom scientifique.
Amathia : ce nom de genre provient du nom d'une des Néréides (nymphes marines, filles de Nérée et de Doris) selon Homère et dans sa version anglo-saxonne, parfois écrit Amatheia (en français : Amathée). Ce nom de genre a été créé en 1812 par le naturaliste français Jean-Victor Felix Lamouroux (1776-1825).
gracilis : cette épithète spécifique a été attribuée en 1855, par Joseph Leidy (1823-1891), paléontologiste et naturaliste américain. Ce nom provient du latin [gracilis] = grêle, effilé, mince, gracile, probablement en lien avec l’allure des zoïdes.
Numéro d'entrée WoRMS : 851589
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Bryozoa / Ectoprocta | Bryozoaires / Ectoproctes | Petits animaux coloniaux filtreurs aquatiques fixés à un substrat. Tous les zoïdes sont en continuité physique et issus de bourgeonnement à partir d’un individu unique. Chaque zoïde porte un lophophore rétractile et est abrité dans une logette. |
| Classe | Gymnolaemata | Gymnolèmes | Colonies polymorphes. Les zoïdes sont cylindriques ou aplatis, les lophophores circulaires. Les parois peuvent être calcifiées ou non. Presque tous marins. |
| Famille | Vesiculariidae | Vésiculariidés | Colonies érigées, en touffes ou rampantes. Zoïdes* cylindriques à ovales allongés et bourgeonnant en groupes ou en lignes le long d'un stolon irrégulièrement ramifié. |
| Genre | Amathia | ||
| Espèce | gracilis |
 Bryozoaires, Brachiopodes et Phoronidiens
Bryozoaires, Brachiopodes et Phoronidiens

Vue générale d'une colonie, avec deux lophophores
Les zoécies* d' Amathia gracilis sont reliées par un stolon*
et se présentent sous la forme d'un tube dressé transparent. Les lophophores*
ont 8 tentacules.
Plage de l'avant-port, Binic-Etables-sur-mer (22), prélèvement dans une mare sur l'estran.
Observation au laboratoire à la loupe binoculaire.
20/08/2025
 Bryozoaires, Brachiopodes et Phoronidiens
Bryozoaires, Brachiopodes et Phoronidiens

Vue détaillée d'une zoécie
Outre le lophophore* en extension au premier plan, on peut
observer, à l'arrière-plan, la forme particulière de la zoécie* lorsque le
lophophore est rétracté.
La colonie est fixée sur une algue coralline, qui donne l'échelle.
Plage de l'avant-port, Binic-Etables-sur-mer (22),
prélèvement dans une mare sur l'estran.
Observation au laboratoire à la loupe binoculaire.
20/08/2025


Vue détaillée d'un lophophore
On voit nettement les 8 tentacules* du lophophore*. La colonie est fixée sur une algue coralline, qui donne l'échelle.
On aperçoit à gauche un fragment de stolon, de diamètre nettement inférieur à celui des zoécies.
Plage de l'avant-port, Binic-Etables-sur-mer (22), prélèvement dans une mare sur l'estran.
Observation au laboratoire à la loupe binoculaire.
20/08/2025


Variante en amas serré
Lophophores rétractés, présence d'embryons roses (Amathia cf. gracilis sp.1 suivant Hans De Blauwe, 2025).
Estuaire de la Rance, Saint-Suliac (35)
07/08/2020


Lophophores délicats à 8 tentacules
Estuaire de la Rance, Saint-Suliac (35)
07/08/2020


En petit amas le long d'un fin stolon
On note la présence d'embryons jaunes (Amathia cf. gracilis sp.2
suivant Hans De Blauwe, 2025).
Port de Bouguezen, Ouessant (29)
15/07/2022
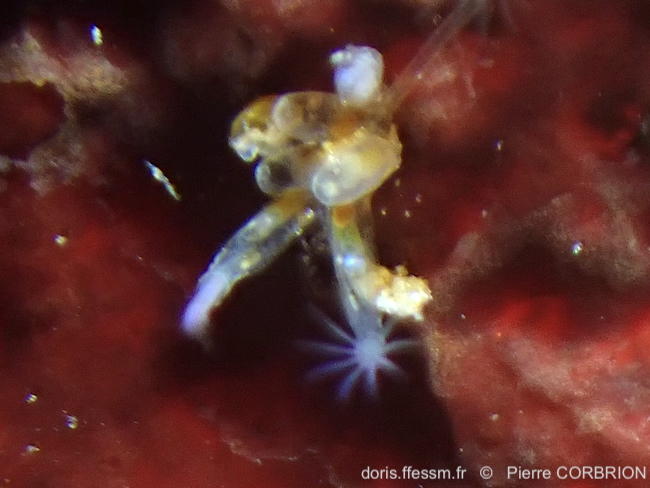
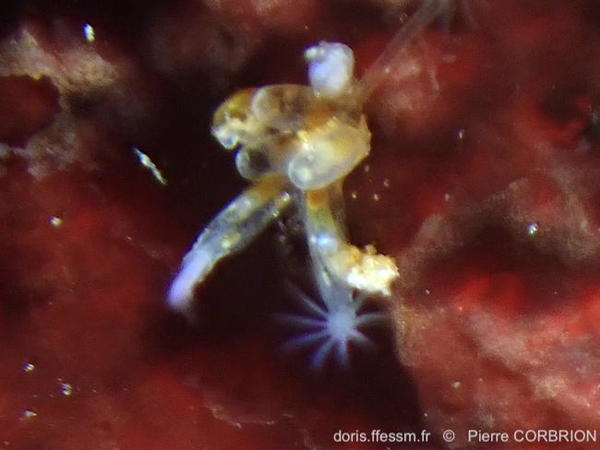
Détail d'un petit bouquet
Le fin stolon est visible en haut à droite.
Port de Bouguezen, Ouessant (29)
15/07/2022
Rédacteur principal : Christophe QUINTIN
Vérificateur : Frédéric ANDRÉ
Responsable régional : Yves MÜLLER
Abdel-Salam Kh., Ramadan Sh., 2008, Fouling Bryozoa from some Alexandria harbours, EGYPT (I) Erect species, Mediterranean Marine Science, 9/1, 31-47.
Kasaei S.M., Nasrolahi A, Abtahi B, Taylor P.D., 2017, Bryozoa of the southern Caspian Sea, Iranian coast, Check List, 13(4), 305–313.
Lamouroux J. V. F., 1812, Extrait d'un mémoire sur la classification des Polypiers coralligènes non entièrement pierreux, Nouveau Bulletin scientifique de la Société Philosophique, 3, 181-188.
Leidy J., 1855, Contributions towards a knowledge of the marine Invertebrate fauna of the coasts of Rhode Island and New Jersey, Journal of the Academy of Natural Sciences of Philadelphia, 3(2) 11, 135-152, pls. 10-11. (xii-1855).
Osburn R., 1912, The bryozoa of the Woods Hole region, Governmental Printing Office, Washington, Document n°760,253-254.
Reed G., Cloney R., 1982, The larval morphology of the marine bryozoan Bowerbankia gracilis (Ctenostoma : Vesicularioidea), Zoomorphology, 100, 23-54.
Reed G., Cloney R., 1982b, The settlement and metamorphosis of the marine bryozoan Bowerbankia gracilis (Ctenostoma : Vesicularioidea), Zoomorphology, 101, 103-132.
Reed G., Cloney R., 1982b, The larval morphology of the marine bryozoan Bowerbankia gracilis, (Ctenostoma : Vesicularioidea), Zoomorphology, 100, 23-54
Reed C., 1988, The reproductive biology of the gymnolaemate bryozoan Bowerbankia gracilis (Ctenostomata: Vesiculariidae), Ophelia, 29(1), 1-23.
Waeschenbach A., Vieira L. M., Reverter Gil O., Souto Derungs J., Nascimento K. B., Fehlauer Ale K. H., 2015, A phylogeny of Vesiculariidae (Bryozoa, Ctenostomata) supports synonymization of three genera and reveals possible cryptic diversity, Zoologica Scripta, 44(6), 667-683.
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.