Corps fusiforme à l'extrémité postérieure étirée
en pointe effilée semblable à une "queue" étroite
Manteau long (en moyenne 12 cm) et étroit
Tête entourée de 8 bras avec 2 rangées de ventouses
2 tentacules rétractiles aux massues larges avec de grosses ventouses au milieu
Nageoires postérieures en forme de losange allongé, situées dans la moitié postérieure du
corps
Manteau gris pâle avec de nombreuses taches brunes ou violacées
Little squid, european
common squid (GB), Calamaretto puntuto (I,) Calamarin picudo (E), Gepfriemter Zwerglamar (D), Kleine pijlinkvis,
dwergpijlinkvis (NL), Dvægblæksprutte (DK)
Loligo media (Linnaeus, 1758)
Loligo subulata Lamarck, 1798
Alloteuthis subulatus (Lamarck, 1798)
Sepia subulata Bosc, 1802
Loligo spiralis de Férussac, 1823
Atlantique Nord-Est et Méditerranée
Zones DORIS : ● Europe (côtes françaises), ○ [Méditerranée française], ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]Alloteuthis subulata est présent dans l’Atlantique Est, dans l'ouest de la Baltique, en mer du Nord et mer Celtique jusqu'à la côte ouest de l'Irlande et jusqu'au Sahara occidental et dans toute la Méditerranée sauf dans la partie la plus orientale.
Le casseron commun vit dans les eaux du plateau continental, en particulier dans la mer du Nord, le Kattegat et la mer Baltique occidentale. Cette espèce serait plus abondante en mer du Nord et dans la partie sud de son aire de répartition comme en Méditerranée. Cette espèce, peu commune, vivrait plutôt en profondeur, plus particulièrement en Méditerranée.
A. subulata a un corps fusiforme, long et étroit se terminant par une “queue” particulièrement longue chez le mâle adulte. C'est un petit calmar, le plus souvent d'une longueur de manteau* jusqu'à environ 12 cm.
La longueur du manteau est la mesure de longueur utilisée chez ces animaux (la tête et les bras ne sont pas pris en compte dans cette mesure). La longueur maximale du manteau, long et étroit, varie selon les régions, elle est au maximum de 20 cm chez les mâles et 12 cm chez les femelles. En moyenne, elle est de 18 cm pour les mâles et 14 cm pour les femelles.
Les nageoires, sur la partie postérieure du manteau, sont en forme de losange, leur bords postérieurs sont concaves et s'étendent le long de la queue. Leur longueur dépasse la moitié de la longueur du manteau.
La tête porte 2 gros yeux recouverts d'une mince membrane cornéenne transparente (c'est une caractéristique de l'ordre des Myopsides).
La tête entourée de 8 bras et 2 tentacules rétractiles. Les 8 bras ont chacun 2 rangées de ventouses. Ces bras sont relativement courts et le bras hectocotyle* (bras ventral gauche) possède 6 à 8 paires de ventouses normales suivies de deux rangées de fines papilles (des ventouses modifiées).
Les tentacules sont courts (plus courts que la longueur du manteau plus de la tête). Les massues sont moins longues et moins larges et les ventouses médianes sont plus petites que chez A. media. Ces tentacules servent à la capture des proies et ne sont visibles que lorsque l'animal chasse ou sur l'animal mort.
Il n'y a pas de ventouses sur la membrane buccale (c'est une caractéristique du genre). Cette espèce ne possède pas de photophores*.
Le manteau est gris pâle avec de nombreuses taches brunes ou violacées.
Les Alloteuthis constituent un groupe de petits calmars Loliginidés présents dans l'océan Atlantique oriental et en Méditerranée.
Ils peuvent être distingués des autres Loliginidés (comme Loligo vulgaris) de l'Atlantique par :
Chez A. media, le bord du manteau s'étend obliquement vers l'arrière entre les marges dorsale et ventrale. Les nageoires ont un contour en forme de cœur. Les tentacules exceptionnellement longs représentent plus de 50 % de la longueur du manteau chez les mâles.
A. media et A. subulata ont longtemps été confondues sous le nom d'Alloteuthis media. La distinction des deux espèces n'est pas toujours évidente surtout chez les jeunes individus. Dans les études anciennes, il est souvent difficile de savoir laquelle des deux espèces est étudiée.
Les spécimens immatures de ces deux espèces sont pratiquement impossibles à distinguer. Les deux espèces n’ont d'ailleurs été distinguées que depuis 1912 et leur appartenance à des espèces différentes est très discutée. Il semblerait qu'il y ait des morphotypes et/ou des variations ontogéniques (au cours du développement) chez les femelles et chez les mâles rendant difficile l'identification. Par ailleurs, leur présence dans une même région et l'existence de cohortes différentes (âges différents) ne facilite pas l'analyse. L'existence de mâles de petite taille a été décrite. Semblables aux femelles et appelés mâles pirates, ils tentent de féconder des femelles déjà engagées dans une reproduction avec un mâle dominant.
Une étude de 2015 qui a analysé des données moléculaires (A.D.N. mitochondrial COI et A.D.N. nucléaire 18S - L'ADN ou Acide DésoxyriboNucléique - est le support de l'information génétique) de spécimens de la mer du Nord et de la Baltique a conclu que ces espèces sympatriques*, dans cette région, ne pouvaient pas être distinguées les unes des autres.
Les Loliginidés sont des prédateurs actifs jouant un rôle important dans le réseau trophique*. Les calmars capturent leur proie en faisant jaillir les deux tentacules* munis de ventouses uniquement sur les massues et la ramènent dans la couronne des bras pour la maintenir. Leur bec corné (bec de perroquet) sert à déchiqueter la proie. Pour immobiliser une proie, la salive contient des substances neurotoxiques* (et de nombreux enzymes et neurotransmetteurs). La radula* sert à convoyer la nourriture. Les proies consommées par les calmars sont connues par l'étude des contenus stomacaux des individus capturés par la pêche commerciale.
Alloteuthis subulata se nourrit de poissons et de crustacés. Les principales proies sont des Gobiidés (comme Pomatoschistus minutus, Crystallogobius linearis, Gymnammodytes semisquamatus, Aphia minuta), des Clupéidés (comme Sprattus sprattus), des Gadidés, des Ammodytidés (comme Ammodytes tobianus), des polychètes, des Mysidacés et d'autres calmars. Cette espèce se nourrit plutôt dans la zone pélagique* que près du fond.
Les céphalopodes sont des animaux gonochoriques* stricts ce qui signifie que les sexes sont séparés. Chaque individu ne se reproduit qu’une fois en fin de vie (semelparité*).
Les mâles possèdent une queue un peu plus longue que celle des femelles, plus particulièrement pour A. subulata.
Chez A. subulata, les migrations saisonnières sont liées également à la reproduction et la période de ponte est limitée à la période estivale (juin-juillet), les deux sexes arrivent ensemble.
Chez le mâle, les spermatozoïdes* sont enfermés dans une structure très élaborée, le spermatophore*. Celui-ci est un tube chitineux* étroit que le mâle passe à la femelle au moyen d’un bras modifié, l’hectocotyle*. Un mâle possède de nombreux spermatophores.
La ponte d' A. subulata ressemble à celle d'A. media, mais les cordons sont plus grands 3-5 cm de long avec des tiges plus courtes attachées à un substrat dur. Le dénombrement d'environ 150 œufs matures pondus par session, indique ainsi que la femelle A. subulata peut se reproduire par intermittence et produire jusqu'à 40 lots séparés d'œufs.
Le développement embryonnaire* est direct et dure 2 à 3 semaines à des températures de 15 à 18 °C. Les petits nouveau-nés, d'une longueur de manteau de 1,5 à 2,2 mm, ont une phase de vie planctonique* de quelques semaines avant de devenir démersaux*. Les jeunes animaux grandissent rapidement jusqu’au début de l’hiver.
Chez A. subulata, la durée de vie varie également selon les régions et est de l'ordre de 6 à 12 mois.
Les adultes meurent après la reproduction.
Ces calmars vivent en bancs.
Comme tous les animaux sauvages, les calmars sont les hôtes de différents parasites.
Chez cette espèce, plusieurs parasites ont été observés : sur les branchies, le trematode monogène Isancistrum loliginis de Beauchamp, 1912, et, principalement sur les bras et les tentacules, Isancistrum subulatae Llewellyn, 1984, dans la cavité palléale et sur les ovaires le nématode, Filaria loliginis delle Chiaje, 1829, ainsi que le copépode Pennella sp.
Les calmars, comme les seiches, possèdent deux façons de se déplacer.
Lors de leur fuite en arrière, les calmars (ainsi que les seiches et les poulpes) peuvent éjecter un nuage d’encre afin de perturber ou leurrer l’agresseur.
Les rapides changements de couleurs sont assurés par l’expansion de cellules pigmentées les chromatophores*. Ces derniers sont petits quand ils sont au repos et grands quand les muscles se sont contractés. Quand les fibres musculaires des chromatophores cessent de se contracter, le chromatophore revient à son état (petit) initial.
La rigidité du corps est en partie assurée par une mince lame chitineuse* transparente presque toute droite et un peu dilatée à la partie supérieure, la plume (ou gladius). Cette structure correspond à la base chitineuse d'une coquille régressée dont la calcification a été perdue.
Alloteuthis subulata effectue des migrations saisonnières liées à la reproduction.
En Atlantique, les mâles d'A. subulata ont des queues plus longues que les femelles ; alors qu'en Méditerranée, ce sont les femelles qui ont les plus longues queues.
Les Alloteuthis sont des espèces comestibles faisant l'objet d'une pêche de faible importance (pêche accessoire).
Les céphalopodes ont tendance à concentrer rapidement les métaux lourds (ou éléments traces métalliques) et autres substances toxiques dans leurs tissus, ce qui joue un rôle important dans la bioaccumulation* de ces polluants chez les prédateurs marins et a des implications pour la consommation humaine. Des niveaux élevés de cadmium et de mercure sont souvent enregistrés uniquement dans la glande digestive (qui ne se consomme pas). Il n’y a aucune accumulation de métaux dans les tissus musculaires (le manteau qui se mange).
Les calmars possèdent des axones (fibres nerveuses des neurones) géants qui peuvent avoir un diamètre de 1,5 mm. Ces axones permettent une transmission de l’information nerveuse optimale et rapide aux muscles, ce qui permet une locomotion performante.
Ces axones géants ont été observés par L.W. Williams en 1909 et redécouverts par J.Z. Young en 1939. Cette caractéristique particulière a permis l'étude du fonctionnement des messages nerveux par Sir A. Huxley et Sir A. Hodgkin (tous les deux prix Nobel en 1963 pour ces travaux).
Les calmars sont répartis dans deux ordres : les Myopsides et les Oegopsides, selon la présence (Myopsides) ou l’absence (Oegopsides) d’une membrane cornéenne transparente couvrant l’œil. Les Loliginidés sont des Myopsides.
Les Alloteuthis sont consommés par de nombreux organismes : des pieuvres (Octopus vulgaris, Eledone moschata, d'autres calmars (Loligo vulgaris et Loligo forbesii), des poissons cartilagineux (Scyliorhinus canicula, Squalus blainvillei, Aetomylaeus bovinus, Raja clavata, R. brachyura, R montagui), des poissons osseux (Chlopis bicolor, Gnathophis mystax, Merluccius merluccius, Seriola dumerilli, Phycis blennoides, Trisopterus minutus, Thunnus alalonga, Scophthalmus rhombus, Chelidonichthys cuculus et C. lucerna, Merlangius merlangus) et des cétacés comme Stenella coeruloalba, Hypperoodon ampullatus, Tursiops truncatus, Delphinus delphis, Phocoena phocoena, et même par des macareux moines (Fratercula arctica).
La longueur de la queue, selon certains auteurs, différente selon le sexe, pourrait jouer un rôle dans la reconnaissance du genre, la parade nuptiale, etc...
Casseron est un terme qui est plus utilisé en cuisine, il désigne les seiches ou Sépiides. Le mot casseron désigne en général des seiches de petite taille. L'origine de ce nom n'est pas claire : il serait dérivé de casse avec le suffixe -eron, parce qu'il émet de l'encre ! ou encore selon Littré, casseron serait dérivé de casse (= caisse) du fait qu'il contient une liqueur noire !
Calmar est l'appellation utilisée par les naturalistes.
Calamar : du latin [calamus] = calame, roseau. La plume (ou gladius, en latin : épée ou glaive) étant comme le roseau taillé pour l'écriture dans l'Antiquité. Ce terme est, de nos jours, davantage utilisé sur les étalages des poissonniers et en gastronomie.
Encornet : nom littéral qui exprime la forme du manteau*.
Alloteuthis : du grec [allo] = autre (parmi plusieurs), différent, étranger, et du grec [teuthis] = calmar, donc autre calmar. Ce nom de genre a été créé en 1916 par le zoologiste et paléontologue suisse Adolf Naef (1883-1949), puis publié en 1920 par le zoologiste allemand Gerhard Konrad Wülker (1885-1930).
subulata : du latin [subula] = alène et le suffixe latin [-ata] = comme ou avec, en relation avec l’extrémité postérieure pointue du manteau*.
Numéro d'entrée WoRMS : 153131
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Cephalopoda | Céphalopodes | Yeux complexes, coquille interne, externe cloisonnée ou absente, cavité palléale musclée, siphon musculeux, tentacules ou bras (munis de ventouses). |
| Sous-classe | Coleoidea | Coléoïdes | Ventouses sur les bras, au nombre de 8 au moins. Bras hectocotyle chez le mâle pour le transfert des spermatophores. 2 branchies, 2 néphridies, une coquille interne ou vestigiale, des chromatophores, une poche à encre, un grand cerveau. |
| Super ordre | Decapodiformes | Décapodiformes / Decabrachia | Céphalopodes à 8 bras et 2 tentacules de chasse. |
| Ordre | Myopsida | Myopsides | Calmars possédant une membrane cornéenne transparente recouvrant l'œil. Les tentacules et les bras portent des ventouses mais jamais de crochets. Cet ordre comprend 2 familles (dont les Loliginidés) et peu d'espèces mais ces dernières sont pour la plupart côtières et donc plus familières. |
| Famille | Loliginidae | Loliginidés | Calmars côtiers et peu profonds. Certaines espèces tolèrent de faibles salinités. Les nageoires se rejoignent à l'extrémité postérieure du corps et peuvent s'étendre sur une partie ou sur toute la longueur du manteau. Les bras portent généralement 2 rangées de ventouses et les massues tentaculaires en portent 4 rangées. Le bras inférieur gauche est généralement modifié chez les mâles adultes (bras hectocotyle). |
| Genre | Alloteuthis | ||
| Espèce | subulata |
 Céphalopodes
Céphalopodes

Alloteuthis subulata
Cette espèce est caractérisée par une "queue" allongée, fine et pointue.
Port de Brezellec (29), 8 m, de nuit
10/07/2012
 Céphalopodes
Céphalopodes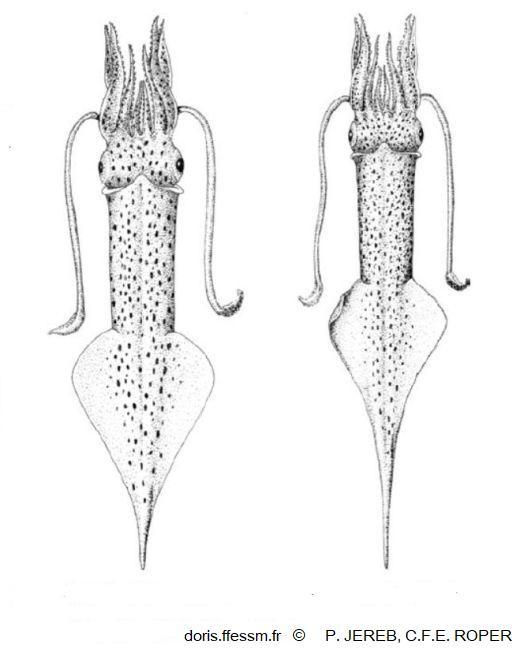
Alloteuthis subulata femelle et mâle
Vue dorsale montrant la "queue" caractéristique de cette espèce. La femelle est à gauche, le mâle à droite.
Dessins de P. Jereb et C.F.E. Roper 2010 page 53, figure 81
Reproduction de documents anciens
2010
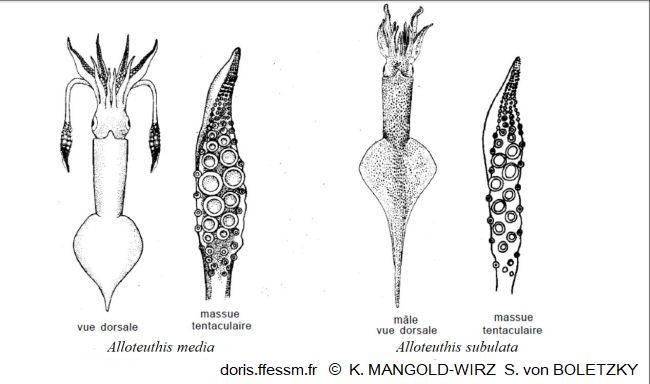
Comparaison des deux Alloteuthis
Alloteuthis media possède des massues tentaculaires larges avec de grosses ventouses et l'extrémité postérieure du manteau est faiblement pointue.
Alloteutis subulata a des massues tentaculaires plus fines avec de plus petites ventouses, son extrémité postérieure forme une pointe caractéristique.
Dessin de K. Mangold-Wirz et de S. von Boletzky 1987 page 681 fig 2-3
Reproduction de documents anciens
1987


Ponte d'Alloteuthis subulata
Dans les cordons translucides, on peut distinguer les embryons encapsulés. La ponte de cette espèce est légèrement différente de la précédente.
Sur l'épave de la "Prinses Astrid", Dunkerque (59), 18 m
17/06/2021
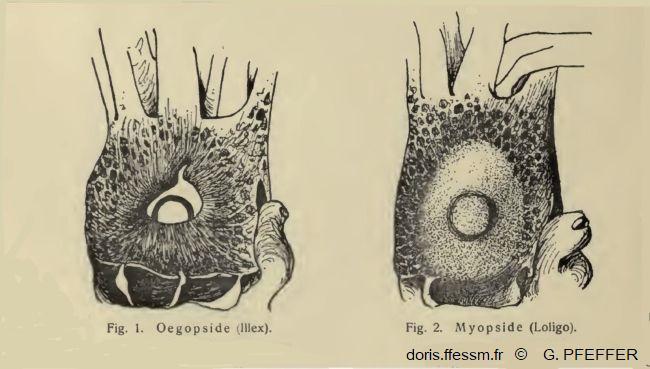
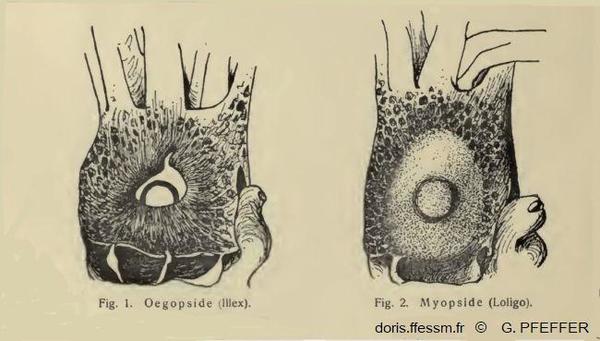
Comparaison de l'œil chez les Myopsides et les Œgopsides
Fig. 1 : Tête de Illex vue du côté droit, l'œil n'est pas recouvert d'une membrane cornéenne transparente. Ordre des Œgopsides.
Fig. 2 : Tête de Loligo vue du côté droit, l'œil est recouvert d'une membrane cornéenne transparente. Ordre des Myopsides.
Les calmars sont répartis dans deux ordres : les Myopsides et les Œgopsides, selon la présence ou l’absence d’une membrane cornéenne transparente couvrant l’œil. Les Loliginidés sont des Myopsides.
D'après deux dessins de G. Pfeffer 1901, IV, page 10.
Reproduction de documents anciens
1901
Rédacteur principal : Yves MÜLLER
Vérificateur : Laure BONNAUD-PONTICELLI
Responsable régional : Yves MÜLLER
Anderson F.E., Pilsits A., Clutts S., Laptikhovsky V., Bello G., Balguerias E., Lipinski M., Nigmatulin C., Pereira J.M.F., Piatkowski U., Robin J-P., Salman A., Tasende M.G., 2005, Systematics of Alloteuthis (Cephalopoda: Loliginidae) based on molecular and morphometric data, Journal of Experimental Marine Biology and Ecology, 364, 99-109.
Gebhardt K., Knebelsberger T., 2015, Identification of cephalopod species from the North and Baltic Seas using morphology, COI and 18S rDNA sequences, Helgoland Marine Research, 69, 259-271.
Hastie L.C., Nyegaard M., Collins M.A., Moreno A., Pereira J.M.F., Piatkowski U., Pierce G., 2009, Reproductive biology of the loliginid squid Alloteuthis subulata in the north-east Atlantic and adjacent waters, Aquatic Living Resources, 22, 35–44.
Holme N.A., 1974, The biology of Loligo forbesi Steenstrup (Mollusca: Cephalopoda) in the Plymouth area, Journal of the Marine Biology Association of the United Kingdom, 54, 481-503.
Jereb P., Allcock A.L., Lefkaditou E., Piatkowski U., Hastie L.C., Pierce G.J., 2015, CEPHALOPOD BIOLOGY AND FISHERIES IN EUROPE II SPECIES ACCOUNTS, ICES International Council for the Exploration of the Sea, Cooperative Research Report, N° 325, 376p.
Lamarck J.B.,1798, Extrait d'un Mémoire sur le genre de la Sèche, du Calmar et du Poulpe, vulgairement nommés, Polypes de Mer. Bulletin des Sciences, par la Societe Philomatique de Paris, 1(17), 129-131.
Mangold-Wirz K., 1963, Biologie des Céphalopodes benthiques et nectoniques de la Mer Catalane, Vie et Milieu, Supplément 13, 285 p.
Mangold Wirz K., Boletzky S. von, 1987, CEPHALOPODES, in Fischer W., Bauchot M-L., Schneider M., 1987, FICHES FAO D’IDENTIFICATION DES ESPECES POUR LES BESOINS DE LA PECHE (REVISION 1). MEDITERRANEE ET MER NOIRE, ZONE DE PECHE 37. VOLUME 1. VEGETAUX ET INVERTEBRES, CEE, FAO, ed. FAO, Rome, 760p.
Pierce G.J., Allcock L., Bruno I., Bustamants P., Gonzalez A., Guerra A., Jereb P., lefkaditou E., Malham S., Moreno A., Pereira J., Piatkowski U., Rasero M., Sanchez P., Begona Santos M., Santurtun M., Seixas S., Sobrino I., Villanueva R., 2010, Cephalopod biology and fisheries in Europe,. ICES cooperative research report. International Council for the Exploration of the Sea, Copenhagen.
Pfeffer G., 1908, Die Cephalopoden in Borgert, Apstein, Lohmann, Lenz, Pfeffer, Simroth, 1901-1911, 2 Bd. III, Dolioliden, Salpen, Appendicularien, Ascidienlarven, IV Pteropoden, Cephalopoden, V Gastropoden, Acephalen : in Brandt K. A. H. & Apstein C. NORDISCHES PLANKTON, ZOOLOGISCHER TEIL, Lipsius & Tischer 1-4, 5-10,11-21, 23-29, 31-47, 1-8, 9-116, 1-36, 37-55.
Roumbedakis K., Drabkova M., Tyml T., Cristo C. di., 2018, A perspective around cephalopods and their parasites and suggestions on how to increase knowledge in the field, Frontiers in Physiology, 9, 1573, 9p.
Toll R.B., 1998, The gladius in teuthoid systematics, Smitthsonian Contributions to Zoology, 586(1), 55-67
La page de Alloteuthis subulata dans l'Inventaire National du Patrimoine Naturel : INPN.
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.