Forme ovale et allongée
Côtes rayonnantes larges, un peu écartées dans la partie postérieure
Stries concentriques un peu espacées
Aspect quadrillé
Sinus palléal peu profond, de forme arrondie
Siphons soudés sur les 3/4 de leur longueur
Coquille de 4 à 5 cm de longueur
Palourde japonaise, palourde croisée japonaise, palourde franche (le nom de palourde est donné à de nombreux bivalves commercialisés).
Japanese carpet shell, pacific palourde, mud clam, short necked clam, Manilla clam, manila clam, japanese littleneck clam, japanese littleneck, japanese clam (GB), Almeja japonesa, almeja japonica (E), Japanische Muschel, Japanische Teppichmuschel, Japanische Teichmuschel (D), Japanse tapijtschelp, asiatische tapijschelp (NL), Asari (Japon).
Venus philippinarum A. Adams & Reeve, 1850
Venus tessellata A. Adams & Reeve, 1850
Tapes philippinarum (Adams & Reeve 1850)
Ruditapes philippinarum (Adams & Reeve 1850)
Ruditapes (Venerupis) philippinarum Adams & Reeve 1850
Venerupis (Ruditapes) philippinarum (A. Adams & Reeve, 1850)
Venus (Amygdala) philippinarum (A. Adams & Reeve, 1850)
Venus analis R. A. Philippi, 1851
Tapes denticulata G. B. Sowerby II, 1852
Tapes indica G. B. Sowerby II, 1852
Tapes denticulatus (Sowerby, 1852)
Tapes indica (Sowerby, 1852)
Tapes japonica (Deshayes, 1853)
Tapes japonica Deshayes, 1854
Tapes violascens Deshayes, 1854
Tapes semidecussata Reeve, 1864
Tapes ducalis Römer, 1870
Tapes philippinarum okupi Bryan, 1919
Paphia bifurcata Quayle, 1938
Tapes bifurcata (Quayle, 1938)
Ruditapes philippinarum f. reticulata T. Cossignani, 2023
Océan Pacifique, océan Atlantique, Méditerranée
Zones DORIS : ● Europe (côtes françaises), ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ● Atlantique Nord-Ouest, ● Indo-Pacifique, ● Caraïbes, ○ [Méditerranée française]R. philippinarum est probablement cosmopolite en mers tempérées et subtropicales.
Cette espèce est originaire de l'océan Pacifique et est présente du Pakistan (océan Indien) aux îles Kouriles (Russie). Elle fut introduite successivement aux îles Hawaï et sur la côte occidentale du Canada.
En Europe, elle est présente de l’ouest de la Norvège jusqu’en Méditerranée occidentale.
En France, son introduction, pour l’aquaculture, date de 1975, on la retrouve sur la côte atlantique puis en Méditerranée (1980).
Ruditapes philippinarum vit enfouie à quelques centimètres (7 cm, maximum 10 cm) de profondeur dans le substrat* dans l'étage infralittoral*. Elle apprécie des substrats variés de sable, de petit gravier vaseux et de vase et particulièrement les zones côtières abritées comme les lagunes (les étangs d'eaux saumâtres méditerranéens) communiquant avec la mer.
C’est la seule espèce de palourde que l’on peut trouver dans la vase molle.
On la retrouve à des profondeurs moyennes de 1 à 3 m mais rarement au-delà de 10 m.
Les limites écologiques de cette espèce sont comprises entre 5 °C et 30 °C pour la température, et de 12 à 40 ‰ (ou psu) pour la salinité, ainsi qu’un taux d’oxygène dissous pas trop inférieur à 80 %. Ce sont des bivalves eurythermes* et euryhalins*.
Les deux valves* sont équivalves* et inéquilatérales*, elles forment un ensemble ovale allongé (parfois triangulaire dans l’Atlantique). L’extrémité antérieure est plus étroite et l’extrémité postérieure plus large. Les sommets sont décalés vers l’avant. Les côtes rayonnantes sont larges surtout dans la partie postérieure et un peu écartées, les stries concentriques croisent les précédentes (aspect quadrillé) et sont également un peu espacées. Les marges sont lisses.
La couleur externe est nuancée de blanc, de gris et de brun, rarement unie, le plus souvent avec de très beaux motifs extrêmement variables de taches, points, lignes ou chevrons bruns à noirs, disposés souvent en bandes axiales, le plus souvent dans la zone postérieure plus sombre. La coloration et les motifs ne sont pas toujours identiques sur les deux valves.
La charnière montre trois dents cardinales* à chaque valve, celle du centre dans la valve gauche, et celles centrale et postérieure de la valve droite sont bifides. Il n’y a pas de dents latérales.
Le sinus* palléal* est peu profond et de forme arrondie sans atteindre la ligne médiane. Les siphons* sont soudés sur les ¾ de leur longueur.
L’intérieur des valves est blanc ou jaunâtre, en particulier près du sommet et du ligament*, et un peu de violet près du sinus palléal et du bord postérieur.
Les différentes espèces de palourdes présentent une grande variabilité d’aspect. Il y a donc un risque de confusion avec d'autres espèces.
Ruditapes decussatus (Linnaeus,1758) : la palourde croisée d'Europe. Cette espèce est très proche de R. philippinarum, elles ont pratiquement les mêmes exigences écologiques, mais R. decussatus est cependant un peu plus exigeante. Toutefois on ne la trouve pas dans de la vase molle. La sculpture de la coquille est moins prononcée. Les côtes rayonnantes sont plus fines et plus serrées, les stries concentriques moins espacées. Les siphons* sont presque complètement séparés. La forme du sommet du sinus* palléal* est un peu anguleux dorsalement.
Venerupis corrugata (Gmelin,1791) : la palourde poulette. Elle possède une coquille de forme ovale allongé, son sinus palléal arrondi atteint ou dépasse la ligne médiane des valves, et est séparé par un espace étroit de la ligne palléale. Elle mesure 4 à 5 cm de longueur. Sa couleur est plutôt jaune orangé avec parfois un peu de blanc. Elle peut s'enfoncer dans le sédiment jusqu'à 5 cm de profondeur et que l'on trouve jusqu'à 35 m de profondeur, sur des fonds de sable fin ou sablo-vaseux, dans les endroits très abrités comme les baies, les golfes ou les estuaires. C'est à mi-hauteur de l'estran* que ce coquillage est le plus abondant. Cette espèce est présente en Atlantique des côtes de Norvège à l'Afrique du Sud, en Manche et en Méditerranée.
Polititapes aureus (Gmelin, 1791) : la palourde jaune. Elle a une forme plus allongée dans la largeur du coté postérieur que R. philippinarum. La coquille mesure 3 à 4 cm de longueur. Les stries sur les valves* sont marquées mais très légèrement. Sa couleur externe est nuancée de blanc crème, d'ocre, et de brun avec parfois des motifs. La couleur interne tend vers un jaune or caractéristique à l'espèce. La zone de répartition de Polititapes aureus va de la Norvège au nord jusqu’en Galice (Espagne) au sud. Elle est également présente dans toute la Méditerranée, mer Noire comprise, ainsi que dans l’archipel des Açores à l’ouest de l’Afrique. Cette palourde préfère les zones calmes de l'infralittoral*. Elle vit enfouie dans des sédiments vaseux ou sablo-vaseux, voire de graviers, du médiolittoral* inférieur jusqu’à une quarantaine de mètres de profondeur.
Polititapes rhomboides (Pennant, 1777) : aussi appelée palourde rose, elle a une forme proche de R. philippinarum et la même longueur. Cependant la palourde rose est plus allongée et plus ovale, d'où le nom latin [rhomboïde]. Autre caractéristique, ses stries concentriques sont beaucoup plus marquées. Sa coloration est nuancée de blanc crème, de brun, de rouge orangé et de rose avec parfois des motifs.
Cette palourde est très commune en mer du Nord, en Manche et en Atlantique Nord-Est où elle est recensée de la Norvège au nord jusqu’aux côtes marocaines au sud. Elle est plus rare en Méditerranée.
La palourde rose vit enfouie dans le sédiment. Ubiquiste*, on peut la trouver aussi bien dans les sables grossiers plus ou moins vaseux, le sable coquillier, les fonds de graviers ou le faciès* du maërl*. Elle est présente de l’étage infralittoral* inférieur jusqu’à 180 m de profondeur environ, c’est cependant dans les 50 premiers mètres que sa densité est la plus importante.
Ruditapes philippinarum est un suspensivore* filtreur* opportuniste. Cette espèce se nourrit et respire grâce aux siphons* qui affleurent à la surface du sédiment. L'eau entre par le siphon inhalant* puis elle est filtrée par les branchies* qui retient les particules alimentaires (et l’oxygène). L'eau est alors rejetée par le siphon exhalant*. Le régime alimentaire est composé de phytoplancton* et de matières organiques en suspension.
Des expositions à des concentrations sublétales de polluants (comme le thiaméthoxam) altèrent le profil protéomique des branchies*, affectant potentiellement la filtration et la nutrition
Chez Ruditapes philippinarum comme chez les autres palourdes, les sexes sont séparés (espèces gonochoriques*), mais il n’y a pas de dimorphisme sexuel*.
La première maturation sexuelle est obtenue dès la deuxième année pour R. philippinarum (lorsqu'elle mesure environ 20 mm). La période de reproduction s'étend de juin à septembre.
Le cycle de reproduction débute lorsque la température avoisine les 12 à 20 °C. Après un mois de maturation, la ponte est déclenchée. Les géniteurs expulsent leurs gamètes* (ovules* ou spermatozoïdes*) par le siphon* exhalant*. Une femelle peut émettre jusqu'à 3 millions d'ovules. La fécondation* a lieu en pleine eau.
Lorsque les conditions sont réunies, il peut y avoir deux pontes au cours de la même saison (dès 35 mm), une à la fin du printemps et l'autre à la fin de l'été.
Des œufs éclosent des larves* trochophores* planctoniques* (pendant 1 ou deux jours). Elle se transforment en larves véligères* (appelées larves-D - la coquille est en forme de D - de 90-95 µm pendant 1 à 3 semaines) puis en pédivéligères* (1 à 2 semaines). La vitesse du développement dépend de la température. Ensuite quand la longueur de coquille est de 190 à 235 µm, elles subissent une métamorphose* et se posent sur le fond. Elles se fixent en attachant un byssus* à un caillou ou un morceau de coquille et adoptent une vie benthique*. A ce stade, la jeune palourde mesure 0,5 mm. Plus tard elle se détachera du byssus et sera libre.
Des protocoles récents (2025) permettent de générer des palourdes gnotobiotiques (sans microbiote) pour étudier les interactions larvaires avec les micro-organismes.
Ruditapes philippinarum héberge des endoparasites* au stade larvaire : Acanthoparyphium macracanthum Rybakov & Lukomskaya, 1988, Acanthoparyphium shinanense Ryoo, Jung, Chang, Hong, Shin & Chai, 2021, Bacciger bacciger (Rudolphi, 1819) Nicoll, 1914, Pseudobacciger harengulae(Yamaguti, 1938) Nahhas & Cable, 1964, Cercaria elegans Tang, 1992 nec Mueller in La Valette, 1855, Cercaria tapidis Faust, 1924, Parvatrema duboisi (Dollfus, 1923) Bartoli, 1974, Proctoeces orientalis Cao, 1989 et d’autres ectoparasites mais à l’état adulte : Conchyliurus quintus Tanaka, 1961, Herrmannella hoonsooi Kim I.H., 1992, Hersiliodes exiguus Kim I.H. & Stock, 1996, Lichomolgus inflatus Tanaka, 1961, Modiolicola bifida Tanaka, 1961, Mytilicola intestinalis Steuer, 1902, Mytilicola orientalis Mori, 1935, Ostrincola koe Tanaka, 1961, Philoconcha amygdalae Yamaguti, 1936. Et une espèce dont le mode d’alimentation est inconnu : Aliivibrio finisterrensis Beaz-Hidalgo, Doce, Balboa, Barja & Romalde, 2010.
Il y a également des virus (Herpès-virus), des bactéries (Ricksettia spp., Vibrio tapetis), des protozoaires* parasites* (Perkinsus atlanticus), des cercaires (Cercaria elegans, Cercaria tapidis), des trématodes digénétiques (Cercaria elegans, Cercaria tapidis, Proctoeces orientalis).
Des populations naturelles avec des densités supérieures à 1000 individus/m² ont été observées. De telles populations ont même occasionnellement remplacé celles de Ruditapes decussatus.
La croissance et la richesse alimentaire sont les deux facteurs principaux qui favorisent la croissance de cette espèce avec une température de 20 °C et une salinité de 30 ‰ (ou psu). Cette croissance cesse en hiver.
Le pied puissant permet de s'enfouir rapidement et de se tenir dans le sédiment. Ces palourdes ont la capacité de se déplacer dans le substrat*.
Lorsque le substrat est trop dur, la coquille dépasse du sédiment.
La capacité de fouissage varie entre groupes : les individus sauvages s'enfouissent plus rapidement que les cultivés, avec des implications pour la survie en milieu naturel.
De nombreux poissons consomment cette espèce dont le flet Platichthys flesus, la daurade royale (Sparus aurata) et le baliste (Balistes capriscus).
Du fait de la surpêche et des rendements irréguliers de Ruditapes decussatus, R. philippinarum, avec d’excellents rendements, a été introduite en France (en 1972), pour l’élevage de naissain en écloserie.
Cependant, à la fin des années 1980, une bactérie (Vibrio tapesis) responsable de la maladie de l’anneau brun a fortement ralenti la production de ces palourdes voire l'a stoppée dans certaines régions. Cette maladie entraîne une forte mortalité lorsque la température de l'eau est trop froide. Elle se traduit par un dépôt brun sur la face intérieure et tout autour du mollusque. Les petits individus sont plus sensibles à la maladie.
R. philippinarum, est parfois considérée comme une espèce invasive dans le sens où elle est en concurrence directe avec l'espèce européenne, Ruditapes decussatus. Dans certaines régions elle a supplanté l'espèce autochtone.
Pour les conditions d’élevage, d’écloserie, de grossissement et de récoltes voir les informations de Goulletquer (2008-2010) dans les documents de la FAO.
Les palourdes font l'objet d'une réglementation sur la taille minimale de capture.
En Manche la taille minimale doit être supérieure à 40 mm pour la palourde japonaise, selon l'arrêté 55/2007 réglementant l'exercice de la pêche maritime à pied à la nage ou sous-marine en Manche.
La réglementation européenne est moins restrictive : la taille minimale de pêche est de 25 mm pour Rudipates spp. dans le Règlement (CE) n° 1967/2006 du Conseil du 21 décembre 2006 concernant des mesures de gestion pour l'exploitation durable des ressources halieutiques en Méditerranée.
Ne pas hésiter à se renseigner auprès des Affaires Maritimes du département pour des informations complémentaires à la réglementation.
Le mot palourde est apparu dans la langue française au XVIe siècle. Il vient du latin [peloris] qui désigne un gros coquillage.
Elle est appelée palourde japonaise mais la première description a été faite d’après des spécimens
provenant des Philippines !
Ruditapes vient du latin [rudis] = brut, qui est à l'état naturel, non façonné, rude, âpre, dur ; et du latin [tapes] = tapis, tapisserie. Ce nom de genre a été créé par le naturaliste italien Alessandro Chiamenti (1848-19 ??) en 1900 ; à partir du nom de genre Tapes créé, en 1811, par le malacologiste autrichien Johann Karl Megerle von Mülhfeld (1765-1840) pour des coquilles dont l'aspect rappelle les motifs géométriques de certains tapis ou paillassons.
philippinarum : (génitif latin) des Philippines. Ce nom d’espèce a été donné par les naturalistes britanniques Arthur Adams (1820-1878) et Lovell Augustus Reeve (1814-1865). L’espèce a été décrite d'après des spécimens provenant des Philippines, dans l’ouvrage édité au retour de l’expédition du HMS Samarang (1843-1846).
Numéro d'entrée WoRMS : 231750
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Bivalvia / Lamellibranchia / Pelecypoda | Bivalves / Lamellibranches / Pélécypodes | Mollusques aquatiques, filtreurs, au corps comprimé latéralement. Coquille composée de 2 valves articulées disposées de part et d’autre du plan de symétrie. Absence de tête, de pharynx, de radula et de glande salivaire. |
| Sous-classe | Autobranchia | Autobranches | |
| Infra-classe | Heteroconchia | Hétéroconchie | |
| Subter-classe | Euheterodonta | Euhétérodonte | |
| Super ordre | Imparidentia | Imparidenties | |
| Ordre | Venerida | Vénérides | Coquille mince, allongée, dure et costulée, bâillante à une ou aux deux extrémités. Ligament à la fois interne et externe. |
| Super-famille | Veneroidea | ||
| Famille | Veneridae | Vénéridés | Coquille équivalve pour la plupart des espèces. De forme ronde, ovale ou encore oblongue. Ecusson distinct, présence de stries concentriques et parfois d’éléments rayonnants |
| Sous-famille | Tapetinae | ||
| Genre | Ruditapes | ||
| Espèce | philippinarum |
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Palourde japonaise
Les stries rayonnantes sont plus espacées et les stries concentriques plus marquées que chez sa cousine européenne, Ruditapes decussatus.
Bassin d’Arcachon (33)
10/08/2008
 Bivalves (ou Lamellibranches)
Bivalves (ou Lamellibranches)

Les siphons en extension
Les siphons de Ruditapes philippinarum sont soudés sur les 3/4 de leur longueur
Forme 4, Dunkerque (59)
16/10/2011


Intérieur et extérieur des coquilles
A gauche un doublet en vue intérieure, à droite un doublet en vue externe
Forme 4, port de Dunkerque (59)
25/03/25


Quelques exemples de coloration
La couleur externe est nuancée de blanc, de gris et de brun, rarement unie, le plus souvent avec de très beaux motifs extrêmement variables de taches, points, lignes ou chevrons bruns à noirs, disposés souvent en bandes axiales, le plus souvent dans la zone postérieure plus sombre. La coloration n'est pas toujours identique sur les deux valves.
Assemblage de plusieurs photos de spécimens observés en forme 4, Dunkerque (59)
26/05/2025
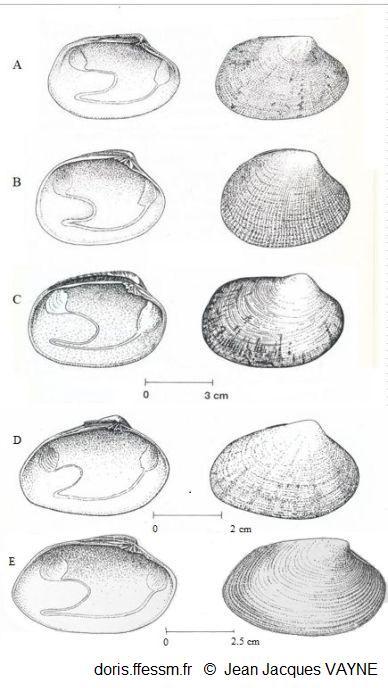
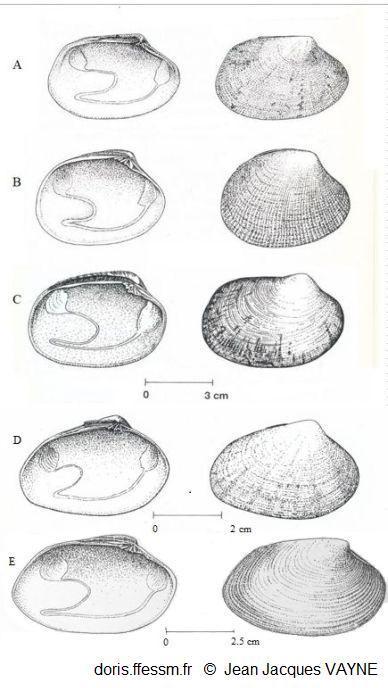
Comparaison de cinq palourdes
à gauche vue intérieure de la valve gauche, à droite vue extérieure de la valve droite
A : Ruditapes decussatus
B : Ruditapes philippinarum
C : Venerupis corrugata
D : Polititapes aureus
E : Polititapes rhomboides
D’après les dessins de J.J. Vayne in Quéro et al. 1998 (pp : 121, 123, 145, 146, 126)
Reproduction de documents anciens
1998


Palourde japonaise et palourde croisée d'Europe
Comparaison entre la palourde japonaise Ruditapes philippinarum (à gauche) et la palourde croisée européenne Ruditapes decussatus (à droite).
Bassin d’Arcachon (33)
10/08/2008


Coloration variée
La coloration et les motifs sont extrêmement variables.
Fig. 40 & 41, planche 22 dans "The zoology of the voyage of H.M.S. Samarang" par A. Adams & L.A. Reeve
Reproduction de documents anciens
1848-1850
Rédacteur principal : Yves MÜLLER
Rédacteur : Cédric CONTI
Vérificateur : Philippe LE GRANCHÉ
Responsable historique : Véronique LAMARE
Responsable régional : Yves MÜLLER
Adams A., Reeve L. A.,1848-1850, MOLLUSCA. In A. Adams (ed.), THE ZOOLOGY OF THE VOYAGE OF H.M.S. SAMARANG, UNDER THE COMMAND OF CAPTAIN SIR EDWARD BELCHER, C.B., F.R.A.S., F.G.S., DURING THE YEARS 1843-1846. Reeve & Benham, London, x + 87 pp., 24 pls
Chiamenti A., 1900, Contribuzione allo studio della Malacofauna adriatici, Nota sulla famiglie delle Veneride, e delle Petricolide, Rivista Italiana di scienze naturali, 2, 9-15.
Dang C., 2009, Dynamique des populations de palourdes japonaises (Ruditapes philippinarum) dans le bassin d'Arcachon : conséquences sur la gestion des populations exploitées, PhD Thesis, Bordeaux 1, 374p.
Flassch J-P., 1988, La palourde. Dossier d'élevage, Ifremer, 106p.
Gérard A., 1978, Recherche sur la variabilité de diverses populations de Ruditapes decussatus et Ruditapes philippinarum (Veneridae, Bivalvia). Thèse dr. 3ème cycle. Univ. Bretagne Occidentale, Brest, France, 149p.
Goulletquer P., 1989, Mortalité hivernale chez la palourde japonaise Ruditapes philippinarum sur le littoral atlantique: aspects biochimique et écophysiologique, Haliotis, 19, 215-226.
Goulletquer P., 1997. A bibliography of the Manila clam Tapes philippinarum. IFREMER, RIDVR-97.02/RA/La Tremblade. 122p.
Goulletquer P., 2008-2010, Ruditapes philippinarum in Cultured Aquatic Species, Fact Sheets, FAO Fisheries and Aquaculture Department, Rome.
Humphreys J., Caldow R.W.G., McGrorty S., West A.D., Jensen A.C., 2007, Population dynamics of naturalised Manila clams Ruditapes philippinarum in british coastal waters, Marine Biology, 151, 2255-2270.
Kim W.S., Huh H.T., Huh S.-H., Lee T.W., 2001, Effects of salinity on endogenous rhythm of the Manila clam, Ruditapes philippinarum (Bivalvia: Veneridae), Marine Biology, 138, 157-162.
Laspougeas C., 2007, Etude sur les gisements naturels de mollusques bivalves accessibles en pêche à pied en basse-Normandie. Aspects biologiques, halieutiques et sanitaires, Rapport final IFOP - AESN - SMEL - DDASSS 50 - Université de Caen, 195p.
Peignoux J-M., Gérard A., Naciri Y., Ledu C., Phélipot P., 1995, Analyse du déterminisme de la coloration et de l’ornementation chez la palourde japonaise Ruditapes philippinarum, Aquatic Living resources, 8, 181-189.
Richardson C.A., 1987, Tidal bands in the shell of the clam Tapes philippinarum (Adams & Reeve, 1850), Proceedings ot the Royal Society of London, 230B, 367-387.
Richardson C.A., 1988, Exogenous and endogenous rhythms of band formation in the shell of the clam Tapes philippinarum (Adams & Reeve, 1850), Journal of Experimental Marine Bioiology and Ecology,.122. 105-126.
Robert R., Deltreil J.-P.,1990, Elevage de la palourde japonaise Ruditapes philippinarum dans le bassin d'Arcachon, Bilan des dix dernières années et perspectives de développement. RIDRV-90.40-RA/Arcachon, 21p.
Suarez A.A., Raven H., 2020, First records of naturalised Ruditapes philippinarum (Adams & Reeve, 1850)(Bivalvia: Veneridae) in Asturias (NW Spain), keys for identification, and evidence of hybridisation with native Ruditapes decussatus (Linnaeus, 1758), ELONA, Revista de Malacogía Ibérica[, 2, 67-83.
Titselaar F.F.L.M., 2008, Tapes philippinarum (Adams & Reeve, 1850) in de Oosterschelde. Spirula, 365, 2p.
La page de Ruditapes philippinarum dans l'Inventaire National du Patrimoine Naturel : INPN à actualiser
La page de Ruditapes Philippinarum sur le site de référence de DORIS pour les mollusques Molluscabase
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.