Algue rouge vif à rouge-brun
Touffe dense
Rameaux très fins, pseudodichotomes puis alternés
Présence de rameaux axillaires
Apex des rameaux à croissance déterminée pointus (apex de l’axe principal arrondi)
Jusqu'à 50 cm de longueur
Au microscope : une cellule centrale entourée de 4 cellules péricentrales
Au microscope : axes sans cortication
Atlantique côtes Est, Méditerranée, Pacifique
Zones DORIS : ● Europe (côtes françaises), ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ○ [Méditerranée française], ● Indo-PacifiqueCette espèce est présente dans l'océan Pacifique (Argentine, Chili, Chine, Corée, Japon, Nouvelle-Zélande, Russie et Etats-Unis d'Amérique). Elle est également observée sur nos côtes de l'Atlantique et en Méditerranée à la suite de l'importation d'huîtres creuses.
Cette algue est signalée comme se fixant sur une large variété de substrats* : roche, pieux en bois, cordages immergés, crustacés, voire tuniciers.
Dans l'Atlantique, elle peut être rencontrée en partie basse de l’estran* et dans les cuvettes de l’étage médiolittoral*.
En Méditerranée, elle se rencontre à faible profondeur dans les lagunes littorales abritant des activités conchylicoles.
Cette algue rouge vif à rouge-brun, pouvant mesurer jusqu'à 50 cm de longueur est constituée de longs rameaux fins, formant une touffe dense. La base du thalle* est constituée de rameaux prostrés (en contact avec le substrat) non cortiqués* (sans couche externe), fixés par des rhizoïdes* unicellulaires, qui restent en connexion avec les cellules péricentrales d’où ils émergent.
L’algue présente une ramification spiralée qui peut devenir alternée vers l’extrémité des rameaux. L’apex* des rameaux à croissance déterminée est pointu tandis que les rameaux à croissance indéterminée (tant que le végétal vit) présentent au contraire une extrémité arrondie. Les trichoblastes* sont rares.
Au microscope, les rameaux sont constitués d’une cellule centrale entourée de quatre cellules péricentrales, ce qui leur donne une allure très particulière, qui ne rend pas nécessaire la réalisation d’une coupe transversale. Les axes ne présentent aucune cortication. Le rapport longueur/largeur des segments (articles) varie de 0,8 à 4 à 6 vers la base.
On peut parfois observer la présence à l'aisselle des rameaux, de rameaux axillaires qui sont caractéristiques de cette espèce.
L’algue change de couleur avec l’arrivée de l’été, la couleur virant au gris-vert.
Cette espèce peut être très facilement confondue avec Polysiphonia stricta, qui possède également 4 cellules péricentrales. La distinction, au microscope, sera principalement assurée par l’observation de l’apex des rameaux, plus pointu que chez Polysiphonia stricta.
Une distinction sans ambigüité entre ces deux espèces passe par le séquençage du gène rbcL (Ribulose-1.5-Biphosphate Carboxylase, le gène classiquement utilisé pour le « barcoding » végétal, codant la grande unité de l’enzyme RubisCo, enzyme clef de la photosynthèse*), ce qui n’est pas à la portée de l’amateur...
Il est à ce titre illustratif d’observer que la présence de Polysiphonia morrowii sur les côtes britanniques n’a été découverte que récemment grâce à l’utilisation de techniques moléculaires (voir les travaux de Cristina Piñeiro-Corbeira publiés en 2020).
Comme toutes les algues, Polysiphonia morrowii est autotrophe* photosynthétique*. L'algue tire son énergie de la lumière solaire, et grâce à l'absorption d'eau, de dioxyde de carbone et des sels minéraux dissous dans l’eau, elle fabrique les matières organiques nécessaires à son développement.
Le cycle de vie repose sur le mode de reproduction trigénétique classique des Floridéophycées, avec une succession de gamétophytes*, de carposporophytes* et de tétrasporophytes*.
L'espèce est dioïque*. Les spermatanges* terminés par 4 à 7 cellules stériles sont regroupés à l’extrémité de rameaux fertiles, sont présents tout le long du gamétophyte mâle fertile, même s'ils sont plus nombreux vers l'apex. Sur les gamétophytes femelles fertiles, les cystocarpes* sont urcéolés (en forme d'urnes avec un col) et brièvement pédicellés*.
Sur les tétrasporophytes fertiles, les tétrasporanges* se différencient à l'apex des rameaux principaux et des rameaux secondaires où ils forment des séries droites (non spiralées) plus ou moins longues.
La caprelle japonaise, Caprella mutica, autre espèce du Japon, introduite en Europe, est un hôte potentiel de cette algue.
L’espèce est originaire du Japon et de Corée. Elle a été introduite en France via l’importation d’huîtres creuses Magallana gigas. Elle a été observée pour la première fois en Europe en 1993 aux Pays-Bas et en 1997, en Méditerranée, dans l’étang de Thau (Verlaque et al. 2015 : 213).
Elle a désormais colonisé une bonne partie des autres régions tempérées de la planète (côtes nord et sud américaines, Australie, Nouvelle-Zélande).
Cette espèce présente une affinité pour les eaux tempérées, qui correspondent à son biotope* d’origine. Elle a donc tendance à disparaître à la belle saison.
Le genre Polysiphonia est un genre particulièrement vaste, comportant aujourd’hui près de 200 espèces valides (le genre a compté plus de 900 espèces décrites !), avec des critères de détermination pas toujours très solides. Le genre a fait l’objet de nombreux travaux taxonomiques, et notamment de taxonomie moléculaire, qui ont progressivement réduit le nombre d’espèces apparentées. Une étude intéressante croisant analyses génétiques et critères morphologiques habituellement employés dans ce genre (22 critères étudiés) a mis en évidence les critères morphologiques qui étaient pertinents pour séparer les espèces (Stuercke et Freshwater, 2008) :
Polysiphonia morrowii synthétise plusieurs molécules aux propriétés antibactériennes, antivirales et anti-inflammatoires. Mei Jing Piao et al. (2018) ont par ailleurs mis en évidence le fait qu’une extraction à l’éthanol de cette algue présente des propriétés de protection des cellules contre les effets des ultraviolets B, ainsi que des propriétés anti-oxydantes.
Traduction du nom scientifique
Le botaniste Robert Kaye Greville (1794-1866) a décrit le genre Polysophonia, du grec ancien [polus] = plusieurs et [siphon] = tuyau pour faire référence à la structure des algues de ce genre, comportant un axe central entouré de plusieurs cellules péricentrales.
Le botaniste irlandais William Henry Harvey (1811-1866) a décrit l’espèce Polysiphonia morrowii en l’honneur du Dr James Morrow (1820-1865), médecin botaniste, qui a participé à l’expédition Perry au Japon entre 1853 et 1854. Cette expédition fut l’occasion d’une controverse importante entre le Dr James Morrow, qui avait profité de l’occasion pour réaliser des prélèvements dans un but scientifique, et le responsable de l’expédition américaine, le Commandant Matthew Calbraith Perry (voir l’article de A. Hunter Dupree en références pour avoir une description complète de cette histoire).Numéro d'entrée WoRMS : 232563
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Rhodobionta / Rhodophyta | Rhodobiontes | Algues rouges, pour la plupart marines. |
| Classe | Florideophyceae | Floridéophycées | Thalle élaboré formé de fins filaments branchés ou en lames. |
| Sous-classe | Rhodymeniophycidae | Rhodyméniophycidées | |
| Ordre | Ceramiales | Céramiales | Structure toujours uniaxiale. |
| Famille | Rhodomelaceae | Rhodomelacées | |
| Genre | Polysiphonia | ||
| Espèce | morrowii |
 Algues rouges (Rhodophycées)
Algues rouges (Rhodophycées)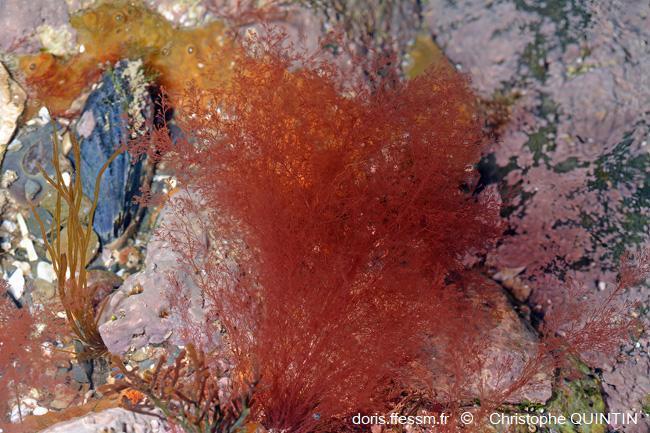
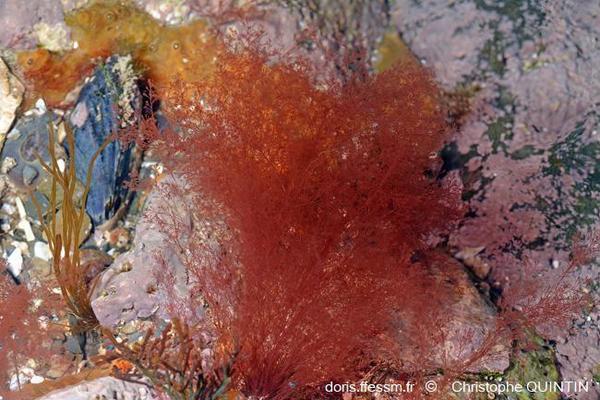
Vue générale du thalle dans une mare
L’espèce présente un habitus (aspect extérieur) relativement caractéristique pour l'œil exercé.
Estran, Plage de l’avant-port, Binic-Etables-sur-mer (22)
12/02/2022
 Algues rouges (Rhodophycées)
Algues rouges (Rhodophycées)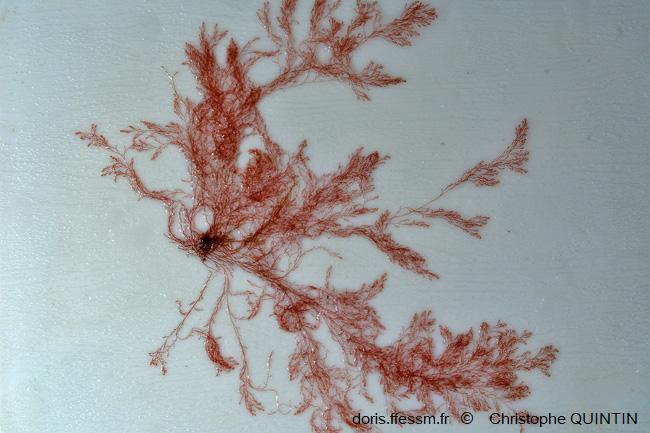
Vue générale du thalle
Les rameaux sont étalés.
Photo ex-situ, Binic-Etables-sur-mer (22)
13/02/2022


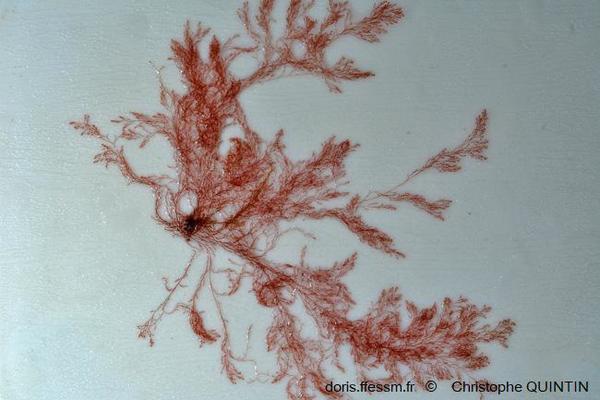
Vue rapprochée
Les rameaux sont étalés pour montrer la disposition particulière de l'extrémité du thalle
Photo ex-situ, Binic-Etables-sur-mer (22)
13/02/2022


Au microscope
Les rameaux sont constitués de 4 cellules périaxiales.
Au microscope (x 100), Photo ex-situ, Binic-Etables-sur-mer (22)
13/02/2022


L''extrémité des rameaux
L’apex des rameaux déterminés est pointu.
Au microscope (x400), Photo ex-situ, Binic-Etables-sur-mer (22)
13/02/2022


Les rameaux
L’apex des rameaux se divise pour former une sorte de corymbe.
Au microscope (x 4), Photo ex-situ, Binic-Etables-sur-mer (22)
13/02/2022


Des trichoblastes
Les
rameaux peuvent parfois porter des trichoblastes vers leurs extrémités.
vue
au microscope d'un échantillon prélevé sur l'estran, Pointe de la Rognouse,
Binic-Etables-sur-mer (22)
04/05/2023


Dans un ouvrage ancien
Quelques aspects de cette espèce.
Okamura K., Icones of Japanese algae, 1913, volume 3, planche CXXVII
Reproduction de documents anciens
1913
Rédacteur principal : Christophe QUINTIN
Vérificateur : Marc VERLAQUE
Responsable régional : Yves MÜLLER
Burel T., Le Duff M., Ar Gall E. 2019, Updated check-list of the seaweeds of the French coasts, Channel and Atlantic Ocean. An aod - les cahiers naturalistes de l’Observatoire marin, 7(1), 1-38.
Cho S.H., Heo S-J.,Yang H.W., Ko E.Y., Jung M.S., Cha S.H. Ahn G., Jeon Y.J., Kim K.N., 2019, Protective Effect of 3-Bromo-4,5-Dihydroxybenzaldehyde from Polysiphonia morrowii Harvey against Hydrogen Peroxide-Induced Oxidative Stress In Vitro and In Vivo, Journal of Microbiology and Biotechnology, 29(8), 1193–1203.
Choi H.G., Kim M.S., Guiry M.D., Saunders G.W., 2001, Phylogenetic relationships of Polysiphonia (Rhodomelaceae,Rhodophyta) and its relatives based onanatomical and nuclear small-subunit rDNA sequence data, Canadian Journal of Botany. 79, 1465-1476.
Choi Y.K., Ye B.R., Kim E.A, Kim J., Kim M.S., Lee W.W., Ahn G.N., Kang N., Jung W.K., Heo S.J., 2018, Bis (3-bromo-4,5-dihydroxybenzyl) ether, a novel bromophenol from the marine red alga Polysiphonia morrowii that suppresses LPS-induced inflammatory response by inhibiting ROS-mediated ERK signaling pathway in RAW 264.7 macrophages, Biomedicine and Pharmacotherapy, 103, 1170-1177.
Dupree A. H., 1953, Science vs. the Military: Dr. James Morrow and the Perry Expedition, Pacific Historical Review, 22(1), 29–37.
Geoffroy A., Le Gall L., Destombe C., 2012, Cryptic introduction of the red alga Polysiphonia morrowii Harvey (Rhodomelaceae, Rhodophyta) in the North Atlantic Ocean highlighted by a DNA barcoding approach, Aquatic Botany, 100, 67-71.
Geoffroy A., Destombe C., Kim B., Mauger S., Raffo M.P., Kim M.S., Le Gall L., 2016, Patterns of genetic diversity of the cryptogenic red alga Polysophonia morrowii (Ceramiales, Rhodophyta) suggest multiple origins of the Atlantic populations, Ecology and Evolution, 6(16), 5635-5647.
Harvey W.H., 1856, Algae in Asa Gray, list of dried plants collected in Japan by S.W. Williams, Esq. And Dr. Morrow, Memoirs of the American Academy of Arts and Sciences, 2, 331–332.
Kang N-J., Han S-C., Kang H-J., Ko G., Yoon W-J., Kang H-K.,Yo E.S., 2017, Anti-Inflammatory Effect of 3-Bromo-4,5-Dihydroxybenzaldehyde, a Component of Polysiphonia morrowii, In Vivo and In Vitro, Toxicological Research, 33(4), 325-332.
Kim M.S., Lee I.K., 1999, Neosiphonia flavimarina gen. et sp. nov. with a taxonomic reassessment of the genus Polysiphonia (Rhodomelaceae, Rhodophyta), Physiological Research, 47, 271-281.
Kim M.S., Lee I.K., Boo S.M., 1994, Morphological studiesof the red alga Polysiphonia morrowii Harvey on the Korean Coast, Korean Journal of Phycology, 9, 185-192.
Kim M.S., Maggs C.A., McIvor L., Guiry M.D., 2000, Reappraisal of the type species of Polysiphonia (Rhodomelaceae, Rhodophyta), European Journal of Phycology, 35, 83-92.
Kim M.S., Yang E.C.,Mansilla A.,Boo S.M., 2004, Recent introduction of Polysiphonia morrowii (Ceramiales, Rhodophyta) to Punta Arenas, Chile, Botanica Marina, 47, 389-394.
Kim S.Y., Kim S.R., Oh M.J., Jung S.J., Kang S.Y., 2011, In vitro Antiviral Activity of Red Alga, Polysiphonia morrowii Extract and ItsBromophenols Against Fish Pathogenic Infectious Hematopoietic Necrosis Virusand Infectious Pancreatic Necrosis Virus, The journal of microbiology, 49(1),102-106.
Kudo T., Masuda M., 1992, Taxonomic features of Polysyphonia morrowii Harvey (Ceramiales, Rhodophyta), Japanese Journal of Phycology, 29, 263-272.
Le Roux A., 2020, Polysiphonia morrowii (Rhodophyta, Ceramiales) dans le golfe du Morbihan (Bretagne sud, France). Phénologie et description de parasporocystes, An Aod, 1-17.
Pangestuti R., Siahaan E.A., Kim S-K., 2018, Photoprotective substances derived from marine algae, Marine drugs, 16, 399.
Piao M.J., Kang H.K.,Yoo E.S., Koh Y.S., Kim D.S., Lee N.H., Hyun J.W., 2012, Photo-protective effect of Polysiphonia morrowii Harvey against ultraviolet B radiation-induced keratinocyte damage,Journal of the Korean Society for Applied Biological Chemistry, 55, 149-158.
Piñeiro-Corbeira C., Maggs C.A., Rindi F., Bunker F., Baldock L. & Díaz-Tapia P., 2020, Molecular assessment of the tribes Streblocladieae and Polysiphonieae (Rhodomelaceae, Rhodophyta) in the British Isles reveals new records and species that require taxonomic revision, Cryptogamie Algologie, 41(8), 55-72.
Raffo M.P., Geoffroy A., Destombe C., Schwindt E., 2014, First record of the invasive red alga Polysiphonia morrowii Harvey (Rhodomelaceae, Rhodophyta) on the Patagonian shores of the Southwestern Atlantic, Botanica Marina, 57, 21-26.
Stuercke B., Freshwater D.W., 2008, Consistency of morphological characters used to delimit Polysiphonia sensu lato species (Ceramiales, Florideophyceae): analyses of North Carolina, USA specimens, Phycologia, 47(6), 541-559.
Verlaque, M., 2001, Checklist of the macroalgae of Thau Lagoon (Hérault, France), a hot spot of marine species introduction in Europe, Oceanologica Acta, 24(1), 29-49.
Verlaque M., Ruitton S., Mineur F., Boudouresque C. F., 2015, CIESM atlas of exotic species in the Mediterranean: 4. Macrophytes (F. Briand édit.), CIESM Publishers, Monaco, 364 p.
La page de Polysiphonia morrowii dans l'Inventaire National du Patrimoine Naturel : INPN
La page sur Polysiphonia morrowii sur le site de référence de DORIS pour les algues : AlgaeBase
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.