Corps cylindrique
Longueur de 14 à 25 mm environ
Translucide
Couleur blanche, avec des mouchetures brun rougeâtre
Yeux petits
Telson arrondi à son extrémité
Hôte des habitats vaseux en estuaire
Vit dans un tube
Lijnpissebed (NL), Dłużnik (Polonais)
Anthura carinata Krøyer, 1847
Anthura brunnea Harger, 1873 in Verrill, Smith & Harger, 1883
Atlantique Nord-Est, Méditerranée et Atlantique Nord-Ouest
Zones DORIS : ● Europe (côtes françaises), ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ○ [Méditerranée française], ● Atlantique Nord-OuestCyathura carinata est présente dans l'Atlantique Nord-Est, de la Norvège à la Méditerranée et dans l'Atlantique Nord-Ouest, du Saint-Laurent à la Floride.
Des observations récentes (2021) confirment sa présence dans les estuaires de la péninsule ibérique, comme dans l'estuaire du Minho (Portugal/Espagne), sans extension significative au-delà des zones déjà connues.
Des observations signalent cette espèce en Afrique du Sud.
Cyathura carinata est une espèce benthique*, fréquemment rencontrée en zone côtière, sur fonds sableux ou sablo-vaseux, voire clairement vaseux. Elle est ainsi une espèce caractéristique des habitats EUNIS* A2.32 (Estrans* vaseux en amont des estuaires dominés par des polychètes ou des oligochètes) et A5.282 (Faciès* avec résurgence d'eau douce à Cerastoderma glaucum et Cyathura carinata). Elle est également une espèce indicatrice des habitats 1130-1 (Slikke* en mer à marées (façade atlantique)) et 1150-2 (lagunes méditerranéennes) des Cahiers d’habitats.
Elle creuse fréquemment des terriers pour s’abriter dans les sédiments meubles.
Outre ces sédiments meubles, l’espèce peut être rencontrée parmi les algues sciaphiles* ou photophiles*.
L’espèce est fortement euryhaline*, puisqu’elle peut vivre dans des milieux allant de l’eau douce à l’eau de mer à salinité normale.
Cyathura carinata est un crustacé isopode au corps allongé et cylindrique, d’une longueur adulte comprise entre 14 et 27 mm, translucide, de couleur blanche, avec des fines ponctuations brun rougeâtre, qui sont en fait des chromatophores*. Ces taches sont plus denses dans la partie antérieure du corps et concentrées dans la partie avant de chaque segment. Le thorax présente des carènes* dorsolatérales. Le corps est d’une largeur pratiquement uniforme, légèrement plus large vers l’arrière, à partir du quatrième segment thoracique.
La tête est dotée d’une paire d’antennules*, plus courtes que la tête, et d’une paire d’antennes*, plus longues que la tête. Les yeux sont relativement petits. Les segments du péréion* sont plus longs que larges. Le premier segment thoracique est le plus long des segments, alors que le septième segment est le plus court.
La première paire de péréiopodes* est large et subchéliforme (presque en forme de pince). Les péréiopodes 4 à 7 sont orientés vers l’arrière, contrairement aux 3 premiers péréiopodes.
Les uropodes* sont composés d’endopodes (rames internes), aussi longs que larges et à l’apex* arrondi, et d’exopodes (rames externes) ovoïdes. Le telson*, presque aussi long que les uropodes, présente une forme arrondie à son extrémité. Il est doté d’une paire de statocystes*.
Tous les isopodes appartenant à la famille des Anthuridés présentent la même allure générale et il faut donc être prudent lors de la détermination.
Dans nos eaux, la confusion la plus immédiate pourra se faire avec Anthura gracilis, doté d’yeux plus gros et chez qui le telson* présente une forme globalement rectangulaire.
Cyathura polita, longtemps confondue avec Cyathura carinata, est l’espèce rencontrée en Atlantique Nord-Ouest.
Cette espèce est détritivore* ou microphage*. Elle se nourrit principalement de matière organique en décomposition et de micro-organismes présents dans les sédiments.
Cyathura carinata présente la particularité d’être une espèce hermaphrodite* protogyne*.
Le cycle de vie de cette espèce a été étudié dans les eaux côtières de la mer Baltique. Cyathura carinata présente un cycle de vie de trois années. Les jeunes individus, nés en été, atteignent la maturité sexuelle la deuxième année. Certains d’entre eux deviennent directement des mâles fonctionnels (mâles primaires), la plupart débutant leur vie sexuelle comme femelles. Certaines de ces femelles deviennent ensuite des mâles (mâles secondaires) après s’être reproduites une à deux fois. Ces mâles secondaires atteignent leur maturité sexuelle au mois de juin de la troisième année, après avoir généralement passé trois stades intermédiaires. Ce cycle de vie très particulier pourrait expliquer les évolutions très marquées du sex-ratio* dans les populations au cours de l’année.
La fécondation* est interne, les mâles transférant directement le sperme* à la femelle via des appendices spécialisés (un stylet copulateur, l’appendix masculina, est présent sur la deuxième paire de pléopodes*). Pour ce faire, les mâles doivent quitter leur terrier et rejoindre les femelles dans leur terrier.
Il existe un dimorphisme* sexuel. Les antennes* des mâles sont plus longues que celles des femelles. La touffe de soies* apicales est nettement plus fournie chez les mâles et constitue donc le principal critère distinctif en période de reproduction. Les fouets antennulaires* des mâles présentent une allure en brosse caractéristique.
Il n’y a pas de stade larvaire* libre (planctonique*). La femelle possède une poche incubatrice ventrale, le marsupium*, formée par des plaques appelées oostégites*. Les œufs y sont incubés jusqu’à éclosion. Les juvéniles ressemblent à des adultes miniatures. Le développement larvaire est synchronisé (tous les embryons sont au même stade de développement dans le marsupium). A leur sortie du marsupium, les jeunes mesurent entre 2 et 3 mm de long.
La durée de vie dans les eaux plus chaudes (Portugal) semble être plus courte, deux ans au maximum, mais avec une maturité sexuelle plus précoce. Une forte mortalité survient à l’issue de la période de reproduction des femelles. L’espèce reste cependant univoltine (une seule reproduction par an), quelle que soit la latitude d’observation.
Dans le bassin d’Arcachon, les premières femelles ovigères* apparaissent à partir de la mi-juin.
Cette espèce peut être parasitée par deux espèces de vers trématodes appartenant à la famille des microphallidés (Maritrema subdolum et Levinseniella sp..ce dernier étant très largement prédominant). Ce parasitisme a été confirmé grâce à l’analyse de séquences d’ARN ribosomique 18S car l’observation des cystes de trématodes nécessite un peu d’attention.
Cyathura carinata n’est qu’un hôte intermédiaire de ces trématodes, les hôtes finaux étant des oiseaux.
Les isopodes parasités voient leurs taux de mortalité s’accroître et leurs capacités reproductives se réduire (les femelles infectées ne se reproduisent quasiment plus).
Les individus qui vivent dans les herbiers de zostères sont davantage contaminés (jusqu’à 90% des individus !) que les individus vivant en zone nue, ceci probablement en raison d’une présence plus abondante de mollusques gastéropodes adultes, comme Peringia ulvae, qui sont les hôtes primaires, dans ces herbiers.
Le pic de contamination se produit en hiver, période où la présence des oiseaux limicoles* dans les estuaires est maximale, ce qui montre une remarquable adaptation du cycle du vie du trématode parasite*.
Cyathura carinata constitue une proie significative pour le flet (Platichthys flesus), constituant 10 % du contenu stomacal d’individus pêchés dans l’estuaire de la Gironde.
Les adultes de Cyathura carinata vivent dans des tubes creusés dans le sédiment. Ils sont peu mobiles, ce qui conduit à la stabilité des peuplements. Les densités couramment rencontrées varient entre 200 et 400 individus par mètre carré, mais on peut parfois rencontrer des densités de plusieurs milliers d’individus par mètre carré.
Susana Margarida de Freitas Ferreira & al. (2004) ont montré que les blooms* de macroalgues (Ulva sp.) dans un estuaire eutrophe* ont un effet marqué sur cette espèce. Ces blooms favorisent dans un premier temps la survie des individus, en leur offrant davantage de refuge et de nourriture, mais dégradent ensuite leur niveau de reproduction, probablement en raison des conditions anoxiques* créées par la dégradation des algues, à la mauvaise période pour Cyathura carinata. La répétition de ces blooms peut donc mettre en péril certaines populations.
Comme chez tous les isopodes, la respiration est principalement assurée par les pléopodes*, qui sont les seuls téguments* perméables chez Cyathura carinata. Les pléopodes ont également une fonction d’osmorégulation, fonction particulièrement importante chez des espèces euryhalines* comme celle-ci. La première paire de pléopodes de Cyathura carinata est élargie et sert d’opercule* à la zone ventrale de l’animal (« chambre respiratoire »). La circulation de l’eau est assurée par un battement synchrone complexe des pléopodes. Les exopodes (rames externes) des pléopodes possèdent une cuticule* plus épaisse et assurent la circulation de l’eau et les échanges gazeux (respiration). Les endopodes (rames internes) quant à eux ont une cuticule plus fine et assurent l’osmorégulation. L’épithélium* des endopodes présente, à l’apex* des cellules, de très nombreuses invaginations qui accroissent la surface d’échange. L’hémolymphe circule dans les pléopodes dans le sens opposé au sens de circulation de l’eau, ce qui favorise les échanges gazeux.
Cyathura carinata est sensible aux pollutions par les métaux, comme de nombreux autres crustacés. L’espèce est ainsi totalement absente de l’estuaire du Fal (Cornouaille, Royaume-Uni), fortement touché par ce type de pollution en raison d’activités minières passées.
Les études menées par M.D. Bordalo & al. dans l’estuaire du Mondego (Portugal) ont montré que, dans cet estuaire, les températures élevées ont un effet délétère marqué. Ces études ont par ailleurs démontré, de manière surprenante, que les herbiers à Zostera noltii nouvellement implantés (effet des efforts de réduction de pollution sur ce fleuve) attiraient Cyathura carinata (alors que cette espèce a plutôt tendance à déserter les herbiers anciens) mais que, de façon surprenante, les individus présents dans ces herbiers nouveaux résistaient moins bien aux stress environnementaux (en particulier aux températures élevées) que les individus présents dans les biotopes nus.
Les expérimentations récentes (2019) conduites par Mercedes Conradi & al. ont démontré que Cyathura carinata pouvait être sensible à l'acidification des océans due aux fuites de dioxyde de carbone ou au changement climatique. Une diminution du pH (induite par une augmentation de la concentration en dioxyde de carbone) affecte la survie, le développement et les taux d'alimentation des individus. Cet effet varie selon les populations, celles soumises naturellement à des variations de pH étant plus résistantes. Cette sensibilité pourrait aggraver les impacts des blooms* algueux et des conditions anoxiques* dans les estuaires eutrophes*
Cyathure carénée :
simple francisation du nom scientifique.
Le nom de genre Cyathura provient du latin [cyathus] = coupe et du grec [uraeo] = queue, donc queue en forme de coupe. Ce genre a été créé en 1886 par Alfred Merle Norman (1831-1918), un homme du clergé britannique, zoologiste émérite, et Thomas Roscoe Rede Stebbing (1835-1926), carcinologue britannique, par référence à la courbure particulière des uropodes.
Le nom d’espèce carinata provient du latin [carinata] = à carène, caréné, par référence aux carènes ornant le thorax de cette espèce. Ce nom d'espèce a été donné par le zoologiste danois Henrik Nicolaj Krøyer (1799-1870).
Numéro d'entrée WoRMS : 118474
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Arthropoda | Arthropodes | Animaux invertébrés au corps segmenté, articulé, pourvu d’appendices articulés, et couvert d’une cuticule rigide constituant leur exosquelette. |
| Sous-embranchement | Crustacea | Crustacés | Arthropodes à exosquelette chitineux, souvent imprégné de carbonate de calcium, ayant deux paires d'antennes. |
| Super classe | Multicrustacea | ||
| Classe | Malacostraca | Malacostracés | 8 segments thoraciques, 6 segments abdominaux. Appendices présents sur le thorax et l’abdomen. |
| Sous-classe | Eumalacostraca | Eumalacostracés | Présence d’une carapace recouvrant la tête et tout ou partie du thorax. |
| Super ordre | Peracarida | Péracarides | Les femelles sont dotées d'une cavité d'incubation formée par des expansions lamelleuses des péréiopodes. |
| Ordre | Isopoda | Isopodes | Corps comprimé dorso-ventralement, première paire d’antennes beaucoup plus petite que la seconde, yeux non pédonculés. 7 paires de pattes de même apparence. |
| Sous-ordre | Cymothoida | Cymothoides | ils portent des appendices buccaux comprenant une mandibule et un processus permettant de couper. |
| Super-famille | Anthuroidea | ||
| Famille | Anthuridae | Anthuridés | |
| Genre | Cyathura | ||
| Espèce | carinata |
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Allure générale
La fine ponctuation qui orne le corps est une bonne méthode d’identification de l’espèce. On note la forme particulière de la première paire de péréiopodes*, nettement plus grosse que les autres péréiopodes. On note également le changement d’orientation des péréiopodes 4 à 7 par rapport aux péréiopodes 1 à 3.
Estran, Pornichet (44) océan Atlantique Est.
16/05/2021
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Vue de la tête et des premiers segments thoraciques.
Les yeux, de petite taille, sont bien visibles. Le premier segment thoracique est le plus long du corps.
Estran, Pornichet (44), océan Atlantique Est.
16/05/2021

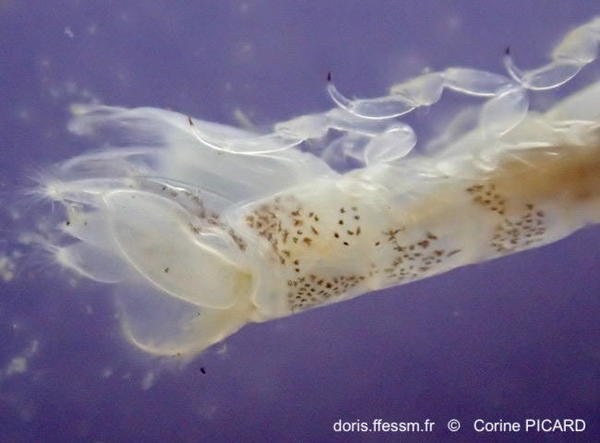
Vue rapprochée de la queue
On voit ici les exopodes (au premier plan) et les endopodes (derrière) des uropodes*.
Estran, Pornichet (44), océan Atlantique Est.
16/05/2021


Appendices (péréiopodes 2 à 6, les péréiopodes 1 étant à peine visibles à gauche)
La carène dorso-latérale est ici bien visible.
Estran, Pornichet (44),océan Atlantique Est.
16/05/2021
Rédacteur principal : Christophe QUINTIN
Vérificateur : Pierre NOËL
Responsable régional : Yves MÜLLER
Amanieu M., 1969, Variations saisonnières de la taille et cycle reproducteur à Arcachon de Cyathura carinata (Kröyer), Journal of Experimental Marine Biology and Ecology, 4(1), 79–89.
Bamber R. N., 1985, The Autecology of Cyathura carinata (Crustacea: Isopoda) in a Cooling Water Discharge Lagoon, Journal of the Marine Biological Association of the United Kingdom, 65(01), 181-194
Barnard K. H., 1925, A Revision of the Family Anthuridae (Crustacea Isopoda), with Remarks on certain Morphological Peculiarities, Journal of the Linnean Society of London, Zoology, 36(241), 109–160.
Bordalo M. D., F. Ferreira S. M., Cardoso P. G., Leston S.,PardalM. A., 2011, Resilience of an isopod population (Cyathura carinata) to multiple stress factors in a temperate estuarine system, Hydrobiologia, 671, 13–25
Cléret J-J., 1960, Etude de Cyathura carinata (Krøyer) (Isopode, Anthuridae), I. Redescription de l'espèce et discussion systématique, Cahiers de Biologie Marine, 1, 433-452.
Conradi M., Sánchez-Moyano J.E., Bhuiyan M.K.A., Rodríguez-Romero A., Galotti A., Basallote M.D., DelValls A., Parra G., Riba I., 2019, Intraspecific variation in the response of the estuarine European isopod Cyathura carinata (Krøyer, 1847) to ocean acidification, Science of The Total Environment, 683, 134-145,
Cruz S., Marques J.C., Gamito S., Martins I., 2003, Autoecology of the isopod Cyathura carinata (Krøyer, 1847) in the Ria Formosa (Algarve, Portugal), Crustaceana, 76 (7), 781-802.
Cruz S, 2015, Models test in the evaluation of Cyathura carinata growth, International Journal of Ecology and Ecosolution, 2(1), 7-16.
Dauvin J.C., 2008, Effects of heavy metal contamination on the microbenthic fauna in estuaries: The case of the Seine estuary, Marine Pollution Bulletin, 57, 160–169.
Ferreira S. M., Brandão A., Baeta A., Neto J. M., Lillebø A. I., Jensen K. T., Pardal M. A., 2006, Effects of restoration management on the estuarine isopod Cyathura carinata: mediation by trematodes and habitat change, Marine Biology, 151(1), 109–118.
Ferreira S.M., Jensen K.T.,Martins PA., Sousa S.F., Marques J.C., Pardal M.A., 2005, Impact of microphallid trematodes on the survivorship, growth, and reproduction of an isopod (Cyathura carinata), Journal of Experimental Marine Biology and Ecology, 318, 191–199.
Ferreira S.M., Pardal M.A., Lillebø A.I., Cardoso P.G., Marques J.C., 2004, Population dynamics of Cyathura carinata (Isopoda) in a eutrophic temperate estuary, Estuarine, Coastal and Shelf Science, 61 (4), 669-677.
Gomes N., Costa D., Cantallo
H. Ribeiro T., Antunes C., 2021, Isopods (Crustacea, Malacostraca) from
International Minho River, Iberian Peninsula, Oceanography &
Fisheries Open access Journal, 13(5), 555866.
Hinrich J., Schulenburg G. V., Wägele J.-W., 1998, Molecular characterisation of digenetic trematodes associated with Cyathura carinata (Crustacea: Isopoda) with a note on the utility of 18S ribosomal DNA for phylogenetic analysis in the Digenea (Platyhelminthes: Trematoda), International Journal for Parasitology, 28(9), 1425–1428.
Jensen K.T., Ferreira S.M., Pardal M.A., 2004, Trematodes in a Cyathura carinata population from a temperate intertidal estuary: infection patterns and impact on host, Journal of the Marine Biological Association of United Kingdom, 84, 4647/1-8.
Jesus T.B. de, Mendes S., Guedes B., Quintas P., Sobral P., 2021,
Isopods (Crustacea, Malacostraca) from International Minho River Estuary,
Iberian Peninsula, Oceanography & Fisheries Open Access Journal,
13(5), 555866.
Krøyer H., 1847, Karcinologiste Bidrag (Fortsaettelse), Naturhistorisk Tidsskrift Ser. II. 2(4), 366-446.
Legrand E., Riera P., Bohner O., Cuvillier-Hot V., Théron M., 2019, Intraspecific variation in the response of the estuarine European isopod Cyathura carinata (Krøyer, 1847) to ocean acidification, Marine Pollution Bulletin, 142, 549-557.
Marques J.C., Martins I., Teles-Ferreira C., Cruz S., 1994, Population dynamics, life history, and production of Cyathura carinata (Krøyer) (Isopoda : Anthuridae) in the Mondego Estuary Portugal, Journal of Crustacean Biology, 14(2), 258–272.
Martins I., Marques J. C., Jørgensen S. E.,Nielsen S. N., 1997, Modelling the effects of green macroalgae blooms on the population dynamics of Cyathura carinata (Crustacea: Isopoda) in an eutrophied estuary, Ecological Modelling, 102(1), 33–53.
Miller M.A., Burbank W.D., 1961, Systematics and distribution of an estuarine isopod crustacean, Cyathura polita (Stimpson, 1855), new comb., from the Gulf and Atlantic seaboard of the United States, The Biological Bulletin, 120, 62-84.
Norman A.M., Stebbing T.R.R., 1886, V On the Crustacea Isopoda of the ‘Lightning', ‘Porcupine', and ‘Valorous' Expeditions Part I.- Apseudidae, Tanaidae, Anthuridae, Transactions of the Zoological Society of London, 12 (4), 77-141.
Ólafsson E. B., Persson L.-E., 1986, Distribution, life cycle and demography in a brackish water population of the isopod Cyathura carinata (Kröyer) (Crustacea), Estuarine, Coastal and Shelf Science, 23(5), 673–687.
Pasquaud, S., Elie, P., Jeantet, C., Billy, I., Martinez, P., Girardin, M., 2008, A preliminary investigation of the fish food web in the Gironde estuary, France, using dietary and stable isotope analyses, Estuarine, Coastal and Shelf Science, 78(2), 267–279.
Reimer L., 1963, Zur Verbreitung der Adulti und Larvenstadien der Familie Microphallidae Viana, 1924 (Trematoda, Digenea) in der mittleren Ostsee, Zeitschrift für Parasitenkunde, 23, 253–273.
Schulenburg J.H.G., Wägele J.W., 1998, Molecular characterisation of digenetic trematodes associated with Cyathura carinata (Crustacea: Isopoda) with a note on the utility of 07S ribosomal DNA for phylogenetic analysis in the Digenea (Platyhelminthes: Trematoda), International Journal for Parasitology, 28, 125-142.
Wägele J. W., 1979, Der Fortpflanzungszyklus von Cyathura carinata (Isopoda, Anthuridea) im Nord-Ostsee-Kanal, Helgoländer Wissenschaftliche Meeresuntersuchungen, 32(3), 295–304.
Wägele J.W., 1982, Ultrastructure of the pleopods of the estuarine isopod Cyathura carinata (Crustacea: Isopoda: Anthuridae), Zoomorphology, 101, 215-226.
Warwick R.M., 2001, Evidence for the Effects of Metal Contamination on the Intertidal Macrobenthic Assemblages of the Fal Estuary, Marine Pollution Bulletin, 42 (2), 145-148.
La page de Cyathura carinata dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.