Corps long et étroit, rouge orange, tout rouge, ou jaune rougeâtre avec des taches rouge pourpre, ventre plus clair
Manteau cylindrique étroit, 20 à 25 cm de longueur en moyenne
Nageoires courtes en forme de cœur un peu évasé
Tête entourée de 8 bras avec 2 rangées de ventouses et 2 tentacules rétractiles
Extrémité des 2 tentacules en forme de massue avec 8 rangées longitudinales de petites ventouses
2 gros yeux
Encornet rouge, faux encornet, calamar rouge, pisseur, calmar illex, encornet illex, chipiron
Southern shortfin squid, broad-tail shortfin squid, broadtail shortfin squid (GB), totano, totano volatore, tutariello, calamaro seatta, todaro (I), volador (E), Roter Kalmar, Kurzflossiger Kalmar, BreitschwanzKurzflossenkalmar, Pfeilkalmar (D), pota voladora, pota-do-note (P), kokkino, thrapsalo (Grec),
Loligo brongniartii Blainville, 1823
Loligo coindetii Vérany, 1839
Loligo pillae Vérany, 1851
Loligo sagittata Vérany, 1851
Illex illecebrosus Steenstrup, 1880
Illex illecebrosus coindetii Pfeffer, 1912
Mer du Nord, Atlantique Est et Ouest, Méditerranée
Zones DORIS : ● Europe (côtes françaises), ○ [Méditerranée française], ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ● Atlantique Nord-Ouest, ● CaraïbesCette espèce a une large
répartition. Elle est présente des deux côtés de l’Atlantique et en
Méditerranée. Dans l’Atlantique Nord-Est, elle est pêchée des côtes norvégiennes
(60°N) et écossaises jusqu’aux côtes namibiennes (18°S). Dans l’Atlantique Nord-Ouest, elle est observée des côtes de la Virginie (37°N) jusqu’aux côtes de la Guyane
(3°N).
Le calmar rouge est une espèce démersale* fréquentant la zone néritique* sur les côtes subtropicales et tempérées qui vit sur le plateau continental et sur le talus entre la surface et plus de 1 000 mètres de profondeur avec des concentrations maximales comprises entre 50 et 100 m et 400 à 600 m, selon la situation géographique.
En mer Méditerranée, les concentrations maximales se situent entre 60 et 400 m, dans l'Atlantique Est de 150 à 300 m, dans l'Atlantique Ouest de 200 à 600 m et dans la mer des Caraïbes de 180 à 450 m.
Ces calmars sont difficilement observables par les plongeurs sauf lorsqu'ils se rapprochent des côtes.
Cette espèce préfère les fonds vaseux et sableux, riches en débris notamment lorsqu'ils sont couverts par le cnidaire Funiculina spp. (cnidaire, pennatules) et fréquentés par la crevette rose du large (Parapenaeus longirostris), le merlu commun (Merluccius merluccius), le merlan bleu ou poutassou (Micromesistius poutassou) et le calmar Todaropsis eblanae et également avec le poulpe blanc Eledone cirrhosa) et le casseron bambou (Alloteuthis media).
Les juvéniles et les adultes partagent la même zone de profondeur dans la plupart des aires méditerranéennes mais les juvéniles sont en plus grande concentration dans des eaux peu profondes (50-200 m) en évitant les zones côtières (< à 50 m). Les adultes migrent verticalement vers le haut la nuit tout en restant sous la thermocline*.
Illex coindetii est un calmar de taille moyenne, les femelles étant généralement plus grandes que les mâles. La longueur du manteau* est la mesure de longueur utilisée chez ces animaux (la tête et les tentacules* ne sont pas pris en compte dans cette mesure). Cette longueur du manteau est en général comprise entre 20 et 25 cm mais des individus de 38 cm (femelles) et 28 cm (mâles) ont été observés.
Le manteau cylindrique est long et étroit, plus large à l’extrémité antérieure, la queue est pointue. Les nageoires disposées à l’extrémité du manteau forment un cœur un peu évasé (l'extrémité postérieure apparaît ainsi pointue) mesurent 35 % de la longueur du manteau. La tête est large et robuste (avec deux grands yeux argentés). Le siphon*, en forme d'entonnoir, présente un sillon lisse.
Les calmars possèdent 8 bras disposés en couronne autour de la bouche et 2 tentacules pour la capture des proies. Chez Illex coindetii les 8 bras sont relativement longs et robustes. Ils portent une double rangée de ventouses. Chez le mâle, un des bras ventralux (gauche ou droit) est transformé pour la reproduction (bras hectocotyle*). Les 2 tentacules (visibles quand l'animal chasse ou quand il est mort) ont une extrémité terminée en massue. Seule cette extrémité porte de petites ventouses disposées en 8 rangées longitudinales. C’est une caractéristique du genre Illex car les autres Ommastrephidés n’ont que 4 rangées de ventouses à cet endroit.
Le corps est rouge orange, voire tout rouge, ou jaune rougeâtre avec des taches rouge pourpre. Le ventre est plus clair.
Il existe quatre espèces dans le genre Illex dont trois sont présentes dans l’Atlantique Nord.
Illex coindetii présente de nombreuses variations morphologiques et la détermination précise est basée sur les proportions de différentes parties du bras hectocotyle* de la tête et du manteau*. Toutefois, Illex coindetii est la seule espèce de ce genre en Méditerranée et dans l’Atlantique Est.
En général, les calmars sont des prédateurs opportunistes à nage rapide. Les calmars, comme tous les céphalopodes, possèdent un bec corné (ressemblant à un bec de perroquet) et une radula*. Leurs glandes salivaires produisent des neurotoxines* pour paralyser leur proie. Les calmars mettent en pièces leur proie avec leur bec corné. La radula ne sert qu'à convoyer la nourriture.
Illex coindetii se nourrit de poissons, de crustacés et de céphalopodes (par ordre décroissant d’importance). Tout dépend de l’abondance et de la disponibilité des proies dans l’environnement. La taille des calmars influence également la taille des captures.
Les petits calmars juvéniles ont un régime alimentaire plus riche en euphausides (comme Meganyctiphanes norvegica ) ce qui indique une alimentation pélagique*, tandis que les calmars adultes capturent des espèces pélagiques tels des poissons de la famille des Myctophidés (comme Lampanyctus crocodilus), des anchois Engraulis encrasicholus, le brossé améthyste ou maurolique de Müller (Maurolicus muelleri), des Clupéidés (harengs, sardines, ..), des Gadidés (la proie la plus importante est le merlan bleu, Micromesistius poutassou), des Scombridés comme le maquereau commun (Scomber scombrus), le maquereau espagnol (Scomber colias) et d’autres céphalopodes Loligo, Alloteuthis sp, Illex coindetii, Todaropsis eblanae, Sepia et des organismes benthiques* comme des crustacés Amphipodes, des Euphausiacés (Thysanopoda), des décapodes comme la sivade blanche (Pasiphaea sivado) et de petits Soléidés (Microchirus).
La présence d’organismes benthiques et pélagiques dans l’estomac des adultes suggère qu’ils vivent près du fond pendant la journée et que la nuit, ils migrent verticalement dans la colonne d’eau où ils se nourrissent de myctophidés, d’autres poissons et céphalopodes pélagiques.
Le cannibalisme est courant surtout lors des fortes concentrations de cette espèce.
Les sexes sont séparés (organisme gonochorique*) et les individus ne se reproduisent qu'une fois dans leur vie (organisme semelpare*). La croissance est plus rapide chez les femelles que les mâles. Les mâles matures sont plus lourds que les femelles et ils se distinguent seulement par des bras et des têtes plus robustes.
Chez les calmars, trois différents modes d'accouplement sont connus. Pour I. coindetii, le mâle s'approche de la femelle du côté ventral et l'enlace autour du manteau* pour fixer les spermatophores* dans la cavité palléale* (position « tête-manteau »).
Ces accouplements ont en commun un caractère plus ou moins agressif, tournant souvent à la violence.
Les spermatozoïdes* sont enfermés dans une structure très élaborée, le spermatophore. Ce spermatophore est un tube chitineux* étroit que le mâle transmet à la femelle au moyen d’un tentacule modifié, l’hectocotyle*. Un mâle possède de nombreux spermatophores qu'il insère dans le manteau de la femelle lors de l'accouplement.
Les spermatophores éclatent probablement au moment de la sortie des ovules, puisqu'ils sont toujours trouvés intacts sur la femelle avant la ponte. Les ovules sont fécondés à leur sortie de l'orifice génital. A ce moment, les spermatophores se vident de leurs spermatozoïdes. La fécondation est interne.
Les femelles d’I. coindetii présentent des périodes de pontes prolongées, allant de quelques jours à plusieurs semaines. Des pics saisonniers variables dépendent des localités : en Méditerranée plutôt au printemps et en automne alors que dans l’Atlantique Nord-Est c’est un pic estival qui a été observé. La température de l’eau serait le principal facteur influençant la reproduction. La reproduction (le frai*) est la phase terminale du cycle de vie.
Par des mesures sur les statolithes* (concrétions calcaires paires situées dans la tête, présentant des stries d’accroissement), la durée de vie des individus est estimée à 13 mois pour les mâles et 15 mois pour les femelles.
Comme les autres Ommastrephidés, le genre Illex produit les plus petits œufs (0,8 x 1,3 mm) de céphalopodes. Le développement embryonnaire* de cette espèce nécessite des températures comprises entre 13 et 17 °C.
Les œufs d’Illex coindetii (et certainement ceux d’autres espèces de cette famille) sont pondus dans une enveloppe sphérique gélatineuse de 0,5 à 1 m de diamètre (appelée Grande Sphère Transparente, ou G.S.T. dans DORIS) dont la flottabilité est neutre. Cette sphère présente une structure plus ou moins colorée et cylindrique la traversant de part en part. Cette sphère est constituée d’une sécrétion muqueuse produite par les glandes nidamentaires de la femelle. Cette sécrétion se gonfle d’eau lorsqu’elle est produite. Les œufs riches en vitellus* sont de petite taille (0,8-1,3 mm) et les embryons sont contenus dans cette enveloppe de protection pendant quelques temps. Le développement embryonnaire (sans métamorphose) est très rapide : une à deux semaines.
La sphère semble se désagréger assez rapidement. Les jeunes sécrètent une enzyme* pour dissoudre le mucus afin de se libérer.
L’identification de l’espèce a été faite à partir du séquençage de l’A.D.N. (le support de l'information génétique, l'Acide Désoxyribo Nucléïque) pour des échantillons récoltés dans le nord de l’Europe (des prélèvements sont souhaités pour la Méditerranée pour confirmer qu'il s'agit bien de la même espèce, ce qui est probable puisqu'I. coindetii est la seule espèce du genre présente en Méditerranée et en Atlantique Est).
Une première sphère a été observée près de Naples par Naef en 1921. Mais c’est la plongée sous-marine qui est à l’origine de plus nombreuses observations et ce sont surtout les techniques de séquençage de l’A.D.N. qui ont permis de relier ces observations aux organismes producteurs. Ces sphères sont probablement trop volumineuses et trop délicates pour être capturées par un filet à plancton.
Chez les céphalopodes, le développement est direct et c’est un jeune céphalopode qui éclot. Toutefois chez les Ommastrephidés, le développement n’est pas totalement achevé. Le jeune, ou paralarve, est très particulier, il est appelé rhynchoteuthion.
Les rhynchoteuthions mesurent moins de 2 mm de longueur totale et n'ont que deux paires de bras avec une trompe (ou proboscis*), qui se divise plus tard pour former les tentacules chez les adultes. Les rhynchoteuthions sont très difficiles à identifier au niveau des espèces, en particulier lorsque plusieurs espèces coexistent dans la même zone.
Les individus nouvellement éclos sont décrits comme des nageurs actifs ; ils utilisent une propulsion à réaction typique des paralarves de céphalopodes planctoniques, adoptant une position oblique tête en bas.
Ces rhynchoteuthions, en attendant d’avoir des tentacules fonctionnels, se nourriraient en utilisant un mucus collant pour capturer des micro-organismes (dinoflagellés, flagellés, ciliés, cystes, bactéries, copépodes) et leur proboscis jouerait un rôle important dans l’ingestion de ce mucus.
Illex coindetii cette espèce st présente sur des fonds sableux et vaseux couverts de Funiculina sp, avec des astérides et des ophiurides souvent associés à des poissons et des crustacés ciblés par la pêche commerciale comme la crevette gambe géante (Aristaeomorpha foliacea), la crevette rose des eaux profondes (Parapeneus longirostris), la langoustine (Nephrops norvegicus ), le merlu européen (Merluccius merluccius) et le merlan bleu (Micromesistious poutassou), Lophius sp., l’argentine (Argentina sphyraenas) et avec le petit calmar volant (Todaropsis eblanae) et occasionnellement avec Todarodes sagittatus.
Comme tous les animaux sauvages, les calmars rouges sont des hôtes intermédiaires ou définitifs de parasites :
Les calmars, comme les seiches, possèdent deux façons de se déplacer.
Lors de leur fuite en arrière, les calmars (ainsi que les seiches et les poulpes) peuvent éjecter un nuage d’encre afin de perturber ou leurrer l’agresseur.
Les calmars, comme les seiches et les poulpes, peuvent modifier leurs couleurs grâce à différentes cellules pigmentées : les chromatophores*.
La rigidité du corps est en partie assurée par une mince lame cornée transparente presque toute droite et un peu dilatée à la partie supérieure, la plume (ou gladius). Cette structure correspond à une coquille régressée à l'état d'une lamelle chitineuse*.
Les calmars adultes sont connus pour effectuer des migrations verticales diurnes dans la colonne d'eau, depuis la proximité du fond marin pendant les heures de clarté jusqu'à juste près de la surface la nuit.
Illex coindetii ne monte pas jusqu’à la surface, cette espèce reste dans les couches de 20 à 30 mètres de profondeur.
La répartition et l'abondance d'I. coindetii dans certaines zones semblent être influencées par des conditions hydrographiques particulières.
Cette espèce, comme tous les calmars, est comestible et fait l'objet d'une pêche importante surtout en Méditerranée. Sa capture, au chalut de fond, au trémail, aux filets maillants, à la senne et à la ligne avec un leurre métallique plombé en forme de poisson (appelé jig) est essentiellement accessoire en même temps que d'autres organismes. Illex coindetii est commercialisée avec Todaropsis eblanae et occasionnellement avec Todarodes sagittatus.
Les céphalopodes ont tendance à concentrer rapidement les métaux lourds (ou éléments traces métalliques) et autres substances toxiques dans leurs tissus, ce qui joue un rôle important dans la bioaccumulation* de ces polluants chez les prédateurs marins et a des implications pour la consommation humaine. Des niveaux élevés de cadmium et de mercure sont souvent enregistrés uniquement dans la glande digestive (qui ne se consomme pas). Il n’y a aucune accumulation de métaux dans les tissus musculaires (le manteau qui se mange).
Les calmars possèdent des axones (fibres nerveuses des neurones) géants qui peuvent avoir un diamètre de 1,5 mm. Ces axones permettent une transmission de l’information nerveuse optimale et rapide aux muscles, ce qui permet une locomotion performante.
Ces axones géants ont été observés par L.W. Williams en 1909 et redécouverts par J.Z. Young en 1939. Cette caractéristique particulière a permis l'étude du fonctionnement des messages nerveux par sir A. Huxley et sir A. Hodgkin (tous les deux prix Nobel en 1963 pour ces travaux).
Par l’étude des contenus stomacaux, il apparaît qu'Illex coindetii est la proie d'une grande variété de prédateurs :
Pendant plusieurs années, Illex coindetii (au départ considérée comme uniquement méditerranéenne) a été présentée comme une sous-espèce de Illex illecebrosus. Mais I. coindetii a ensuite été observée dans l'Atlantique Nord-Est. Ce n'est qu'en 1969 que la situation a été clarifiée avec la distribution actuelle de ces espèces. (cf. espèces ressemblantes).
Les calmars sont répartis dans deux ordres : les Myopsides et les Oegopsides, selon la présence (Myopsides) ou l’absence (Oegopsides) d’une membrane cornéenne transparente couvrant l’œil. Les Ommastrephidés sont des Oegopsides.
Cette espèce est inscrite depuis 2014 sous le statut LC (préoccupation mineure) dans la liste rouge de l'UICN*
Calamar : du latin [calamus] = calame, roseau. La plume (ou gladius) étant comme le roseau taillé pour l'écriture dans l'Antiquité. Ce terme est, de nos jours, davantage utilisé sur les étalages des poissonniers et en gastronomie, calmar serait l'appellation utilisée par les naturalistes.
Encornet : nom littéral qui exprime la forme du manteau*,
Illex: : du latin [Illex]= séducteur, attractif, appât. Les pêcheurs utilisent les calmars comme appâts. Ce nom de genre a été créé en 1880 par le zoologiste danois Japetus Steenstrup (1813-1897). (Illex est le nom d'une marque d'articles de pêche dont des leurres !)
coindetii : dédié au docteur Jean-François Coindet (1774-1834), médecin chercheur de Genève vivant à Nice, ami de Jean Baptiste Vérany (1800-1865), spécialiste niçois des céphalopodes. Ce nom d'espèce a été créé en 1839.
Numéro d'entrée WoRMS : 140621
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Cephalopoda | Céphalopodes | Yeux complexes, coquille interne, externe cloisonnée ou absente, cavité palléale musclée, siphon musculeux, tentacules ou bras (munis de ventouses). |
| Sous-classe | Coleoidea | Coléoïdes | Ventouses sur les bras, au nombre de 8 au moins. Bras hectocotyle chez le mâle pour le transfert des spermatophores. 2 branchies, 2 néphridies, une coquille interne ou vestigiale, des chromatophores, une poche à encre, un grand cerveau. |
| Super ordre | Decapodiformes | Décapodiformes / Decabrachia | Céphalopodes à 8 bras et 2 tentacules de chasse. |
| Ordre | Oegopsida | Oegopsides | Calmars ne possédant pas de membrane cornéenne transparente recouvrant l'œil. Les bras et les tentacules portent des ventouses et/ou des crochets. Cet ordre comprend la plupart des calmars pélagiques et profonds (25 familles). |
| Famille | Ommastrephidae | Ommastrephides | Calmars présents dans tous les océans souvent en profondeur. Certaines espèces peuvent mesurer couramment jusqu'à 1 m de longueur (voire beaucoup plus : Architeuthis). Les nageoires sont en forme de cœur ou rhomboïdales. Les bras portent 2 rangées de ventouses et les massues tentaculaires en ont 4 rangées (sauf le genre Illex qui en a 8). Les ventouses des séries médianes des massues tentaculaires sont plus grandes que celles des séries marginales. 1 ou 2 bras ventraux peuvent être modifiés chez le mâle adulte (bras hectocotyles). |
| Genre | Illex | ||
| Espèce | coindetii |
 Céphalopodes
Céphalopodes

Prise amateur
En haut à droite les nageoires forment un cœur. Les 8 bras sont bien visibles mais pas les tentacules de chasse qui sont rétractés. Le manteau est cylindrique.
Le calmar rouge fait l'objet d'une pêche amateur à l'entrée de l'hiver (d'octobre à janvier). Il est capturé à la turlutte de nuit.
Baie de Toulon (83), de nuit
11/2019
 Céphalopodes
Céphalopodes

Grand calmar rouge pêché de nuit
Le manteau* de ce "pisseur" mesure environ 35 cm et la longueur hors tout environ 60 cm.
L'œil (sans cornée) est visible.
Baie de Toulon (83), capture de pêche amateur, de nuit
10/2019
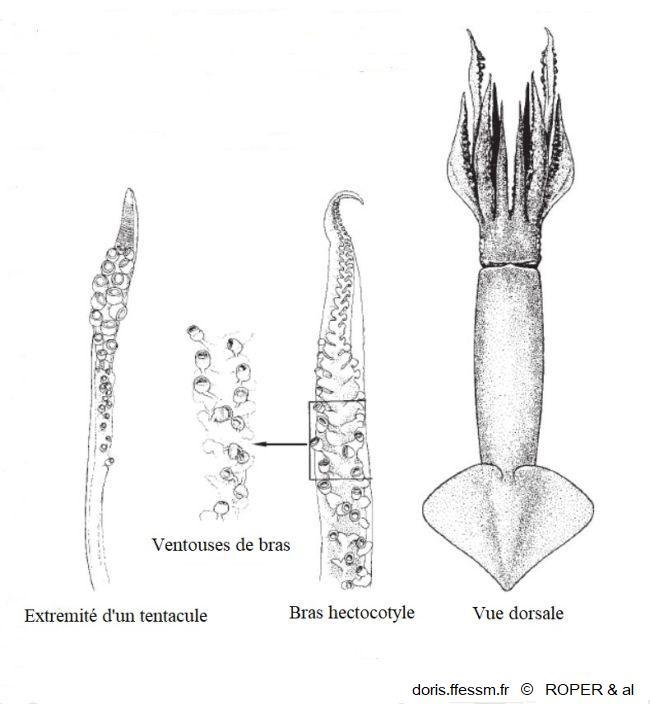
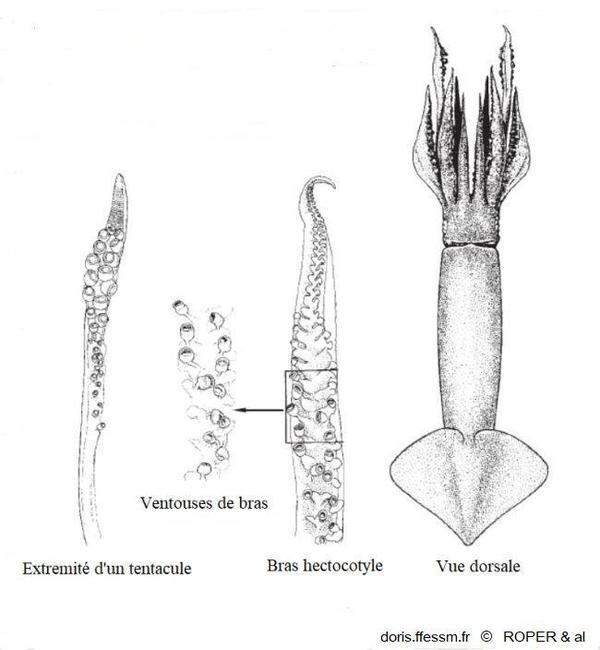
Morphologie
A droite, une vue dorsale d'ensemble de l'animal, au milieu un détail du bras hectocotyle* et à gauche l'extrémité en massue d'un des tentacules de chasse.
fig 286 p 290 de Jereb, Roper & al 2010
Reproduction de documents anciens
2010


Illex coindetii et sa plume
Vue dorsale du calmar avec à gauche un dessin de la "plume" ou gladius. Les deux tentacules sont placés en extension.
planche 36, fig a et c, Vérany 1851.
Reproduction de documents anciens
1851
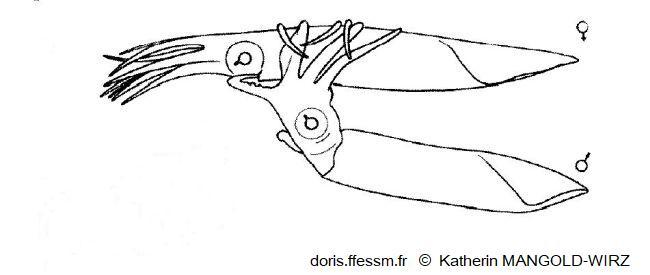
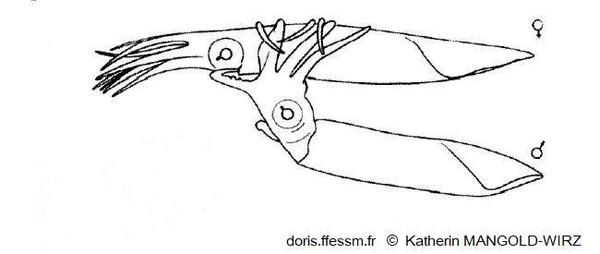
Accouplement chez Illex coindetii
Le mâle (en bas) s'approche de la femelle du côté ventral et l'enlace autour du manteau* (position « tête-manteau »).
Le bras hectocotyle* est glissé dans la cavité palléale* de la femelle pour déposer les spermatophores*.
Dessin de K. Mangold-Wirz 1963, figure 4 page 199
Reproduction de documents anciens
1963
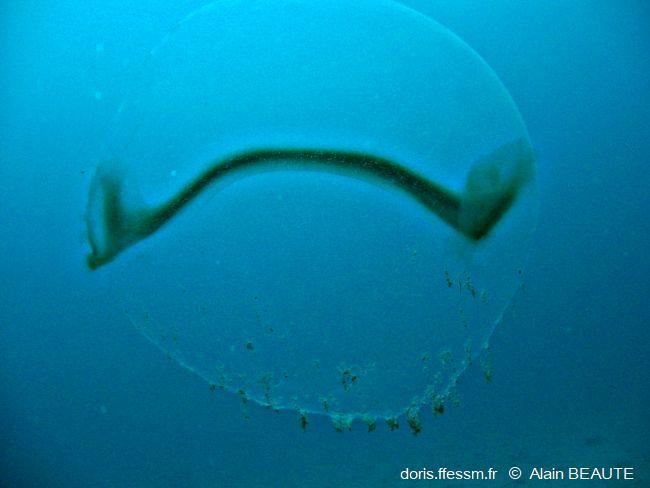
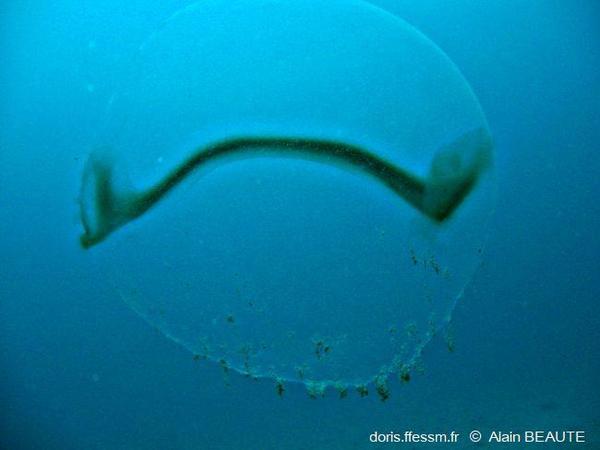
Grande Sphère Transparente
Cette structure de près de 1 m de diamètre a été énigmatique quelque temps. Les œufs et les embryons sont contenus dans cette enveloppe de protection.
Castelviel, Cassis (13), 45 m
22/08/2009
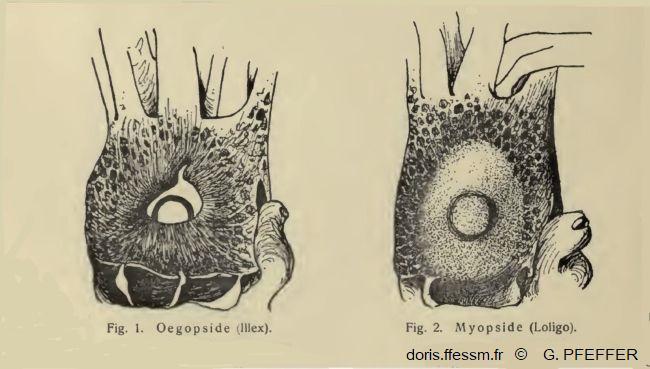
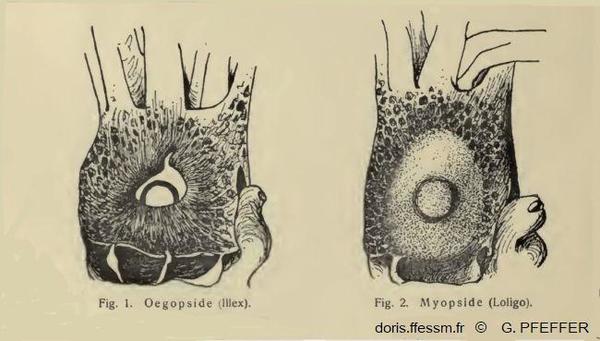
Comparaison de l'œil chez les Myopsides et les Œgopsides
Fig. 1 : Tête de Illex vue du côté droit, l'œil n'est pas recouvert d'une membrane cornéenne transparente. Ordre des Œgopsides.
Fig. 2 : Tête de Loligo vue du côté droit, l'œil est recouvert d'une membrane cornéenne transparente. Ordre des Myopsides.
Les calmars sont répartis dans deux ordres : les Myopsides et les Œgopsides, selon la présence ou l’absence d’une membrane cornéenne transparente couvrant l’œil. Les Loliginidés sont des Myopsides.
D'après deux dessins de G. Pfeffer 1901, IV, page 10.
Reproduction de documents anciens
1901
Rédacteur principal : Yves MÜLLER
Vérificateur : Michel PEAN
Responsable régional : Yves MÜLLER
Boletzky S. von., Rowe L., Aroles L., 1973, Spawning and development of the eggs, in the laboratory, of Illex coindetii (Mollusca: Cephalopoda), The Veliger, 15, 257-258.
Castro J.J., Hernández-García V., 1995, Ontogenetic changes in mouth structures, foraging behaviour and habitat use of Scomber japonicus and Illex coindetii,. Scientia Marina, 59, 347-355.
Fernández-Álvarez F. A., Martins C. P. P. ,Vidal E. A. G., Villanueva R., 2016, Towards the identification of the ommastrephid squid paralarvae (Mollusca: Cephalopoda): morphological description of three species and a key to the north-east Atlantic species, Zoological Journal of the Linnean Society, 180(2), 268–287.González A. F., Castro B. G., Guerra Á., 1996, Age and growth of the short-finned squid Illex coindetii in Galician waters (NW Spain) based on statolith analysis. ICES Journal of Marine Science, 53, 802–810.
Hastie L.C., Pierce G.J., Wang J., Bruno I., Moreno A., Piatkowski U., Robin J.P., 2009, Cephalopods in the north-eastern Atlantic: species, biogeography, ecology, exploitation and conservation, Oceanography and marine biology: an annual review, 47, 111–190.
Jereb P., Allcock A.L., Lefkaditou E., Piatkowski U., Hastie L.C., Pierce G.J., 2015, CEPHALOPOD BIOLOGY AND FISHERIES IN EUROPE II SPECIES ACCOUNTS ICES International Council for the Exploration of the Sea, Cooperative Research Report N° 325, 376p
Jereb P., Ceriola L., Ragonese S., 2017, Illex coindetii, Life history, ecological importance and potential for a “key” role in the Mediterranean context, NTR-ITPP, sr80: 69 pp (+Appendixes I, II, III and IV).
Logan J.M., Toppin R., Smith S., Galuardi B., Porter J., Lutcavage M., 2013, Contribution of cephalopod prey to the diet of large pelagic fish predators in the central North Atlantic Ocean, Deep-Sea Research, II, 95, 74-82.
Martinez P., Sanjuan A., Guerra A., 2002, Identification of Illex coindetii, I. illecebrosus and I. argentinus (Cephalopoda: Ommastrephidae) throughout the Atlantic Ocean by body and beak characters, Marine Biology, 141, 131-143.
Mangold-Wirz K., 1963, Biologie des Céphalopodes benthiques et nectoniques de la Mer Catalane, Vie et Milieu, Supplément 13, 285 p.
Mangold Wirz K., Boletzky S. von, 1987, CEPHALOPODES in Fischer W., Bauchot M-L., Schneider M., 1987, FICHES FAO D’IDENTIFICATION DES ESPECES POUR LES BESOINS DE LA PECHE (REVISION 1). MEDITERRANEE ET MER NOIRE, ZONE DE PECHE 37. VOLUME 1. VEGETAUX ET INVERTEBRES , CEE, FAO, ed. FAO, Rome, 760p.
Pascual S., González A., Arias C., Guerra Á., 1996, Biotic relationships of Illex coindetii and Todaropsis eblanae (Cephalopoda, Ommastrephidae) in the Northeast Atlantic : evidence from parasites. Sarsia, 81, 265–274.
Rasero M., Gonzalez A.F., Castro B.G., Guerra A., 1996, Predatory relationships of two sympatric squid, todaropsis eblanae, and Illex coindetii (Cephalopoda: Ommastrephidae) in Galician waters, Journal of the Marine Biological Association of United Kingdom, 76, 73-87.Ringvold H., Taite M, Allcock A. L., Vecchione M., Péan M., Sandulli R., Johnsen G., Fjellheim A., Bakke S., Sannæs H., Wårøy Synnes A.-E., Coronel J., Hansen M., Olejar P. G., Eliassen G., Eliassen A. & Klungland K., 2021, In situ recordings of large gelatinous spheres from NE Atlantic, and the first genetic confirmation of egg mass of Illex coindetii (Vérany, 1839 (Cephalopoda, Mollusca), Scientific Report, 11, 7168, 22 p.
Roper C.F.E., Lu C.C., Vecchione M., 1998, A revision of the systematics and distribution of Illex species (Cephalopoda: Ommastrephidae), Smithsonian Contributions to Zoology, 586, 405–423.
Roper C.F.E., Mangold K.M., 1998, Systematic and distributional relationships of Illex coindetii to the genus Illex (Cephalopoda; Ommastrephidae), In: Rodhouse P.G.,. Dawe E.G, O’Dor R.K., eds. Squid recruitment dynamics. The genus Illex as a model, the commercial Illex species and influences on variability, FAO Fisheries Technical Paper, 376, 13–26.
Salman A., 2017, Fecundity and Spawning Strategy of Shortfin Squid Illex coindetii (Oegopsida: Ommastrephidae), In the Eastern Mediterranean, Turkish Journal of Fisheries and Aquatic Sciences, 17, 843-851.
Sweeney M.J., Roper C.F.E., Mangold K.M ., Clarke M.R., Boletzky S. von, 1992, « larval » and juvenile cephalopods : a manual for their identification, Smithsonian Contributions to Zoology, 513,282 pages, 277 figures, 6 tables.
Vérany J.B.,1839, Mémoire sur six nouvelles espèces de Céphalopodes trouvés dans la Méditerranée à Nice. Memorie della Realle Accademia delle Scienze di Torino, 2(1), 91–98.
Vérany G.B., 1851, Mollusques méditeranéens [sic] observés, décrits, figurés et chromolitographiés d'après le vivant. 1. Céphalopodes de la Méditerranée. Gênes [Genova], imprimerie des Sourds-Muets pp. i-xvi, 1-132, avec 44 planches.La page de Illex coindetii dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.