Antennes 2 larges et très longues, antennes 1 beaucoup plus petites (voir le schéma "vocabulaire")
Corps non comprimé latéralement mais aplati dorso-ventralement
Corps blanchâtre avec des marques brunes
Terriers dans les sédiments vaseux estuariens (C. volutator), dans des sables vaseux (C. arenarium)
Le "termite" des ostréiculteurs.
Mud shrimp, mud dwelling amphipod, european mud scud (GB), Wattkrebs, Wattenkrebs, Schlickkrebs (D), Wadkreeftje, slijkgarnaal, langspriet (NL), Almindelig slikkrebs (DK), Slammärla (SE), Bełkaczek pospolity (PL)
Uniquement pour Corophium volutator :
Oniscus volutator Pallas, 1766
Corophium grossipes Linnaeus, 1767
Gammarus longicornis Fabricius, 1779
Corophium longicorne Latreille, 1806
Côte atlantique européenne, Méditerranée, côte est de l'Amérique du Nord
Zones DORIS : ● Europe (côtes françaises), ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ○ [Méditerranée française], ● Atlantique Nord-OuestCorophium volutator est présent dans l’ouest de la Norvège, en Baltique (jusque dans golfe de Botnie), en Grande-Bretagne et en Irlande, sur la côte atlantique européenne et en Méditerranée, jusqu’à la mer Noire et la mer d’Azov. Il est considéré comme introduit sur les côtes nord-américaines.
Corophium arenarium est présent en mer du Nord, en Manche, en mer d’Irlande, sur les côtes atlantiques et méditerranéennes françaises. On l'observe aussi en Amérique du Nord de la Nouvelle-Ecosse au Maine.
Le corophie tourneur creuse des galeries dans les sédiments vaseux souvent réduits en profondeur, des vasières estuariennes, lagunes, prés-salés et chenaux de marées soumis à la dessalure*. Cette espèce est principalement située au-dessus de la mi-marée. Les galeries sont en forme de U de 2 mm de diamètre pouvant s’enfoncer jusqu’à 4 cm de profondeur. Cette espèce supporte des variations de salinité de 2 à 50 ‰ avec un optimum de 15 à 20 ‰. Les individus de cette espèce sont souvent présents en très grand nombre.
Le corophie des sables (proposition de DORIS) vit également dans des terriers un peu plus profonds (5 cm) mais plutôt dans des sables vaseux (donc des sédiments non réduits, plus grossiers et moins saumâtres que pour C. volutator) depuis le niveau de mi-marée jusqu’au bas de l’estran*. Cette espèce accepte des salinités de plus de 30 ‰. Elle constitue également des populations denses.
Ce qui est remarquable à la première observation ce sont les antennes 2 larges et longues (voir le schéma "vocabulaire") qui peuvent chez le mâle atteindre la longueur du corps. Les antennes 1 sont beaucoup plus petites. Les antennes 2 chez les mâles sont plus robustes que celles des femelles (c'est un dimorphisme* sexuel).
Le corps blanchâtre est couvert de marques brunes. Chez Corophium volutator il peut mesurer jusqu’à 11 mm de long. Il est segmenté et aplati dorso-ventralement et non latéralement. La tête est petite avec les deux paires d'antennes pointant vers l'avant. Il y a sept paires de pattes segmentées. Les dernières paires de péréiopodes* sont beaucoup plus longues que les paires précédentes.
Corophium arenarium est semblable à C. volutator. Les deux espèces ont longtemps été confondues. Le corophie des sables est un peu plus petit puisqu’il ne dépasse pas 7 mm de longueur. En plus de la longueur, les deux espèces se différencient uniquement par des caractères visibles à la loupe binoculaire (par exemple au niveau du premier uropode*) et un peu par le milieu de vie quoique, parfois, les populations se chevauchent aux limites de leur répartition.
Dans les hauts niveaux de nombreux amphipodes peuvent être présents mais aucun ne présente des antennes 2 aussi développées et ils sont tous aplatis latéralement (comme les gammares) :
Sur le haut des estrans :
- dans les laisses de mer des plages de sable: Talitrus saltator et Talorchestia ;
- dans les galets et cailloutis : Orchestia gammarellus.
Quelques espèces d'amphipodes vivent dans un tube de vase :
- le genre Jassa dans le médiolittoral et jusque dans le circalittoral ;
- Haploops nirae dans le circalittoral.
D’autres espèces de Corophium sont également présentes en Europe et les corophiidés sont encore plus nombreux.
Corophium volutator (et probablement C. arenarium) pratique trois modes d’alimentation selon les conditions de l’environnement.
Les sexes sont séparés. Mâles et femelles sont légèrement différents. Les femelles sont un peu plus petites que les mâles. Les antennes des femelles sont moins développées et diffèrent par quelques caractères. Il y a donc un dimorphisme* sexuel. Les femelles vivent dans les terriers ou galeries.
À mesure que la marée se retire, les mâles adultes rampent à la surface des sédiments humides à la recherche de terriers occupés par des femelles matures où ils pénètrent si la femelle est réceptive. Des expériences en laboratoire ont montré que les mâles sont attirés par les signaux chimiques (phéromones*) libérés par les femelles. Comme les femelles (de 5 à 6 mm de long) doivent muer avant la copulation, les mâles doivent souvent combattre pour garder les femelles. Il y a copulation quand la femelle est prête.
Le thorax (le péréion) de la femelle porte du côté interne 4 paires de plaques flexibles (les lamelles incubatrices ou oostégites*). Ces structures forment un marsupium* ou poche du couvain. Les femelles y déposent directement leurs œufs. Le développement des 20 à 52 embryons s’effectue pendant deux semaines dans cette poche et les jeunes éclosent sous une forme identique à celle des adultes ; ils subiront ensuite plusieurs mues pour atteindre la taille adulte.
Les juvéniles creusent leur terrier à proximité de celui de leur mère. Il n’y a donc pas de phase larvaire* planctonique* permettant la dispersion de l’espèce. Cette dispersion dépend essentiellement de la capacité de nage des adultes, des courants de marée, de sa grande capacité reproductrice, ainsi que de la zoochorie* (transports par d’autres animaux comme les oiseaux).
Les individus vivent six mois à un an et les femelles ont une à deux périodes de reproduction mais parfois jusqu’à 5 . La reproduction cesse en dessous de la température de 7 °C.
Dans certaines populations de la côte est de l’Amérique du Nord, chez le corophie tourneur, le nombre de femelles est plus grand que celui des mâles. La prédation des mâles par les oiseaux ne suffit pas à expliquer cette différence, certains auteurs proposent que les femelles pratiqueraient l’automixie qui est une forme de parthénogenèse* par fusion de deux cellules haploïdes* produites par la femelle. L'individu issu de ce processus est une femelle.
La présence en grand nombre de coque commune (Cerastoderma edule) et d’arénicole des pêcheurs (Arenicola marina) peut fortement perturber le peuplement de Corophium volutator par la mise en mouvement des sédiments, dérangeant ainsi les amphipodes qui sortent de leurs galeries. Ces derniers sont alors soumis à la prédation par la crevette grise [Crangon crangon (Linnaeus, 1758)], le crabe enragé [Carcinus maenas (Linnaeus, 1758)] et le gobie tacheté [Pomatoschistus microps (Kroyer, 1838)].
D’importantes variations dans la densité du peuplement du corophie tourneur peuvent être dues à la prédation car ces amphipodes sont une importante source de nourriture :
Le corophie des sables est également un maillon très important du réseau trophique* car il constitue une des principales sources de nourriture pour les oiseaux (comme le gravelot à collier interrompu - Charadrius alexandrinus Linnaeus, 1758-) et pour les poissons.
D’autres organismes consomment les corophies tourneurs comme le némerte Tetrastemma melanocephalum (Johnson, 1837). Des diptères adultes (des mouches dolichopodides) et un coléoptère carabidé [Bembidion laterale (Samouelle, 1819)] consomment le corophie tourneur.
Les terriers en forme de U peuvent être utilisés successivement par plusieurs individus à la suite de luttes intraspécifiques*.
Les Corophium sont les seconds hôtes de Plathelmintes trématodes digènes parasites comme Maritrema subdolum Jägerskiöld, 1909 et Levinseniella brachysoma (Creplin, 1837) qui ont d’abord infecté des gastéropodes comme les hydrobies.
Les antennes très développées des corophies ont plusieurs fonctions : creusement du terrier, compactage de la paroi du tube, déblayage du sédiment hors de la galerie mais aussi ratissage des particules autour du terrier pour l'alimentation. Quant aux mâles plus fortement pourvus que les femelles, les antennes 2 joueraient peut-être un rôle dans la détection des phéromones des femelles.
Corophium construit dans le sédiment un terrier en forme de « U ». La paroi des galeries est formée de particules sédimentaires compactées, liées par la sécrétion collante des glandes glutinifères (= qui portent de la colle) localisées à la base du second péréiopode*.
Lors d’une eutrophisation* estivale pendant laquelle les entéromorphes (Ulva intestinalis) couvrent complètement le sédiment, les corophies tourneurs peuvent être complètement éliminés. Quand les entéromorphes ont disparu, ces zones sont rapidement recolonisées à partir des peuplements adjacents.
Du fait de la circulation de l’eau dans les terriers de Corophium volutator, l’oxygène dissous dans l’eau pénètre dans les sédiments un peu plus profondément et fait descendre la limite de la zone de sédiments réduits (anoxiques).
En hiver, la prédation peut diminuer fortement la densité des populations.
- Corophium volutator est l'un des organismes les plus abondants dans les vasières estuariennes atteignant des densités de 60 000 et même 100 000 individus par m². Cependant les densités de populations peuvent varier considérablement selon les saisons par exemple de 6 000 individus par m² en hiver à plus de 50 000 individus par m² en été. Lors des périodes de fortes densités, les ouvertures des terriers sont clairement visibles à la surface des sédiments.
- Corophium arenarium forme également des populations denses monospécifiques de plus de 40 000 individus par m².
Dans le milieu de vie de Corophium volutator de nombreuses espèces sont présentes comme :
Le corophie tourneur, par ses importantes populations, joue un rôle important dans le remaniement et la remise en suspension des sédiments.
- Les populations de Corophium sont sensibles aux insecticides à base de pyrèthre d’origine agricole par ruissellement.
- Les nonylphénols sont des molécules utilisées dans l’industrie textile, les peintures, les cosmétiques et les produits nettoyants domestiques. Ils sont théoriquement biodégradables mais bioaccumulables* et persistants. Ce sont des perturbateurs endocriniens qui se fixent aux particules de vase. Leur présence n’est pas mortelle pour Corophium volutator, mais elle réduit leur croissance et provoque l’agrandissement des antennes 2 du mâle qui sont déjà très développées et, ainsi, les rend plus vulnérables à la prédation par les échassiers lorsqu'ils rampent sur la surface de la vase à la recherche de femelles.
- Les éléments traces métalliques (les ex-métaux lourds) souvent présents dans les estuaires (émissaires industriels et eaux usées contaminées) sont toxiques pour Corophium volutator.
Du fait de sa prolificité, Corophium volutator est capable de recoloniser rapidement des zones fortement perturbées.
Dans un ouvrage sur les amphipodes de 1925, on peut lire que le corophie tourneur est en telle quantité que ses mues forment des cordons littoraux d'une épaisseur considérable sur la plage de Gravelines (Nord). Ce n’est plus le cas actuellement.
Les observations de Corophium (et les sous espèces) du Pacifique Nord-Ouest sont probablement attribuables à une ou plusieurs espèces de Sinocorophium.
Corophie : nom donné par Latreille en 1806 sans explication. Ce nom est parfois utilisé au masculin, comme l'a fait Latreille, ou au féminin.
tourneur : traduction simple de « volutator ». Ce devrait être plutôt « tourbillonneur ».
Corophium : nom de genre créé par Latreille en 1806 sans explication mais il a donné un nom vernaculaire : corophie.
volutator : du latin [voluto] = tourner ou du latin [voluta] = volute et le suffixe latin [-tor] = agent de l’action donc « tourneur » ou « fait des volutes ». Pallas, qui a décrit cette espèce en 1766, a écrit qu'elle tourne à la surface de l'eau d'une manière unique grâce à ces antennes.
oniscus : du latin [oniscus] = le cloporte.
arenarium : des sables, du latin [arena] = sable.
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Arthropoda | Arthropodes | Animaux invertébrés au corps segmenté, articulé, pourvu d’appendices articulés, et couvert d’une cuticule rigide constituant leur exosquelette. |
| Sous-embranchement | Crustacea | Crustacés | Arthropodes à exosquelette chitineux, souvent imprégné de carbonate de calcium, ayant deux paires d'antennes. |
| Super classe | Multicrustacea | ||
| Classe | Malacostraca | Malacostracés | 8 segments thoraciques, 6 segments abdominaux. Appendices présents sur le thorax et l’abdomen. |
| Sous-classe | Eumalacostraca | Eumalacostracés | Présence d’une carapace recouvrant la tête et tout ou partie du thorax. |
| Super ordre | Peracarida | Péracarides | Les femelles sont dotées d'une cavité d'incubation formée par des expansions lamelleuses des péréiopodes. |
| Ordre | Amphipoda | Amphipodes | Péracarides comprimés latéralement, dépourvus de carapace, et possédant de nombreuses paires d'appendices souvent modifiés. Ils sont représentés par les gammares, les talitres, les caprelles... |
| Sous-ordre | Senticaudata | ||
| Famille | Corophiidae | Corophidés | Amphipodes benthiques filtreurs. La deuxième antenne est très longue. |
| Genre | Corophium | ||
| Espèce | volutator / arenarium |
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Corophium volutator
L’animal est vu du côté droit. Les antennes 2, très développées, sont en avant de la tête. Un des péréiopodes est malencontreusement tordu vers le haut.
Paimpol (22) en haut de la zone de balancement des marées. Photographie faite au laboratoire.
06/03/2019
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Dans son terrier
Cet individu de Corophium volutator est surpris dans son terrier.
Paimpol (22), en haut de la zone de balancement des marées.
06/03/2019
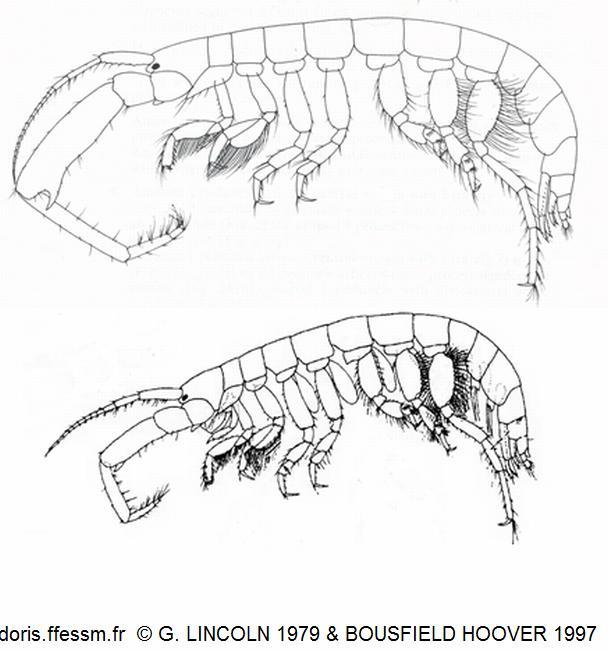
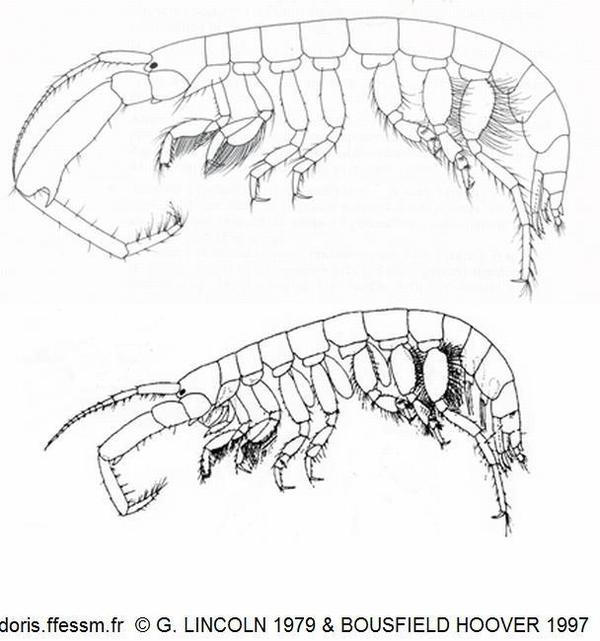
Comparaison du mâle et de la femelle
Le mâle est en haut, la femelle en bas. Les antennes 2 du mâle sont bien plus développées que celles de la femelle.
Seuls les appendices du côté droit sont représentés afin d'alléger les dessins.
Le dessin du mâle est extrait du livre de Lincoln (1979), celui de la femelle de l'article de Bousfield & Hoover (1997)
Reproduction de documents anciens
1979 et 1997
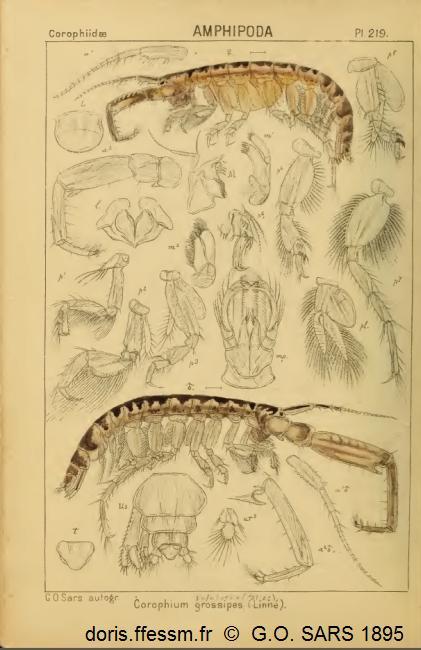
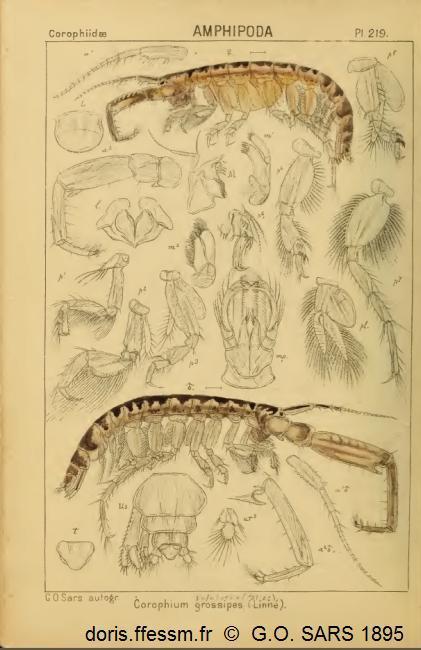
Dessins anciens de Corophium volutator mâle et femelle
Cette planche montre la femelle (en haut) et le mâle (en bas) et quelques détails permettant la détermination de cette espèce ainsi que du sexe.
Cette planche est extraite de l'ouvrage de Sars G.O. (1895).
Reproduction de documents anciens
1895
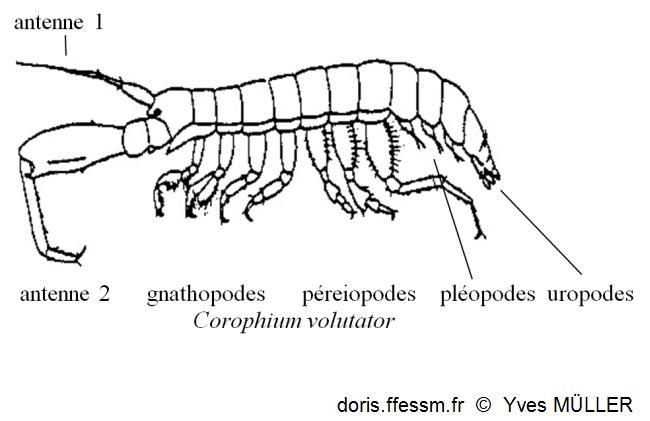
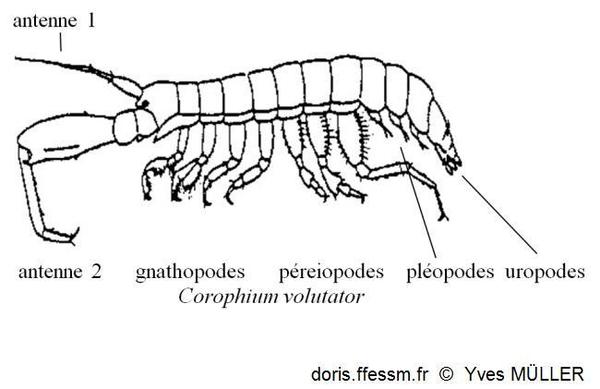
Vocabulaire
Schéma permettant de situer les différents appendices cités dans la fiche.
schéma
30/03/2020


Quelques aspects du comportement
Schémas illustrant le comportement de grattage de la surface du sédiment par C. volutator et sa position dans son terrier. Les antennes dépassent de l’une des ouvertures du terrier et tâtent les dépôts environnants. Elles sont utilisées pour racler les détritus organiques vers le terrier.
Extrait de Meadows P.S. Reid A.. 1966 The behaviour of Corophium volutator (Crustacea, Amphipoda). Journal of Zoology, London. 150, 387 -399.
Reproduction de documents anciens
1966


Deux individus de Corophium arenarium sur le sédiment
Un mâle en bas avec ses longues antennes 2 et une femelle (ou un individu juvénile) en haut.
Baie de Saint Brieuc, (22)
17/03/2011


Corophium arenarium femelle
Cet individu est vu du côté droit. Les antennes 2 sont moins développées que celles du mâle.
Pleubian (22). Détermination et photographie réalisées au laboratoire.
21/03/2019


Corophium arenarium femelle
L'individu est vu de dessus. Contrairement à la plupart des amphipodes les corophies sont aplatis dorso-ventralement et non pas latéralement.
Pleubian (22), Détermination et photographie réalisées au laboratoire.
21/03/2019


Corophium arenarium mâle
Les antennes 2 sont aussi longues que le corps.
Baie de Saint Brieuc (22), Détermination et photographie réalisées au laboratoire.
17/03/2011


Milieu à Corophium arenarium et Pygospio elegans
Le sédiment colonisé par ces organismes prend un aspect caractéristique.
Baie de Saint Brieuc,(22),
17/03/2011
Rédacteur principal : Yves MÜLLER
Vérificateur : Pierre NOËL
Responsable régional : Yves MÜLLER
Barnard J. L.,1973, Revision of Corophiidae and related families (Amphipoda), Smithsonian Contributions to Zoology, 1–27.
Bousfield E.L., Hoover P.M., 1997, The amphipod superfamily Corophioidea on the Pacific coast of North America: 5. Family Corophiidae: Corophiinae, new subfamily: systematics and distributional ecology, Amphipacifica, Journal of systematic biology, 2(3), 67-139.
Crawford G.I. ,1937, A review of the amphipod genus Corophium, with notes on the British species, Journal of the Marine Biological Association of the United Kingdom, 21, 589-629.
Fish J.D., Fish S., 1996,, A STUDENT'S GUIDE TO THE SEASHORE, Cambridge University Press, 572p.
Fish J.D., Mills A., 1979, The reproductive biology of Corophium volutator and C. arenarium (Crustacea: Amphipoda), Journal of the Marine Biological Association of the United Kingdom, 59, 355 -368.
Flach E.C., De Bruin W., 1993, Effects of Arenicola marina and Cerastoderma edule on distribution, abundance and population structure of Corophium volutator in Gullmarsfjorden western Sweden, Sarsia, 78, 105-118.
Flach E.C., De Bruin W., 1994, Does the activity of cockles, Cerastoderma edule (L.) and lugworms, Arenicola marina (L.), make Corophium volutator Pallas more vulnerable to epibenthic predators: a case of interaction modification?, Journal of Experimental Marine Biology and Ecology, 182, 265-285.
Foveau A., Mignard C., Ruellet T., 2013, Contribution à la dynamique de population de Corophium arenarium en baie de Somme dans le cadre du projet COMORES, Rapport du GEMEL n°13-033 30p.
Hart TJ., 1930, Preliminary notes on the bionomics of the amphipod, Corophium volutator Pallas. Journal of the Marine Biological Association of the United Kingdom, 16(3), 761-790.
Kruse I., Buhs F., 2000, Preying at the edge of the sea: the nemertine Tetrastemma melanocephalum and its amphipod prey on high intertidal sandflats, Hydrobiologia, 426, 43-55.
Le Mao P., Godet L., Fournier J., Desroy N., Gentil F., Thiébaut É., & al, 2020, ATLAS DE LA FAUNE MARINE INVERTEBREE DU GOLFE NORMANO-BRETON. Volume 4 : Arthropodes, Éditions de la Station Biologique de Roscoff, 192p.
Limia J., Raffaelli D., 1997, The effects of burrowing by the amphipod Corophium volutator on the ecology of intertidal sediments, Journal of the Marine Biological Association of the United Kingdom, 77(2), 409-423.
Lincoln R.J., 1979, BRITISH MARINE AMPHIPODA GAMMAROIDEA, British Museum Natural History, 658p.
Little C., 2000, THE BIOLOGY OF SOFT SHORES AND ESTUARIES, Biology of habitats, Oxford University Press, 252p.
Meadows P.S., Reid A., 1966, The behaviour of Corophium volutator (Crustacea, Amphipoda), Journal of Zoology, London, 150, 387-399.
Meißner K., Schaarschmidt T., 2000, Ecophysiological studies of Corophium volutator (Amphipoda) infested by microphallid trematodes, Marine Ecology Progress Series, 202, 143-151.
Neal K.J. Avant P., 2006, Corophium volutator A mud shrimp. In Tyler-Walters H. and Hiscock K. (eds) Marine Life Information Network: Biology and Sensitivity Key Information Reviews, [on-line]. Plymouth: Marine Biological Association of the United Kingdom. https://www.marlin.ac.uk/species/detail/1661
Salvat B., 1967, La macrofaune carcinologique endogée des sédiments meubles intertidaux (Tanaidacés, Isopodes et Amphipodes), éthologie, bionomie et cycle biologique, Mémoires du Muséum National d’histoire naturelle série A, Zoologie, 45, fascicule unique, 275p.
Schneider S D., Boates J.S., Forbes M., 1994, Sex ratios of Corophium volutator (Pallas) (Crustacea: Amphipoda) in Bay of Fundy populations, Revue canadienne de zoologie, 1994, 72(11), 1915-1921.
Watkin E.E., 1941, The yearly life cycle of the amphipod, Corophium volutator, Journal of Animal Ecology, 10, 77-93.
La page de Corophium volutatpr dans l'Inventaire National du Patrimoine Nature : INPN
La page de Corophium arenarium dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.