Grandes nageoires de contour ovale et s’étendant sur presque toute la longueur du manteau
Nageoires en forme de poire avec la partie la plus large vers l’extrémité postérieure du manteau
Petite tête avec 2 grands yeux verdâtres
8 bras longs, inégaux par paires, portant 2 rangées de ventouses
2 tentacules de chasse peu visibles
Massue tentaculaire avec 4 rangées de ventouses (les médianes sont plus grandes)
Manteau de 20 à 30 cm de longueur (voire plus)
Corps translucide avec des reflets métalliques et des points scintillants
Couleur variant de blanc crème
translucide à rose brunâtre et violet brunâtre en passant par le jaune
pâle
Calmar tonnelet, calmar aux yeux
verts, calmar de Lesson, calmar de récif à grandes nageoires, calmar récifal à
grandes nageoires
Bigfin reef squid, reef squid, oval squid, lesson’s squid, palk bay squid, green-eyer squid, (en Australie et Nouvelle-Zélande il est également connu sous le nom de “northern reef squid” pour le distinguer du “southern reef squid” Sepioteuthis australis qui est très proche)(GB), Grossflosse-Sepiakalmar, Grossflossen-Riffkalmar (D), calamar manopla (S)
Cette espèce porte de nombreux noms en Inde, au Myanmar, en Malaisie, en Corée, en Chine, au Japon (shiro-ika, ako-ika, kwa-ika) et à Hawaï.
Sepioteuthis hemprichii Ehrenberg, 1831
Sepioteuthis guinensis Quoy & Gaimard, 1832
Sepioteuthis lunulata Quoy & Gaimard, 1832
Sepioteuthis mauritiana Quoy & Gaimard, 1832
Sepioteuthis doreiensis Quoy [in Férussac & d'Orbigny], 1835
Sepioteuthis sinensis d'Orbigny [in Férussac & d'Orbigny], 1848
Sepioteuthis arctipinnis Gould, 1852
Sepioteuthis brevis Owen, 1881
Sepioteuthis neoguinaica Pfeffer, 1884
Sepioteuthis indica Goodrich, 1896
Sepioteuthis sieboldi Joubin, 1898
Sepioteuthis malayana Wülker, 1913
Sepioteuthis krempfi Robson, 1928
Mer Rouge, Indo-Pacifique tropical
Zones DORIS : ● Indo-Pacifique, ○ [Mer Rouge]Ce calmar est l’un des
Loliginidés les plus répandus en région tropicale et intertropicale. Il est
présent dans l’océan Pacifique occidental des îles d’Hawaï, et sur les côtes
septentrionales de l’Australie, aux côtes orientales africaines, en mer Rouge
et en Méditerranée orientale.
Sepioteuthis lessoniana est une espèce néritique* présente de la surface jusqu'à au moins 100 m de profondeur.
Il vit autour des récifs, des herbiers, des fonds sableux ou des rivages rocheux, dans des eaux entre 16 °C et 34 °C et une salinité de 28 à 36 ‰.
Cette espèce est présente près de la surface la nuit et plus profondément le jour ou sous du bois flotté (souvent des juvéniles).
Elle a tendance à rester près du littoral.
Sepioteuthis lessoniana est un calmar de taille moyenne à grande. La longueur du manteau* (la longueur du manteau est la mesure de longueur utilisée chez ces animaux, la tête et les tentacules ne sont pas pris en compte dans cette mesure) est communément de 20 à 30 cm (42 cm pour les plus grands mâles et 38 cm pour les plus grandes femelles). Ce manteau musclé est large et se termine par une extrémité postérieure émoussée.
Les nageoires, situées sur la partie supérieure du manteau, sont très grandes, de contour ovale et s’étendent sur presque toute la longueur du manteau (sauf chez les très jeunes individus).
L’ensemble des nageoires présente une forme de poire avec la partie la plus large vers l’extrémité postérieure du manteau. Une étroite ligne bleue ou blanche est visible au point d'attache des nageoires au manteau. Une crête charnue est également présente à l'endroit où les nageoires se rejoignent à l'arrière du calmar.
La tête, petite, porte deux grands yeux verdâtres recouverts d’une cornée* secondaire transparente (caractéristique de l’ordre des Myopsides). Elle porte également 8 bras longs (de longueur inégale, par paires), munis de deux rangées de ventouses et 2 tentacules de chasse plus longs mais peu visibles. Ces tentacules portent à leur extrémité une massue avec des ventouses. Cette massue tentaculaire est large avec 4 rangées de ventouses, les ventouses médianes sont plus grandes et portent 14 à 23 crochets pointus. Les ventouses sur les bras portent de petites dents pointues (18 à 29).
Le corps est translucide, parcouru de reflets métalliques verts ou bleutés, et moucheté de points scintillants pouvant émettre de la lumière par bioluminescence* (ces organes spéciaux contiennent des bactéries bioluminescentes) avec une couleur changeante en fonction des environnements. Il est souvent orné de chapelets de taches brunes et présente des barres transversales sombres.
De grands chromatophores* couvrent densément les surfaces supérieures de la tête, du manteau et des bras. Ils sont distribués de façon plus éparse sur la face ventrale. Les nageoires ne possèdent pas de chromatophores* sur la face inférieure. La couleur des individus vivants varie du blanc crème translucide au rose brunâtre et au violet brunâtre en passant par le jaune pâle.
Peu de genres de calmars ont une nageoire aussi longue que le manteau :
On peut confondre les seiches et les calmars, néanmoins, le manteau des seiches est plus large et leur nageoire relativement étroite en forme de ruban borde toute la longueur du manteau. Les seiches vivent à proximité du fond. Elles possèdent une coquille interne calcifiée (l’os de seiche ou sépion) peu visible en plongée.
Les Loliginidés sont des prédateurs actifs jouant un rôle important dans le réseau trophique*.
Les calmars capturent leur proie en faisant jaillir les deux tentacules de chasse munis de ventouses uniquement sur les massues et la ramènent dans la couronne des bras pour la maintenir. Leur bec corné (bec de perroquet) sert à déchiqueter la proie. Leur salive contient des substances neurotoxiques*. La radula* sert à convoyer la nourriture.
Sepioteuthis lessoniana se nourrit d’une grande diversité d’organismes marins et ses proies principales sont des poissons, des crevettes et d'autres crustacés (occasionnellement des stomatopodes et des crabes), des mollusques.
Cette espèce capture des proies mesurant moins de la moitié de sa longueur de manteau*.
Le cannibalisme est peu fréquent sauf chez les jeunes. Les juvéniles consomment du zooplancton* et des invertébrés marins.
Les céphalopodes sont des
gonochoriques* stricts, ce qui signifie que les sexes sont séparés.
Chaque
individu ne se reproduit qu’une fois en fin de vie (semelparité*). Les femelles
atteignent la maturité entre 8 et 20 cm de longueur du manteau, un peu plus tard
que les mâles.
Les individus mâtures, de coloration rougeâtre, se rapprochent des côtes pour se reproduire et se rassemblent en bancs dans la journée (ils se séparent la nuit pour se nourrir). Ils forment des couples qui font partie de petits groupes (jusqu'à plus de 80 couples) près d'un récif corallien par exemple, à faible profondeur.
A cette occasion, de nombreuses interactions sociales sont observées, comme des démonstrations de dominance, de parades nuptiales, de comportement territorial et le signalement de la présence de prédateurs. Ce sont des comportements dits agonistiques (conduites liées aux confrontations de rivalité entre individus).
Les mâles avant l'accouplement peuvent être agressifs, ce qui se manifeste par des postures et par des motifs de coloration corporelle (motifs colorés agonistiques), comme par exemple des motifs zébrés.
Les individus d’un couple sont parallèles et dans la même direction.
Les mâles non appariés imitent les motifs des femelles afin d’inciter les autres mâles à gaspiller leurs spermatophores*.
Les mâles appariés présentent des motifs différents des mâles seuls.
Les femelles utilisent aussi parfois ce dernier comportement pour repousser les mâles qui leur font la cour.
Puis, le mâle à côté de la femelle est de couleur sombre et, si un prétendant vient de l’autre côté, il lui présente la moitié de son corps de couleur claire (à l’inverse de chez les seiches). Les couples peuvent rester ensemble plusieurs jours.
Une fois le couple formé, les mâles protègent leur partenaire des autres mâles.
Ils nagent côte à côte, puis le mâle se place sous la femelle, au niveau de la tête, enlace son cou avec ses bras et insère son bras ventral gauche, le bras hectocotyle* dans la cavité du manteau de la femelle pour y fixer ses spermatophores*. Les spermatozoïdes* sont enfermés dans cette structure très élaborée. Le bras hectocotyle porte des ventouses modifiées en papilles longues, coniques et charnues. Le mâle libère les spermatophores et relâche la femelle. Cet accouplement dure une quinzaine de secondes. Il peut être répété après une demi-heure (observations pour la forme shiro-ika, Wada & al., 2005).
L’accouplement peut également se faire en tête-à-tête.
Pendant la ponte qui
suit l’accouplement, le mâle protège la femelle par des comportements (position
du corps, écartement des bras, modifications de coloration des chromatophores*) pour
éloigner les autres mâles.
Les femelles peuvent déposer de 20 à 1200 œufs dans des cordons (ou capsules ovigères*) contenant chacun 5 à 13 œufs disposés en un seul rang. Ces cordons sont attachés entre 2 et 10 m de profondeur, à des rochers, des coraux (comme des Acropora), des galets, des coquilles brisées, des algues et même des branches immergées.
Les œufs, de 3 à 5 mm de diamètre, sont enrobés par une substance gélatineuse et contenus dans un cordon blanc laiteux (de 6 à 8 cm de long et d'environ 1 cm de large) fixé à la base. Au moment de déposer un cordon, la femelle de couleur sombre clignote. Ces capsules sont attachées en grappes au substrat*.
L’ensemble des cordons forme souvent un bouquet. La femelle pond à plusieurs reprises (en moyenne 4 fois) après une seule copulation.
Lorsque la femelle pond dans des branches de coraux, l'extrémité de ses bras sont écorchés et deviennent opaques. Des petits poissons en profitent pour en picorer les extrémités.
Une fois la ponte effectuée, le mâle s’éloigne de la femelle.
Après la ponte, la femelle meurt assez rapidement. Les mâles peuvent s’accoupler avec plusieurs femelles.
La reproduction peut avoir
lieu toute l’année et la période la plus importante, de janvier à septembre,
dépend des endroits et des conditions.
Le développement des embryons* dure de 15 à 22 jours selon la température de l'eau.
A l’éclosion, la longueur du manteau* des juvéniles est de 4 à 6 mm. Ils ressemblent à des adultes miniatures. Ils ont un comportement grégaire et forment des bancs. Les individus les plus faibles sont mangés par les autres. La croissance des survivants est rapide.
Les calmars accomplissent généralement l'ensemble de leur cycle de vie dans les 4 à 6 mois suivant leur naissance. La température de l'eau peut affecter les taux de croissance et de maturation sexuelle des calmars. Dans les eaux chaudes équatoriales, ils ont une durée de vie plus courte et atteignent une taille corporelle plus petite que les individus qui vivent dans des eaux subtropicales "plus fraîches".
Les juvéniles de cette espèce vivent en bancs, ainsi que les calmars matures.
C’est à cette occasion que l’on peut les rencontrer en pleine eau à la fin d’une plongée.
Les différents individus d'un banc d'adultes sont presque tous orientés de la même façon et se tiennent à environ 2 longueurs de manteau* les uns des autres.
C’est une espèce dite lessepsienne* car elle est arrivée de la mer Rouge en Méditerranée orientale en passant par le canal de Suez. Toutefois il semble qu'elle y ait déjà existé en populations importantes car les pécheurs de la mer Egée lui ont donné un nom : soupiocalamaro, littéralement "calmar semblable à une seiche".
Les calmars, comme les seiches, possèdent deux façons de se déplacer :Lors de leur fuite en arrière, les calmars (ainsi que les seiches et les poulpes) peuvent éjecter un nuage d’encre afin de perturber ou leurrer l’agresseur. L'encre produite par les calmars menacés peut faire perdre aux prédateurs leur vue et leur odorat, en raison de la couleur et de l'alcalinité de l'encre.
Comme certains autres céphalopodes, le calmar de récif est capable de changer rapidement de couleur et de motifs corporels dès l'éclosion grâce au contrôle volontaire de l’expansion des chromatophores* (cellules cutanées pigmentées). Ces derniers sont petits quand ils sont au repos et grands quand les muscles se sont contractés. Quand les fibres musculaires des chromatophores cessent de se contracter le chromatophore revient à son état (petit) initial. En comparaison, les autres espèces de calmars Loliginidés ne produisent pas de motifs corporels complexes avant l'âge de quatre mois.
Il possède également des iridophores* (en particulier dans la tête), une forme de coloration structurelle qui produit des verts et des rouges métalliques iridescents lorsqu'ils sont éclairés. C’est aussi probablement l'une des deux espèces de calmar à posséder des leucophores*. Les leucophores sont une coloration structurelle de type réflecteur qui reflète la lumière ambiante, de sorte qu'ils sont blancs dans la lumière blanche, verts dans la lumière verte, et ainsi de suite.
Ils peuvent également utiliser des motifs cutanés polarisés différemment comme moyen de communication entre les individus, ce qui leur permettrait de communiquer entre eux tout en restant camouflés des prédateurs qui sont incapables de percevoir la lumière polarisée.
À tous les stades de leur vie, les calmars de récif de Lesson utilisent le camouflage, en changeant leur coloration en fonction de leur environnement grâce à leurs chromatophores.
Ils utilisent des changements rapides et vifs dans les motifs de couleur de son corps (via les chromatophores) pour transmettre des informations sur les menaces potentielles, les sources de nourriture ou la dominance. L'intimidation physique, comme la poursuite ou la morsure d'autres individus, ainsi que d'autres manifestations visuelles de domination, comme la présentation des organes génitaux et l'écartement des bras, ont également été observées dans les bancs et les groupes d'accouplement.
Le calmar de récif de Lesson est très proche du calmar des Caraïbes (Sepioteuthis sepioidea), une espèce connue pour ses interactions sociales complexes. Comme le calmar des Caraïbes, le calmar de récif de Lesson présente de nombreux comportements élaborés (toutefois moins diversifiés) à l’origine d’interactions entre les individus.
Cinq comportements sont couramment observés chez les calmars matures actifs de cette espèce :
Chaque comportement est composé de séquences de multiples composantes chromatiques en réponse à celles des congénères, ce qui correspond à des signaux visuels de communication (Lin & al., 2017).
Ces animaux ne possèdent pas d'organes spécialisés dans la détection ou la production de sons (bien que les vibrations soient perçues), et se fient plutôt à leur sens de la vue très développé pour communiquer et percevoir leur environnement.
En outre, les bras portent des chimiorécepteurs* sensibles près de leur bouche et sur les ventouses (plus développés chez les pieuvres et les seiches), ce qui les aide à distinguer les proies des autres éléments.
La rigidité du
corps est en partie assurée par une mince lame cornée transparente presque
toute droite et un peu dilatée à la partie supérieure, la plume (ou gladius).
Cette structure correspond à une coquille régressée à l'état d'une lamelle
chitineuse*.
Sepioteuthis lessoniana présente un intérêt commercial dans toute son aire de répartition. il est présenté principalement frais mais aussi séché. Sur l'ensemble de son aire de répartition, il est capturé tout au long de l'année à l'aide d'une variété d'engins.
Les céphalopodes ont tendance à concentrer rapidement les métaux lourds (ou éléments traces métalliques) et autres substances toxiques dans leurs tissus, ce qui joue un rôle important dans la bioaccumulation* de ces polluants chez les prédateurs marins et a des implications pour la consommation humaine. Des niveaux élevés de cadmium et de mercure sont souvent enregistrés dans les tissus des céphalopodes, mais uniquement dans la glande digestive (qui ne se consomme pas). Il n’y a aucune accumulation de métaux dans les tissus musculaires (le manteau qui se mange).
Cette espèce fait l'objet de nombreux projets d'aquaculture pour l’alimentation humaine et pour la recherche biomédicale. Elle est également utilisée comme appâts dans la pêche industrielle et de loisir.
Les calmars possèdent des axones (fibres nerveuses des neurones) géants qui peuvent avoir un diamètre de 1,5 mm. Ces axones permettent une transmission de l’information nerveuse optimale et rapide aux muscles, ce qui permet une locomotion performante.
Ces axones géants ont été observés par L.W. Williams en 1909 et redécouverts par J.Z. Young en 1939. Cette caractéristique particulière a permis l'étude du fonctionnement des messages nerveux par Sir A. Huxley et Sir A. Hodgkin (tous les deux prix Nobel en 1963 pour ces travaux).
Sepioteuthis lessoniana est d’ailleurs utilisé pour la recherche en neuroscience car ses axones géants mesurent plus de 400 µm de diamètre. D'autres recherches en immunologie, en biochimie, en oncologie et en éthologie sont également en cours.
Les calmars sont répartis dans deux ordres : les Myopsides et les Oegopsides, selon la présence (Myopsides) ou l’absence (Oegopsides) d’une membrane cornéenne transparente couvrant l’œil. Les Loliginidés sont des Myopsides.
Des études menées en 1993 ont toutefois indiqué que le calmar de récif de Lesson pourrait constituer un complexe d'espèces cryptiques. Il est donc probable que l'espèce comprenne plusieurs espèces très similaires et étroitement apparentées.
Ainsi on compte 3 groupes :
Le calmar de récif de Lesson est la proie de nombreux prédateurs comme le thon rouge (Thunnus thynnus), le thon ilstao (Katsuwonus pelamis), le thon blanc (Thunnus alalonga), le makaire bleu de l'Atlantique (Makeira nigricans), des requins ainsi que des oiseaux, des baleines et les humains.
Il est plus vulnérable à la
prédation pendant les stades larvaires.
Calamar : du latin [calamus] = calame, roseau. La plume (ou gladius) étant comme le roseau taillé pour l'écriture dans l'Antiquité. Ce terme est, de nos jours, davantage utilisé sur les étalages des poissonniers et en gastronomie, calmar serait l'appellation utilisée par les naturalistes.
de récif : cette espèce vit, entre autres, à proximité des récifs coralliens.
de Lesson : traduction de la dédicace à René Primevère Lesson, afin de distinguer cette espèce des autres calmars de récif.
Sepioteuthis : la nageoire fait le tour du manteau comme chez les seiches (du grec [sepia] = nom grec de l'animal et de l'encre produite lors de la fuite) et du grec [teuthis] = calmar.
lessoniana : le naturaliste français André Étienne d'Audebert de Férussac (1786-1856) a dédié ce calmar à René Primevère Lesson (1794-1847) naturaliste français qui prit part, comme médecin (et naturaliste), au voyage autour du monde de « la Coquille » (1822-1825). Ce dernier a collecté cette espèce de calmar sur les côtes de la Nouvelle-Guinée.
Numéro d'entrée WoRMS : 220317
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Cephalopoda | Céphalopodes | Yeux complexes, coquille interne, externe cloisonnée ou absente, cavité palléale musclée, siphon musculeux, tentacules ou bras (munis de ventouses). |
| Sous-classe | Coleoidea | Coléoïdes | Ventouses sur les bras, au nombre de 8 au moins. Bras hectocotyle chez le mâle pour le transfert des spermatophores. 2 branchies, 2 néphridies, une coquille interne ou vestigiale, des chromatophores, une poche à encre, un grand cerveau. |
| Super ordre | Decapodiformes | Décapodiformes / Decabrachia | Céphalopodes à 8 bras et 2 tentacules de chasse. |
| Ordre | Myopsida | Myopsides | Calmars possédant une membrane cornéenne transparente recouvrant l'œil. Les tentacules et les bras portent des ventouses mais jamais de crochets. Cet ordre comprend 2 familles (dont les Loliginidés) et peu d'espèces mais ces dernières sont pour la plupart côtières et donc plus familières. |
| Famille | Loliginidae | Loliginidés | Calmars côtiers et peu profonds. Certaines espèces tolèrent de faibles salinités. Les nageoires se rejoignent à l'extrémité postérieure du corps et peuvent s'étendre sur une partie ou sur toute la longueur du manteau. Les bras portent généralement 2 rangées de ventouses et les massues tentaculaires en portent 4 rangées. Le bras inférieur gauche est généralement modifié chez les mâles adultes (bras hectocotyle). |
| Genre | Sepioteuthis | ||
| Espèce | lessoniana |
 Céphalopodes
Céphalopodes

Sur le platier
La nageoire caractéristique, vue de profil, n'est pas bien visible.
Sakouli, Mayotte, 2 m
12/07/2020
 Céphalopodes
Céphalopodes

En pleine eau
Ces individus sont orientés dans la même direction et à distance les uns des autres.
M'Samboro, Mayotte, 2 m
30/05/2010


Vu du côté droit
L'animal fait onduler sa nageoire pour se déplacer. Cette nageoire est presque aussi longue que le manteau. L'œil est grand, les bras sont rassemblés vers l'avant et on devine l'extrémité des tentacules de chasse en massue tout à droite.
Piste de ski, Mayotte, 5 m
11/12/2008


Rencontre
Nageoire développée, œil grand, à proximité d'un récif en eau peu profonde.
Abu Dabbab, Egypte, 6 m
28/10/2021


Agrandissement de la photo précédente
On distingue la grande nageoire bien développée, les bras relativement courts avec les massues des tentacules à l'extrémité.
Abu Dabbab, Egypte, 6 m
28/10/2021


Vu de 3/4, détail d'une photo
Les massues des tentacules sont visibles à l'extrémité des bras. La nageoire très développée est visible.
Abu dabbab, Egypte, 6 m
28/10/2021


Vu de loin la forme est caractéristique
L'ensemble des nageoires a une forme de poire avec la plus grande largeur vers l'arrière.
Marsa Shagra, Egypte, 2-3 m
29/10/2021


Deux individus
L'individu, au premier plan, présente de forts reflets métalliques.
Bangka-Indonesie, 3 m, nuit
16/05/2015


Deux individus
Celui du premier plan montre ses deux tentacules de chasse, son corps semble presque transparent, ce serait le mâle.
Bangka, Indonesie, 3 m, nuit
16/05/2015




Un banc sous la surface
Nombreux individus tous orientés dans le même sens.
Mayotte
09/05/2012


Un individu près du fond
La nageoire ondule autour du corps comme chez la seiche. Cette posture avec les bras redressés est également décrite chez d'autres espèces. A quel comportement correspond-t-elle ?
Aer prang, Lembeh, Indonésie
27/07/2017


Un corps coloré
Le manteau présente des points scintillants et des reflets métalliques au-dessus des yeux.
Aer prang, Lembeh, indonésie
20/07/2017
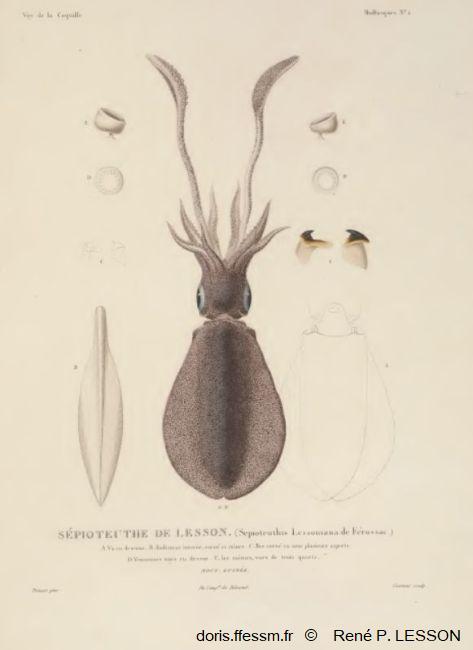
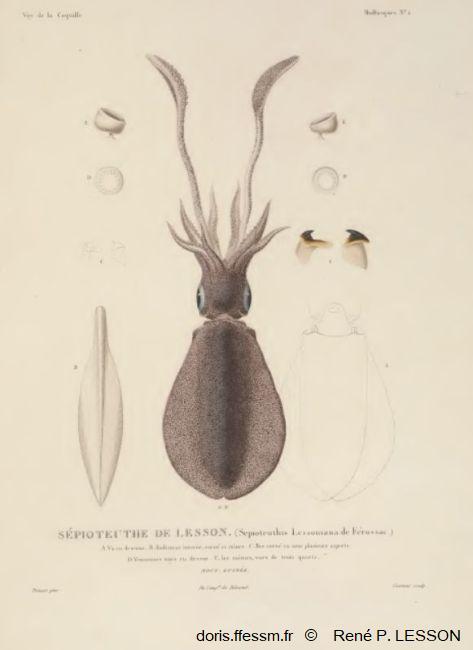
Planche Sepioteuthis lessoniana
Dessin du milieu : l'animal vu de dessus ;
A : l'animal vue de dessous ;
B : la plume ou gladius ;
C : le bec corné ;
D : ventouses vues en dessus ;
E : ventouses vues de 3/4.
R. P. Lesson, Voyage de "la Coquille" Atlas t2-1, Mollusques, Planche II.
Reproduction de documents anciens
1826-1830
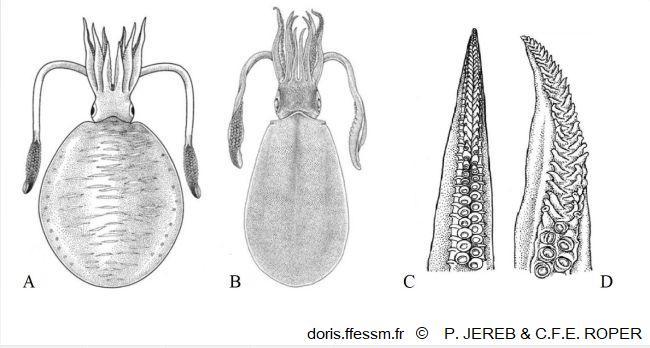
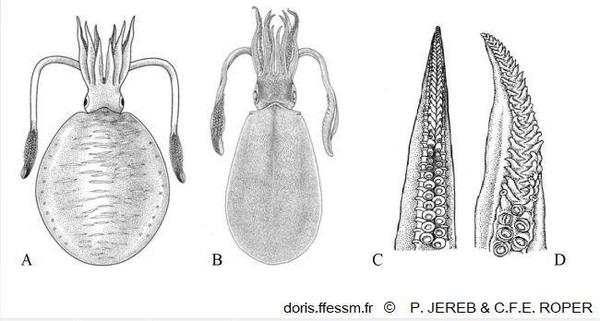
Différentes formes et détail du bras hectocotyle
A : Vue dorsale d'une forme indopacifique ;
B : Vue dorsale d'une forme du nord-est de l'Australie ;
C : Extrémité du bras hectocotyle de la forme indopacifique ;
D : Extrémité du bras hectocotyle de la forme du nord-est de l'Australie.
Dessins extraits de la figure 7 pages 124 et 125 de Jereb P. & Roper C.F.E.
Reproduction de documents anciens
2006
Rédacteur principal : Yves MÜLLER
Vérificateur : Laure BONNAUD-PONTICELLI
Responsable régional : Yves MÜLLER
Adamo S., Weichelt K.,1999, Field observations of schooling in the oval squid, Sepioteuthis lessoniana, Journal of Molluscan studies, 65, 377-380.
Boal J., Gonzalez S., 1998, Social behaviour of individual oval squids (Cephalopoda, Teuthoidea, Loliginidae, Sepioteuthis lessoniana) within a captive school, Ethology, 104, 161-178.
Cheng S.H., Anderson F.E., Bergman A., Mahardika G.N., Muchlisin A.A., Dang B.T., Calumpong H.P., Mohamed K.S., Sasikumar G., Venkatesan V., Barber P.H., 2013, Molecular evidence for co-occuring cryptic lineages within the Sepioteuthis cf. lessoniana species complex in the Indian and Indo-West pacific Oceans, Hydrobiologia, 25p.
Choe S., 1996, On the eggs, rearing, habits of the fry, and growth of some Cephalopoda, Bulletin of marine Science, 16, 330-348.
Choe S., Oshima Y., 1961, On the embryonal development and growth of the squid Sepioteuthis Iessoniana Lesson, Venus, 21, 462- 476.
Furya H., Ota M., Kimura R., Tsuneki K., 2004, Renal organs of cephalopods a habitat for dicyemids and Chromidinids, Journal of Morphology, 262, 629-643.
Ho J., Kim I., 2001, New species of Doridicola (Copepoda, Rhynchomolgidae) from Thailand, with a cladistic analysis of the genus, Journal of Crustacean Biology, 21, 78-89.
Ikeda Y., Ueta Y., Anderson F., Mmatsumoto G., 2009, Reproduction and life span of the oval squid Sepioteuthis lessoniana (Cephalopoda : loliginidae) : comparison between laboratory-cultured and wild-caught squid, Marine Biodiversity Records, 2, 1-7.
Jackson G.D., 1990, Age and growth of the tropical nearshore Loliginid squid Sepioteuthis lessoniana determined from statolith growth-ring analysis, Fishery Bulletin, 88(1), 113-118.
Jereb P., Roper C.F.E., 2006, Cephalopods of the Indian Ocean. A review, Part 1, Inshore squids (Loliginidae) collected durin the International Indian Ocean Expedition, Proceedings of the Biological Society of Washington, 119(1),91-136.
Kudo F., Nagasawa K., 2017, Doridicola similis (Copepoda : Poecilostomatoida : Rhynchomolgidae) associated with Sepioteuthis sp. (Cephalopoda : Myopsida : Loliginidae), new to Japan, Species Diversity, 22, 161-166.
Lee P., Turk P., Yang W., Hanlon R., 1994, Biological characteristics and biomedical applications of the squid Sepioteuthis lessoniana cultured through multiple generations, Biology Bulletin, 186, 328-341.
Lefkaditou E., Corsini-Forka M., Kondilatos G., 2009, Description of the first Lessepsiansquid migrant, Sepioteuthis lessoniana (Cephalopoda : Loliginidae), in the Aegean sea (eastern Meditteranean), Mediterranean Marine Science, 10(2), 87-97.
Lin C-Y., Tsai Y-C., Chiao C-C., 2017, Quantitative Analysis of Dynamic Body Patterning Reveals the Grammar of Visual Signals during the Reproductive Behavior of the Oval Squid Sepioteuthis lessoniana, Frontiers in Ecology and Evolution, 5, 1-16.
Lu C. C., Tait R. W., 1983, Taxonomic studies on Sepioteuthis Blainville (Cephalopoda: Loliginidae) from the Australian region, Proceedings of the Royal Society of Victoria, 95, 18l-204.
Segawa S., Izuka T., Tamashiro T., Okutani T., 1993, A note on mating and egg deposition by Sepioteuthis lessoniana in Ishigaki Island, Okinawa, southwestern Japan, Venus (Japanese Jounal of Malacology), 52, 101–108.
Sugimoto C., Ikeda Y., 2013, Comparison of the ontogeny of hunting behavior in pharaoh cuttlefish (Sepia pharaonis) and oval squid (Sepioteuthis lessoniana), Biological bulletin, 225, 50-59.
Sugimoto C., 2019, Basement of squid socialityexpressed with social network in the oval squid school, The japanese Journal of Animal Psychology, 69(2), 147-159.
Ueta Y., 2000, Fishery biological studies of the oval squid, Sepioteuthis lessoniana around Tokushima prefecture,(Japan), Résumé, Bulletin of Tokushima Prefectural Fisheries Experimentatl Station.
Wada T., Takegaki T., Mori T., Natsukari Y., 2005, Alternative male mating behaviors dependent on relative body size in captive oval squid Sepioteuthis lessoniana, Zoological Science, 22, 645-651.
La page de Sepioteuthis lessoniana dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.