Corps oblong faiblement comprimé pouvant atteindre 30 cm
Couleur dominante turquoise à verte, marques jaunes sur le dos et le pédoncule possibles
Ecailles portant une longue tache rose ou bleu foncé
Motifs bleu vif et verts sur la tête
Dents blanches toujours visibles
Perroquet gros ventre, perroquet prairie (île Maurice)
Common parrotfish, palenose parrotfish (GB), Loro commun (E), Papagaio vulgar (Mozambique), Witneus-papegaaivis (Afrique du Sud), Rosy-cheek parrotfish, gogos (Indonésie), Batavian parrotfish (Papouasie-Nouvelle Guinée), Busalog, molmol, angol, asul, bon-ak, bunog na angol, maming, mul-mul ungus, buyos, moy-moy, luro, yaput, malunaw (Philippines), Shogeyal (Micronésie), Bayan, kalat, ketarap, perencong (Malaisie), Bubute, kakarawa (Fidji), Mara kirita, uvu raungali (Iles Salomon), Uhu (Hawaï), Fuga matapua’a, laea matapua’a (Samoa), Pahoro hou (Tahiti), Kopumeri (Tuamotu)
Scarus forsteri Valenciennes, 1840
Scarus hertit Valenciennes, 1840
Scarus taeniurus Valenciennes, 1840
Scarus venosus Valenciennes, 1840
Xanothon venosus (Valenciennes, 1840)
Callyodon forsteri (Valenciennes, 1840)
Scarus balinensis Bleeker, 1849
Scarus bataviensis Bleeker, 1857
Callyodon bataviensis (Bleeker, 1857)
Xanothon bataviensis (Bleeker, 1857)
Pseudoscarus oktodon Bleeker, 1861
Scarus oktodon (Bleeker, 1861)
Xanothon oktodon (Bleeker, 1861)
Pseudoscarus forskalii Klunzinger, 1871
Scarus foskalii (Klunzinger, 1871)
Pseudoscarus filholi Sauvage, 1880
Pseudoscarus labiosus Macleay, 1883
Scarus brunneus Jenkins, 1901
Scarus gilberti Jenkins, 1901
Scarus jenkinsi Jordan et Evermann, 1903
Callyodon erythacus Jordan et Seale, 1906
Callyodon hornbosteli Fowler, 1925
Scarus galena Jordan, 1925
Xanothon carifanus Smith, 1956
Xanothon parvidens Smith, 1956
Mer Rouge, Indo-Pacifique tropical
Zones DORIS : ● Indo-Pacifique, ○ [Mer Rouge]On trouve ce poisson-perroquet en mer Rouge, dans tout l'océan Indien ainsi que dans l'océan Pacifique jusqu'à Hawaï et l'ile de Pâques à l'Est et du sud du Japon jusqu'aux côtes ouest-australiennes ainsi qu'en Nouvelle-Calédonie.
Scarus psittacus se rencontre en zones coralliennes ou sur fond rocheux, dans les lagons et sur les pentes externes jusqu’à 25 mètres de profondeur. On le trouve souvent en zone intertidale*.
Le perroquet commun affectionne les fonds sableux à coraux dispersés, où il trouve de quoi se nourrir.
Le corps est oblong et faiblement comprimé. Sa hauteur entre 2,6 à 3,1 fois dans la longueur standard (longueur sans la queue). Ce poisson-perroquet peut atteindre 30 cm.
Couleurs et motifs :
La couleur dominante de la livrée en phase terminale (la livrée des mâles) varie du turquoise au vert ; une bande vert clair à jaune plus ou moins large est fréquente le long de la dorsale, elle peut s’étendre sur la nuque et sur les parties supérieure et inférieure du pédoncule* caudal, ou former parfois une grosse tache en son centre. Les écailles, de grande taille, sont d’autant plus visibles qu’elles portent en leur centre une longue marque rose, qui peut virer au bleu violacé quand la livrée est verte. Il peut arriver aussi que quelques écailles éparses pâlissent quand l’animal est stressé.
La région ventrale présente 3 bandes horizontales vertes et roses alternées.
La tête porte des motifs bleu vif et verts. Le plus long part de la lèvre supérieure et se prolonge un peu au-delà de l’œil, séparant ainsi un front bleu violacé et des joues roses à orange. Deux autres lignes irrégulières, bleues à vertes, rayonnent à partir de la partie postérieure des yeux.
La gorge est rose ou orange. Une ligne bleue borde la lèvre inférieure, une autre, en forme de selle inversée, vient ensuite à quelques centimètres. A celle-là succède une large marque verte sous les joues, allant jusqu’au bout des opercules*, dont le bord porte une ligne verte dans la région des pectorales. Une ligne bleue partant de la selle inversée longe la gorge et le ventre sur la médiane du corps, jusqu’à la nageoire anale. Des marbrures diffuses, bleues à verdâtres, peuvent colorer les joues.
Quand la lèvre supérieure est fortement retroussée, elle laisse apparaître un large liseré jaune.
La livrée en phase initiale (celle des femelles et des mâles primaires) peut aller d’un gris verdâtre plus ou moins pâle et parfois parsemé d’écailles plus claires avec des bandes ventrales blanches à un brun rouge foncé uniforme. Les points communs sont des pelviennes rouges, vif dans la livrée brune et virant au rose plus ou moins pâle dans la livrée grise. Dans les deux livrées la région ventrale et la pointe du museau sont plus claires ; on distingue une tache plus foncée et diffuse entre les deux premiers rayons de la dorsale et une petite tache bleue à noire sur la partie supérieure de la base des pectorales.
Relativement à d’autres poissons-perroquets, Scarus psittacus ne présente pas de changements de livrée spectaculaires.
Dans la livrée nocturne, les couleurs sont conservées, mais elles sont relativement masquées par de grandes plaques grisâtres formant des bandes au tracé très irrégulier sur le corps. On constate alors des taches claires éparses sur le museau et une large zone blanchâtre sur les joues et éventuellement les opercules.
L’agressivité envers un congénère provoque un blanchiment de la partie antérieure du corps (à l’exception du front) qui peut aller jusque derrière les pectorales, pendant qu’une large bande horizontale très sombre marque le milieu des flancs jusqu’au pédoncule caudal.
Le stress peut brouiller la livrée, qui devient alors gris verdâtre, les motifs de la face, des écailles et des nageoires s’estompant.
La tête :
La tête est assez longue (environ un tiers de la longueur standard). Le front est relativement plat, la gorge est convexe, le museau est allongé et arrondi à son extrémité. Les yeux, ronds, sont indépendants, la peau enchâssant le globe oculaire est bleue à verte. Deux rangées de 5 à 7 écailles chacune se trouvent sur les joues. Le bout de la mâchoire supérieure couvre celui de la mâchoire inférieure quand la bouche est fermée.
Les dents, blanches dans les deux phases, toujours visibles, sont fusionnées en plaques à l’avant des deux mâchoires, il peut y avoir sur chacune 2 canines par côté, coudées vers l’extérieur, apparaissant aux commissures des lèvres.
Les nageoires :
- La dorsale est longue, elle commence à la verticale des pectorales et va jusqu’au début du pédoncule caudal. Une ligne bleue se prolongeant en cônes entre chaque rayon marque sa base, et une large bande rose à orange lui succède, suivie d’une fine ligne bleu foncé à haute marge bleu vif. Il arrive que des motifs verdâtres diffus, ou une série horizontale de taches rondes vertes soient visibles sur la bande rose.
- La nageoire anale porte les mêmes couleurs.
- Les pectorales sont bleu vif en partie antérieure, puis rose orange, leur partie postérieure est translucide à rayons bleutés.
- Les pelviennes présentent le même patron, mais les couleurs sont plus étendues et plus prononcées.
- La caudale est en croissant assez plat, elle devient légèrement trilobée chez les grands individus. Sa partie centrale commence par un croissant violet à lavande, puis elle est saumon à orange avec une série verticale de taches vertes ou bleues aux emplacements et contours irréguliers, ces motifs changeant avec les individus. Enfin vient un liseré bleu pâle suivi d’une très fine ligne translucide à blanche. Les bords des lobes supérieur et inférieur sont bleu vif, puis roses ou violets. La caudale est tronquée à légèrement échancrée en phase initiale.
Malgré le grand nombre de perroquets bleus ou verts à motifs faciaux bleus ou roses et nageoires à bandes roses, Scarus psittacus est plutôt aisé à reconnaître. En effet, la considération de la forme des motifs faciaux, associée à la répartition des couleurs de la tête, ne devrait pas permettre de confusions.
Il est conseillé, pour la discrimination, de ne pas se contenter des motifs jaunes présents sur le corps : ils existent chez d’autres espèces et peuvent ne pas apparaître ou être très discrets chez Scarus psittacus.
La couleur de la phase initiale ressemble beaucoup à celle de la même phase chez Scarus globiceps et Scarus rivulatus. Seuls un décompte du nombre de rangs d’écailles sur la face ventrale et un examen de celles-ci peuvent permettre la distinction entre ces trois espèces à cette période de l’évolution des individus.
Principalement herbivore, il se nourrit de jour et continuellement, ingérant des algues benthiques* épilithiques* et les organismes épiphytes* associés. La morphologie de sa dentition en fait un "racleur" (opposé aux poissons-perroquets "excavateurs") qui avale en même temps que le gazon algal une fine couche de corail. Le corail porte alors des marques superficielles typiques.
Sur les sites dégagés, il se contente le plus souvent de brouter à même le substrat sableux ou détritique. Comme tous les Scaridés, il n’a pas d’estomac, l’œsophage est relié à l’intestin.
L’espèce est hermaphrodite* protogyne* et diandrique*.
Environ 28% des individus en phase initiale sont des mâles (mâles primaires), selon une étude réalisée à Hawaï. Le ratio entre phase initiale et phase terminale a été évalué à 77 pour 1. Le changement de sexe commence aux alentours de 15 cm (longueur standard, sans la queue), la taille requise pour la maturité sexuelle des femelles est d’environ 10 cm.
Les mâles sont polygames, et territoriaux pendant la période de reproduction.
La ponte donne lieu à des agrégations. Le pic de ponte se situe en pleine saison chaude, un second pic moins important ayant lieu en fin de saison. Il arrive que des mâles primaires en livrée de phase initiale profitent de la ponte pour émettre leurs gamètes en même temps que le mâle terminal ("sneak spawning").
Les œufs sont pélagiques*, ils sont fuselés (contrairement à ceux de nombreux genres de Scaridés, qui sont sphériques), ils font 3 mm de longueur et 1 mm de largeur au maximum. Les larves de Scarus psittacus n’ont pas encore été décrites.
La livrée des juvéniles est extrêmement variable. La livrée typique est uniformément gris-brun pâle avec un ventre plus clair, les flancs sont rayés par 4 barres horizontales un peu plus foncées, la barre partant des yeux étant légèrement plus large et la barre ventrale plus indistincte. Les nageoires sont translucides. Chez les individus de moins de 25 mm, il peut y avoir 4 à 6 taches de couleur bronze alignées sur les barres foncées. Les juvéniles au-dessus de 15 mm peuvent changer rapidement de couleur. Au-dessus de 20 mm la livrée typique est uniformément gris pâle ou brun pâle avec un museau plus clair. Au-dessus de 40 mm les pelviennes commencent à rougir. A 60 mm, la livrée est très proche de celle de la phase initiale. Les juvéniles se mêlent à des groupes de juvéniles d’autres espèces à couleur dominante claire. Les jeunes en phase initiale peuvent aussi former de petits groupes.
On peut trouver des gobies (Eviota sp., notamment) ou des crevettes (Stenopus hispidus par exemple), sur le cocon formé la nuit par ce poisson-perroquet.
Il peut être parasité par des crustacés isopodes ou copépodes (Caligus callyodoni), son cocon l’en protégeant la nuit, ou par des parasites internes comme Haemogregarina tetraodontis.
L’adulte pèse entre 270 et 500 grammes, il mesure en moyenne 20 cm à 5 ans.
La ligne latérale est interrompue, elle comprend 22 à 24 écailles.
Des dents pharyngiennes (dents implantées dans l'arrière-bouche, sur le pharynx) permettent le broyage des contenus solides (notamment les morceaux de squelette de corail issus du « raclage » des algues qu’ils portent).
La nageoire dorsale comprend 9 rayons durs flexibles et 10 rayons mous. Sa base est accompagnée d’un rang d’écailles.
L’anale comprend 3 rayons durs et 9 rayons mous.
Les pectorales comprennent 11 à 16 rayons dont la majorité sont branchus.
Scarus psittacus fait partie des espèces de poissons-perroquets qui s’entourent la nuit d’un cocon de mucus transparent et relativement épais dans lequel ils dorment profondément. Il n’est pas rare de rencontrer plusieurs individus d’espèces différentes dormant sur une faible surface.
Le cocon est produit une fois que le poisson a trouvé un appui, posé sur le substrat en position verticale, contre le pied d’un massif de corail ou dans une anfractuosité (plus rarement avec la partie postérieure du corps légèrement ensablée, sans autre appui). Le mucus qui le constitue est sécrété par des glandes spécialisées, situées dans la cavité operculaire et autour des branchies. Il est concentré dans la bouche où il forme parfois une boule blanche, et est dirigé sur le corps à l’aide des pectorales. Le cocon est achevé en une durée comprise entre 30 minutes et plus d’une heure, il possède un clapet devant la bouche, probablement pour faciliter la sortie, et un petit trou à l’arrière pour permettre la circulation de l’eau nécessaire à la respiration. Hors situations critiques, la sortie du cocon est lente, probablement du fait de la nécessité de retrouver le cycle métabolique diurne. On peut voir le matin des cocons vides en forme de boules informes, flottant sur le substrat ou accrochés aux coraux.
Le cocon peut être produit de jour, après un stress ou une obscurité expérimentalement provoquée. Il peut l’être aussi en situation d’anoxie, ce qui signifierait qu’il présente de probables avantages métaboliques. Un second cocon peut être formé par un individu qui a été contraint de sortir du premier..
Les spécialistes sont partagés quant à la fonction précise de ce cocon : le mucus contient un antioxydant qui a clairement une fonction répulsive vis-à-vis des parasites, mais l’enveloppe peut aussi empêcher des prédateurs de repérer olfactivement la présence de l’animal, ou servir d’avertisseur d’approche quand il est touché. Aucune de ces fonctions n’est exclusive des deux autres, mais seule la première est démontrée.
Le mucus qui couvre constamment le corps des poissons récifaux les protège contre le rayonnement ultra-violet, mais il a aussi un rôle dans l’osmorégulation (contrôle de la pression osmotique interne), ainsi que dans la résistance aux frictions et à la dessiccation. Le mucus destiné au cocon n’est pas produit par la même glande, il a des propriétés anti-bactériennes mais pas de propriétés anti-UV.
L’espèce est commune. Les individus sont en général solitaires mais peuvent accompagner quelque temps un groupe mixte ne contenant pas de congénère. Scarus psittacus est peu farouche et s’habitue assez vite à l’observateur.
Les rassemblements occasionnés par les périodes de ponte peuvent être attaqués par des prédateurs comme Caranx melampygus ou Aphareus furca.
L’âge maximum rapporté est de 5 ans, l’espèce a un haut niveau de résilience* (le temps minimum de doublement de population est de moins de 15 mois), sa vulnérabilité est faible.
Scarus psittacus est pêché malgré sa petite taille (il est commun sur les marchés), mais il n’est pas en danger de raréfaction hors zones de surpêche. La taille minimum pour les prises à Hawaï est de 30 cm, elle ne concerne donc que les plus grands mâles et protège ainsi l’espèce.
Il joue un rôle positif dans l’équilibre des écosystèmes coralliens : du fait de sa façon de brouter peu agressive pour le corail, il ne l’affecte pas de façon importante, et pour ce qui concerne ses prélèvements sur le substrat, il empêche l’établissement et la croissance des macro-algues et libère des espaces de substrat propices au recrutement des jeunes coraux.
Il participe moins que les poissons-perroquets « excavateurs » à la formation du sable corallien.
Scarus psittacus est rarement demandé dans le commerce aquariophile notamment à cause de sa taille exigeant un grand bac, et du fait qu’il abîme les coraux.
Perroquet : le rapport de ce nom au poisson peut venir des couleurs très vives de certaines espèces, qui évoquent celles de nombreux oiseaux de la famille des Psittacidés (perroquets) et/ou des plaques dentales soudées de la plupart des Scaridés, qui évoquent le bec des volatiles.
Commun : du fait que cette espèce est largement répandue.
Scarus : du latin [scarus], qui signifie scare, ou poisson de mer (scare est le nom vernaculaire générique des poissons-perroquets). Le mot latin est dérivé du grec [skaros], de même sens. Les Grecs connaissaient cette famille à travers Sparisoma cretense, présent sur leurs côtes, Aristote en décrit les viscères. Le genre a été porté à la connaissance du public
scientifique en 1775 d’après les descriptions de P. Forskål, mort en
1763. Il comprend actuellement 52 espèces acceptées.
psittacus : du latin [psittacus] qui signifie perroquets (il s’agit alors des oiseaux).
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Chordata | Chordés | Animaux à l’organisation complexe définie par 3 caractères originaux : tube nerveux dorsal, chorde dorsale, et tube digestif ventral. Il existe 3 grands groupes de Chordés : les Tuniciers, les Céphalocordés et les Vertébrés. |
| Sous-embranchement | Vertebrata | Vertébrés | Chordés possédant une colonne vertébrale et un crâne qui contient la partie antérieure du système nerveux. |
| Super classe | Osteichthyes | Ostéichthyens | Vertébrés à squelette osseux. |
| Classe | Actinopterygii | Actinoptérygiens | Ossification du crâne ou du squelette tout entier. Poissons épineux ou à nageoires rayonnées. |
| Sous-classe | Neopterygii Teleostei | Néoptérygiens Téléostéens | Poissons à arêtes osseuses, présence d’un opercule, écailles minces et imbriquées. |
| Super ordre | Acanthopterygii | Acanthoptérygiens | Rayons épineux aux nageoires, écailles cycloïdes ou cténoïdes, présence d'une vessie gazeuse et pelviennes thoraciques ou jugulaires, sans être systématiquement présents, sont des caractères que l'on ne rencontre que chez les Acanthoptérygiens. |
| Ordre | Perciformes | Perciformes | Nageoires pelviennes très rapprochées des nageoires pectorales. |
| Sous-ordre | Labroidei | Labroïdes | Une seule dorsale, dents molariformes formant un puissant appareil masticatoire. |
| Famille | Scaridae | Scaridés | Une seule nageoire dorsale, dents soudées formant un puissant "bec de perroquet". |
| Genre | Scarus | ||
| Espèce | psittacus |
 Poissons osseux nageant près du fond
Poissons osseux nageant près du fond

Un joyau du lagon
Ce mâle explore le substrat à la recherche de nourriture.
Lagon de l'Ermitage, La Réunion, 1,5 m
19/12/2011
 Poissons osseux nageant près du fond
Poissons osseux nageant près du fond

Livrée bleue
La livrée à dominante bleue a tendance à violacer les roses, qui sont plus vifs sur la livrée à dominante verte.
Tahiti, Polynésie française, 8 m
02/04/2010


Livrée initiale
La livrée en phase initiale (ou PI, phase initiale) concerne les femelles et les mâles primaires de l’espèce.
Elle peut-être gris-vert, comme ici, ou gris très pâle, ou verdâtre à écailles plus claires et plus foncées, ou brun rouge foncé. Le point commun le plus visible est la couleur rouge plus ou moins prononcée des pelviennes !
Lagon de l'Ermitage, La Réunion, 1,5 m
20/10/2010


Tête d'un tahitien
Chez le mâle, la tête porte des motifs bleu vif et verts. Le plus long part de la lèvre supérieure et se prolonge un peu au-delà de l’œil, séparant ainsi un front bleu violacé et des joues roses à orange. Une ligne bleue borde la lèvre inférieure. Mais le motif peut se faire plus complexe si on le détaille...
Tahiti, Polynésie française, 8 m
02/04/2010


Agressivité
La rencontre d’un congénère provoque souvent un comportement de menace caractérisé, pour ce qui concerne la livrée. On constate, comme sur ce cliché, un pâlissement très net du dos et de la partie antérieure à l’exception du front qui reste sombre, accompagné d’une zone noirâtre tout le long du flanc après les pectorales.
Lagon de l'Ermitage, La Réunion, 1,5 m
23/07/2011


Confrontation au dessus du récif : combat rituel
Les mâles sont territoriaux pendant la période de reproduction.
Ce comportement donne lieu à des affrontements entre eux pour la possession du territoire, autrement dit des femelles.
Ces affrontements prennent souvent une forme ritualisée sur la frontière d’un territoire : les mâles pratiquent alors le « verrouillage de bouche (« mouth locking », ou « lip locking ») en mordant, l’un la mâchoire supérieure de l’autre et l’autre la mâchoire inférieure du premier, puis en tournant ainsi autour de ce pivot jusqu’à ce que l’un des deux abandonne la partie. Les combats peuvent aussi être plus violents quand une frontière est franchie.
Passe de Dumbéa (Nouvelle-Calédonie), 13 m
21/12/2017


Cocon de nuit
Scarus psittacus fait partie des espèces de poissons-perroquets qui fabriquent et s'entourent d'un cocon avant de s'endormir.
Il faut entre 30 minutes et plus d'une heure pour que le cocon soit achevé.
On peut remarquer des taches claires éparses sur le museau et une large zone blanchâtre sur les joues, typiques de la livrée nocturne.
Archipel d'Alor, Petites îles de la Sonde, Indonésie, 16 m, de nuit
13/04/2008


Pongiste ?
On voit ici, dans la gueule de l’animal, la boule de mucus à partir de laquelle le cocon est formé par dilution dans l’eau. Le mouvement des pectorales dirigera le filet protecteur vers l’arrière du corps pour que le mucus enveloppe le corps du poisson.
Lagon de l'Ermitage, La Réunion, 1,5 m
24/11/2010


A Mayotte
Les poissons-perroquets dorment "verticalement", le ventre à même le substrat, en prenant appui sur une roche ou une anfractuosité du corail.
Mayotte, de nuit
05/2010


Rencontre étrange
On peut rencontrer le matin, échoué au pied d’un massif de corail ou, comme ici, flottant entre deux eaux, un cocon vide abandonné par son auteur aux aurores.
Lagon de l'Ermitage, La Réunion, 1,5 m
24/11/2010


Nourriture
Scarus psittacus se nourrit d’algues qu’il trouve sur le substrat, sur des débris coralliens ou sur des massifs vivants. Il fait partie des perroquets « racleurs », beaucoup moins agressifs pour le corail que les « excavateurs ».
Lagon de l'Ermitage, La Réunion, 1,5 m
05/11/2011


Dentition
On distingue ici les deux paires de canines que le poisson porte en arrière des plaques dentales sur chaque mâchoire. Les dents sont blanches (elles peuvent être bleues chez d’autres espèces de poissons-perroquets).
Lagon de l'Ermitage, La Réunion, 1,5 m
05/11/2011
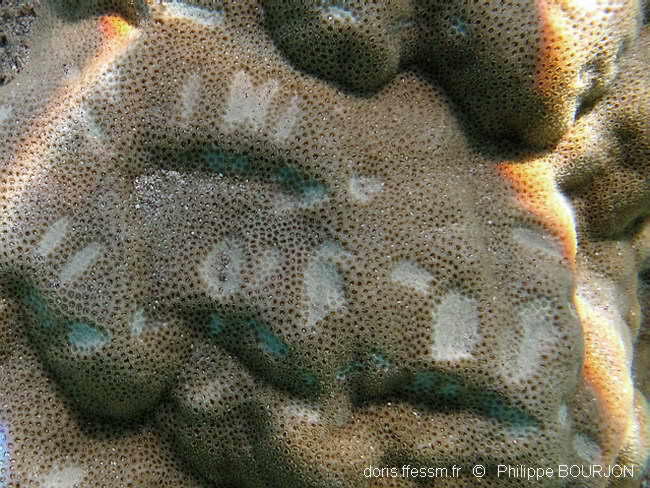
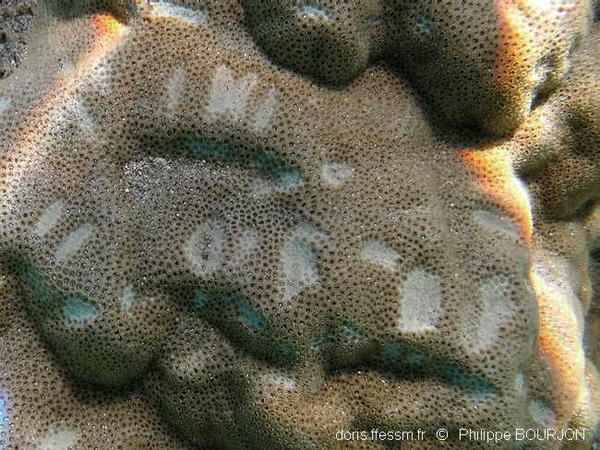
Morsures à la surface du corail
Ces entailles peu profondes à la surface d’un massif de corail Porites sont le fait d’un poisson-perroquet « racleur ». Leur taille peut permettre de soupçonner l’identité de leur auteur, dans la mesure où Scarus psittacus est le plus gros (et l’un des seuls) racleurs du lagon dans lequel la photo a été prise.
Lagon de l'Ermitage, La Réunion, 1,5 m
25/09/2009
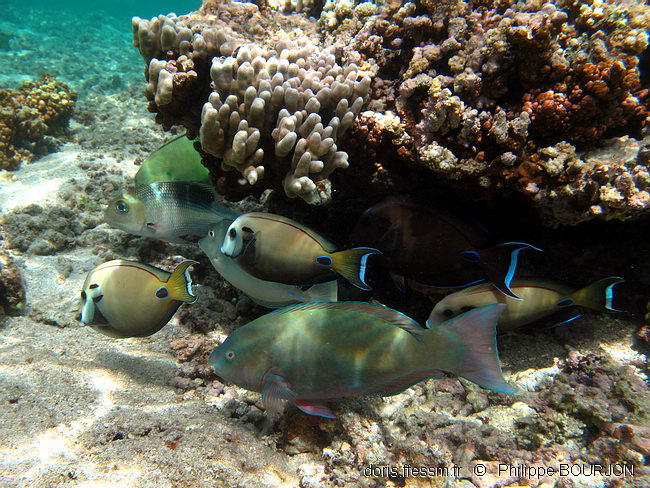
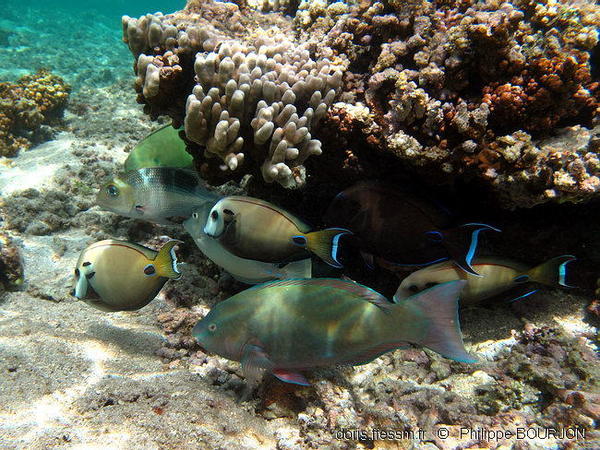
Groupe mixte à La Réunion
On peut rencontrer Scarus psittacus en groupes mixtes.
L’individu présent sur la photo, inquiet de la présence de l’observateur, arbore sa livrée brouillée.
On peut voir ici quatre chirurgiens-lieutenants (Acanthurus tennentii) dont l’un est en livrée brune, un chirurgien à éperons bleus (Naso unicornis), un capitaine bossu (Monotaxis grandoculis) et une girelle-clown (Coris aygula) au fond.
Lagon de l'Ermitage, La Réunion, 1,5 m
17/09/2011


En Nouvelle-Calédonie
Le perroquet commun Scarus psittacus a une large distribution Indo-Pacifique puisqu'on le trouve des côtes orientales de l'Afrique jusqu'à Hawaï. On voit ici un individu néo-calédonien endormi.
Poindimie, Nouvelle-Calédonie, 10 m, de nuit
23/05/2010


A Madagascar
Photographié dans le parc naturel marin de Tanikely, cet individu s’est obstiné un certain temps à demander un service de nettoyage, comme le montre son attitude oblique, en regardant fixement le caisson ou son propriétaire ! Il faut dire que le lieu regorge de stations de nettoyage, et l’affaire était peut-être urgente…
Parc naturel marin de Tanikely, Madagascar, 7 m
11/08/2011
Rédacteur principal : Philippe BOURJON
Vérificateur : Alain-Pierre SITTLER
Responsable régional : Alain-Pierre SITTLER
Bellwood D. R., Choat J.H., 1989, A description of the juvenile phase colour patterns of 24 parrotfish species (family Scaridae) from the Great Barrier Reef, Australia. Records of the Australian Museum, 41, 27-38.
Bellwood D. R., 1994, A phylogenetic study of parrotfishes Family Scaridae (pisces : Labroidei), with a revision of genera, Records of the Australian Museum, supplement 20, 67-68.
Byrne J. E., 1970, Mucous Envelope Formation in Two Species of Hawaiian Parrotfishes (Genus Scarus), Pacific Science, 24, 490-492.
Cerny-Chipman E., 2007, Distribution of ultraviolet-absorbing sunscreen compounds across the body surface of two species of Scaridae, ISP Collection ; Paper 147.
Curan M. C., 1992, The Behavioral Physiology of Labroid Fishes, Doctoral dissertation, The Massachusetts Institute of Technology, 13-21.
Green A. L., Bellwood D. R., 2009, Monitoring functional groups of herbivorous reef fishes as indicators of coral reef resilience, IUCN, 70, 20-34.
Grutter A. S., Rumney J. G., Sinclair-Taylor T., Waldie P., Franklin C. E., 2010, Fish mucous cocoons: the 'mosquito nets' of the sea, Biology letters, The Royal Society, 1-3.
Longenecker K., Langston R., Barrett B., 2008, A Compendium of the life history information for some exploited Hawaian reef fishes, Bishop Museum technical report n° 44, 39-42.
Sancho G., Petersen C. W., Lobel P. S., 2000, Predator-prey relations at a spawning aggregation site of coral reef fishes, Marine Ecology Progress Series, 203, 275-288.
Smit N. J., Grutter A. S., Adlard R. D., Davies A. J., 2006, Hematozoa of teleost from Lizard Island, Australia, with some comments on their possible mode of transmission and the descrption of a new hemogregarine species, Journal of parasitology, 92, 77-87.
Videler H., Geertjes G. J., Videler J. J., 1999, Biochemical characteristics and antibiotic properties of the mucous envelope of the queen parrotfish, Journal of fish biology, 54, 1124-1127.
La page de Scarus psittacus sur le site de référence de DORIS pour les poissons : FishBase
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.