Ver habitant dans un tube, de 2 à 4 mm de diamètre intérieur, constitué de grains de sable agglomérés, fixé sur un support solide
Dans la zone intertidale (de balancement des marées)
Formant parfois des « récifs »
Soies dorées fixées sur 2 pédoncules antérieurs faisant office d'opercule
Nombreux tentacules autour de la bouche, parfois visibles à marée haute, à l'ouverture du tube
Teigne, crassier en Vendée
Honeycomb worm (GB), Gusano panal (E), Sandkoralle (D), Zandkokerworm (NL)
Sabella alveolata Linnaeus 1767
Hermella alveolata Quatrefages, 1865
Mer du Nord, Manche, Atlantique Nord-Est tempéré, Méditerranée occidentale
Zones DORIS : ● Europe (côtes françaises), ○ [Méditerranée française], ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]Les hermelles affectionnent les eaux fraîches et tempérées.
On les rencontre en mer du Nord ; en Manche, au sud-ouest de la Grande Bretagne, et en baie du Mont Saint Michel ; en Atlantique, de l'Irlande au nord de l'Afrique. En France, des récifs importants sont situés en Vendée, à Saint Gilles Croix de Vie, autour des îles d'Yeu, de Noirmoutier, d'Oléron ; on en trouve aussi dans le bassin d'Arcachon, et sur la côte basque.
En Méditerranée, cette espèce a été signalée dans le golfe de Valence et sur la côte languedocienne.
Habitant du médiolittoral*, Sabellaria alveolata vit en principe dans la zone de balancement des marées en milieu littoral principalement sableux.
Le juvénile construit son tube sur un substrat stable (rocher, galet, coquille, autre tube…) en utilisant les grains du sable alentour.
Une certaine agitation de l'eau paraît favorable à la croissance des tubes, en permettant la mise en suspension du sable, mais on peut rencontrer ces vers aussi bien en mode battu qu'abrité.
Ces vers vivent dans des tubes sableux de 2 à 4 millimètres de diamètre intérieur, collés sur toute leur longueur sur des rochers, des galets ou des coquilles. La taille et la forme des grains sont sélectionnées en fonction de la taille de l'organe constructeur ventral en forme de fer à cheval, qui calibre et « englue » de « ciment organique » le grain avant qu'il soit déposé au bord du tube. Les individus se groupent souvent en masses considérables, de 15 000 à 60 000 au mètre carré, et forment de véritables récifs. Ceux-ci, parfois épais de plusieurs décimètres peuvent couvrir des surfaces de plusieurs centaines de mètres carrés dans la zone de balancement des marées. Des bancs importants se sont formés dans la baie du Mont St Michel, ou dans la baie de Bourgneuf en Vendée (cf. photos n° 1 à 5).
Le corps de l'animal hors de son tube mesure 3 à 4 centimètres de long et présente 3 régions distinctes :
Tout à fait à l'avant, près de l'ouverture du tube, deux gros pédoncules portent une couronne de 3 rangées de soies* dorées, appelées « palées », dirigées en avant. Ils font office d'opercule* et obturent le tube lorsque l'animal est rétracté. La bouche est entourée par de nombreux tentacules alimentaires (cf . photos n° 8, 9), et 2 petits palpes marquent la région du cou. Le reste de cette région antérieure dite « thoracique » porte des branchies, mais il n'y a pas de panache branchial extériorisé.
La deuxième région du corps dite « abdominale » porte à la fois des soies et des branchies. Elle est blanchâtre chez le mâle et rose violacé chez la femelle, à maturité sexuelle.
La troisième partie est constituée d'une fine région « caudale » sans soies ni branchies, incurvée vers l'avant, contre la face ventrale et terminée par l'anus.
Sabellaria spinulosa (Leuckart 1849,) se rencontre de l'Arctique à l'Atlantique. Cette espèce vit plutôt en milieu subtidal* jusqu'à 25 m de fond dans le golfe de Gascogne. Mais il existe des récifs mixtes comprenant les 2 espèces.
Cette espèce est difficilement identifiable en plongée, sauf si on se réfère à la profondeur à laquelle on l'observe.
Un critère anatomique permettant de différencier les deux espèces est observable à la loupe binoculaire : S. spinulosa possède une longue dent médiane barbelée sur les soies externes des pédoncules operculaires (ce que ne possède pas S. alveolata) !
Le mode de nutrition et la nourriture restent assez mal connus ; toutefois, grâce à leurs tentacules ciliés situés autour de la bouche, ces vers collectent des particules fines, du plancton, des diatomées*, etc… (cf. photos n° 7, 10).
Même si leur capacité de filtration est faible, à cause de la forte densité des populations, les récifs constituent, tout de même, d'immenses filtres, au pied desquels l'accumulation des fécès* forme des « biodépôts » non négligeables (cf. photo n° 11).
Elle a lieu presque toute l'année avec toutefois 2 périodes principales de ponte : mars, avril et juin, juillet, août.
Les sexes sont séparés. A maturité, l'abdomen des mâles est blanc, alors que celui des femelles est rose violacé.
Les œufs de 90 microns de diamètre, au nombre de 300 000 à 600 000 par femelle, sont émis et fécondés à l'extérieur des tubes dans l'eau de mer (fécondation externe).
Gamètes mâles et femelles sont émis spontanément dès que les vers sont extraits de leur tube. On peut alors aisément observer la fécondation et les premiers stades de segmentation de l'œuf sous microscope (cf . photos n° 14, 15).
La larve ciliée « trochophore» planctonique est formée 10 heures après la fécondation.
A 2 mois, la larve cylindrique mesure 600 microns de diamètre, et ses 2 paires d'yeux et de tentacules commencent à croître. C'est également à cette période qu'entrent en activité les glandes qui sécrètent le ciment qui agglomèrera les grains de sable du tube ; mais il faudra attendre l'âge de 11 semaines pour que cette larve achève sa vie pélagique.
En effet, à 12 semaines, la jeune Sabellaria alveolata commence sa vie benthique et peut ramper sur le substrat.
C'est à presque 3 mois qu'elle construit un tube muqueux collé sur son support en y agglomérant les grains de sable, ou au début, quelques diatomées et soies perdues.
Le grégarisme* de l'espèce s'expliquerait par la présence d'une substance chimique dans le tube des hermelles adultes, qui attirerait les larves nageuses prêtes à se métamorphoser (attraction des larves par les adultes).
La durée de vie d'une hermelle est assez longue puisqu'elle peut atteindre 3 ans pour 50% de la population, et même 7 à 8 ans pour certains individus !
Les récifs d'hermelles peuvent servir de support aussi bien à des algues qu'à une faune variée et sont d'une grande richesse biologique.
Les algues ne se développent bien que lorsque les constructeurs ont cessé toute activité constructrice.
La microflore, telle que les diatomées, abonde surtout à la base des constructions, sur les dépôts vaseux essentiellement constitués des fécès des hermelles.
Tous les groupes d'invertébrés ont des représentants vivant sur ou dans les récifs d'hermelles, qui présentent de nombreuses fentes et microcavités, sauf en milieu très battu où les tubes se touchent. On y rencontre des cnidaires, vers plats, annélides, mollusques, crustacés, échinodermes, bryozoaires, ascidies...
D'autres hôtes plus mobiles, crevettes, crabes, poissons (blenniidés), viennent aussi y chercher nourriture et abri.
De plus, leurs œufs et larves, très abondants lors de la reproduction, représentent une source de nourriture très appréciée des consommateurs de plancton.
Les hermelles sont très sensibles au froid qui tue les individus et à l'hydrodynamisme qui peut entraîner une destruction ou un ensevelissement des récifs sous les sédiments. Par ailleurs, certaines espèces, comme les crabes, se nourrissent d'hermelles et d'autres, comme les moules, entrent en concurrence avec les hermelles pour la nourriture et l'espace.
Cependant, la principale menace vient de l'Homme. Les pêcheurs à pied peuvent entraîner la destruction des récifs par piétinement. Les installations mises en place par les conchyliculteurs, pieux de bouchots ou tables de parcs à huîtres, peuvent réduire la propagation des courants et des houles. La pêche au chalut peut également dégrader les récifs d'hermelles.
Toutefois, la forte capacité de reproduction de l'espèce et la longue durée de vie larvaire sont favorables à la recolonisation des zones dégradées.
Les récifs d'hermelles constituent un biotope tout à fait particulier qui contribue à protéger nos rivages contre l'érosion, participe à l'équilibre sédimentaire des plages, et enrichit le zooplancton grâce à la quantité énorme des produits génitaux produits.
Il serait donc bienvenu de prendre des mesures de protection pour ces récifs qui « bougent » et sont sensibles aux caractéristiques de l'hydrodynamisme local.
Le banc d'hermelles en baie du Mont Saint Michel bénéficie d'un classement en « gisement coquillier » qui réglemente la pêche à pied et interdit toute forme de dégradation et de destruction des récifs (Article 7 de l'arrêté n° 247 de la D. R. A. M. de Rennes).
Hermelle, traduction d'un nom scientifique non valide. Probablement un diminutif composé à partir du mot grec [herma-] = rocher, écueil, obstacle à la navigation. Référence à la capacité de ce ver de bâtir des récifs.
Sabellaria, du latin [sabulum] = sable, en référence à la nature du tube fabriqué par l'animal.
Le nom d'espèce, alveolata, fait allusion à l'aspect en « nid d'abeilles » avec ses multiples alvéoles, de la surface des récifs d'hermelles.
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Annelida | Annélides | Vers segmentés (annelés) à section cylindrique, à symétrie bilatérale constitués de segments semblables. Le premier segment porte la bouche et le dernier l’anus. Nombreuses formes marines, dulcicoles ou terrestres, libres ou parasites. |
| Classe | Polychaeta | Polychètes | Annélides marines. Chaque segment porte des excroissances locomotrices (les parapodes) plus ou moins développées, munies de touffes de soies chitineuses rigides. Chez la plupart des espèces, la tête porte plusieurs organes sensoriels, des mâchoires, et souvent un panache branchial coloré. Animaux libres dans la colonne d'eau ou sur les sédiments mais aussi galéricoles ou tubicoles. |
| Sous-classe | Sedentaria - Canalipalpata | Annélides polychètes sédentaires - Canalipalpata | Annélides polychètes sédentaires vivant dans des tubes ou des terriers semi-permanents, avec une paire de palpes creusés d'un sillon longitudinal cilié. |
| Ordre | Sabellida | Sabellides | Métamérie très altérée, corps divisé en deux régions distinctes, une thoracique à segments peu nombreux et une abdominale, le plus souvent à segments très nombreux, parfois seulement 3 segments chez les très petites espèces. Prostomium indistinct et peristomium faisant une collerette plus ou moins développée, entière ou divisée en lobes, branchies volumineuses (2 lobes semi-circulaires ou spiralés portant de nombreux filaments ou rayons garnis de barbules ciliées) en panache terminal disposé en entonnoir entourant la bouche. |
| Famille | Sabellariidae | Sabellariidés | Dans des tubes à parois épaisses, constitués de sable ou de gravier coquillier cimentés, parfois aggrégés formant un récif. Corps long et cylindrique divisé en trois régions (tête, abdomen, queue). Une paire de palpes. Nombreux filaments tentaculaires près de la bouche. |
| Genre | Sabellaria | ||
| Espèce | alveolata |
 Annélides Polychètes sédentaires (Sédentaires)
Annélides Polychètes sédentaires (Sédentaires)

Récif en nid d'abeilles
Les populations d’hermelles constituent des « blocs rocheux » pouvant être colonisés par une flore et une faune qui auraient été absentes dans le milieu meuble sableux.
Ile d'Oléron (17), estran
27/01/2008
 Annélides Polychètes sédentaires (Sédentaires)
Annélides Polychètes sédentaires (Sédentaires)

Hermelles colonisant un gisement d'huîtres
Un épi de blocs a d’abord servi de support à la fixation des huîtres puis des hermelles qui utilisent le sable, visible alentour, pour construire leur tube. Les huîtres donnent une idée de la dimension des tubes.
Plage de La Vigne, Bassin d'Arcachon (33), estran
07/02/2008


Hermelles sur les rochers
Sur cette forme du récif en plateau sur milieu rocheux, on remarque de nombreuses cavités pouvant servir d’abri à des crabes ou à des mollusques.
Saint Gilles Croix de Vie (85), estran
08/2007


Récifs en boules
Les pêcheurs à pied doivent prendre des précautions pour ne pas piétiner ou casser les récifs, afin de les épargner.
Plage de Barbâtre, île de Noirmoutiers (85), estran
2003


Impressionnants récifs
L'importance de ces récifs et leur élévation au-dessus du substrat peuvent entraîner une gêne pour la navigation, et justifient l'étymologie du nom français d'hermelle.
Ile de Ré (17)
20/01/2007


Récifs d’hermelles à perte de vue
Ces récifs, avec ceux des Roches de la Fosse de l’ Ile de Noirmoutiers en Vendée, sont les plus étendus et imposants des côtes d’Europe et du nord de l’Afrique. Très dégradés dans les années 70, ils se sont reconstitués par la suite.
Baie du Mont Saint Michel (50), estran
26/05/2002


Détail d'un récif
Des lamellibranches se protègent de la dessiccation dans les cavités existant entre les tubes empilés.
Baie du Mont Saint Michel (50), estran
26/05/2002


Sur la côte languedocienne
Les hermelles sont bien présentes en Méditerranée occidentale.
St Pierre La Mer (11), en surface
22/05/2010


Sur la Côte d'Azur
Sur ces fonds sédimentaires, à l'embouchure d'une rivière, il y a suffisamment de sable en suspension et de courant pour permettre l'installation de grands récifs.
Embouchure de l'Aven, Baie de Bandol (83) 2-5 m
01/09/2014


En Corse
La présence de bio-constructions de ce ver ont été observées prés d'un enrochement sur la très grande plage de sable de sable de la plaine orientale en Corse.
Plage de Taglio-Isolaccio, Corse Est (22), 3 m
23/05/2022


Sur la côte atlantique du Maroc
Présent par plaques de plusieurs m², hors d'eau à marée basse. Malgré une impression de fragilité, cette bioconstruction semble bien résister aux vagues puissantes à marée montante.
Environ de Mirleft, 100 km au sud d'Agadir, côte atlantique du Maroc
06/06/2018


Tentacules alimentaires et déjections
Ce cliché montre, en même temps que les tentacules alimentaires déployés, les petits cylindres d’excréments rejetés par l’anus dirigé vers l’ouverture du tube.
Chez Hortense, Cap-Ferret, Bassin d'Arcachon (33), 2 m
24/05/2008


Individus mâle et femelle extraits de leur tube
Hors de leur tube, les 2 individus montrent au niveau de la tête les 2 pédoncules operculaires et les tentacules alimentaires, ainsi que les 3 régions du corps : la région thoracique porte les soies, la région caudale effilée et, située entre les deux, la région abdominale. Celle-ci est blanchâtre chez le mâle en haut et rose violacé chez la femelle, qui a d’ailleurs émis ses gamètes formant les nappes rosées sur le fond blanc.
L’épingle à tête donne l’échelle.
Récoltés à La Vigne, Bassin d’ Arcachon (33), photo ex-situ
08/06/2008
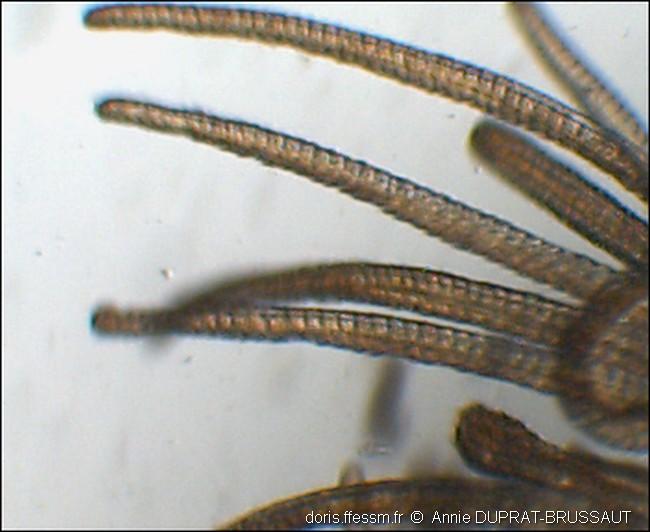
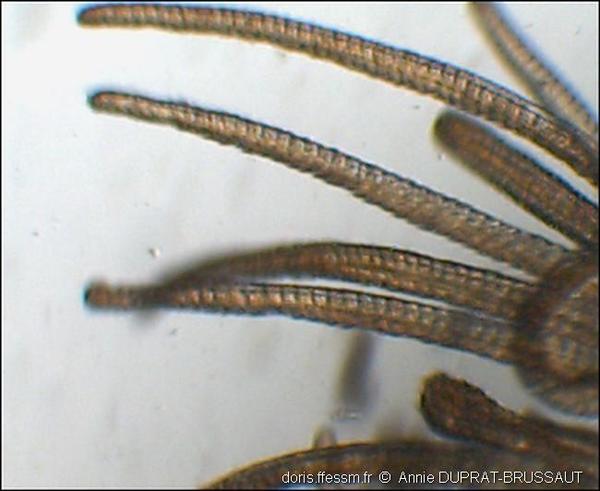
Détail des tentacules alimentaires ciliés
Les mouvements des cils présents sur la face inférieure des tentacules permettent d’amener jusqu’à la bouche les particules fines captées hors du tube par les tentacules souples et mobiles.
Récoltés à La Vigne, Bassin d’ Arcachon (33), photo ex-situ
08/06/2008


Hermelles et leurs excréments
On remarque ici « l’ennoyage » ou l’envasement des tubes par le dépôt des excréments des hermelles.
Ile de Noirmoutiers (85), estran
2003
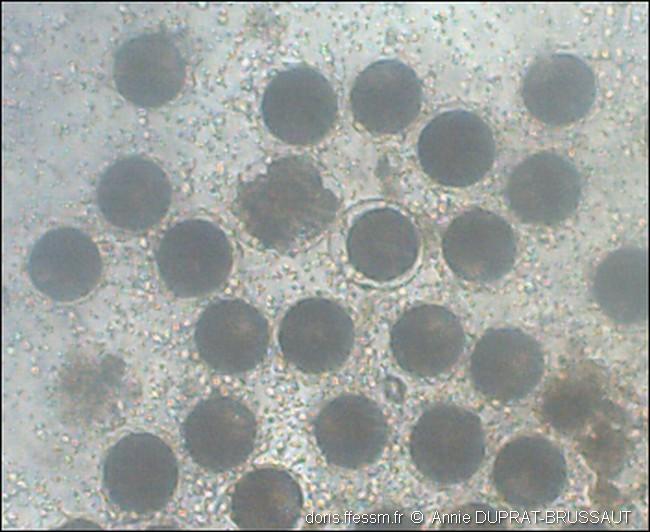
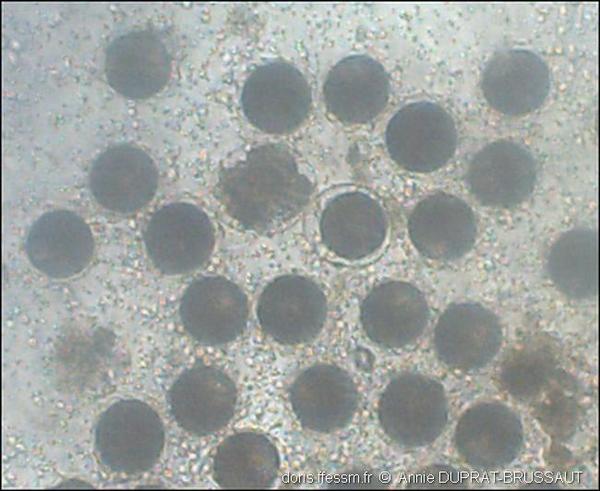
Gamètes et fécondation
Les ovules arrondis et les nombreux spermatozoïdes sont mélangés. Au centre de la photo, l’auréole claire limitée par une membrane autour d’un ovule montre que celui-ci a été fécondé, 10 minutes après le mélange.
Récoltés à La Vigne, Bassin d’ Arcachon (33), photo ex-situ
13/06/2008
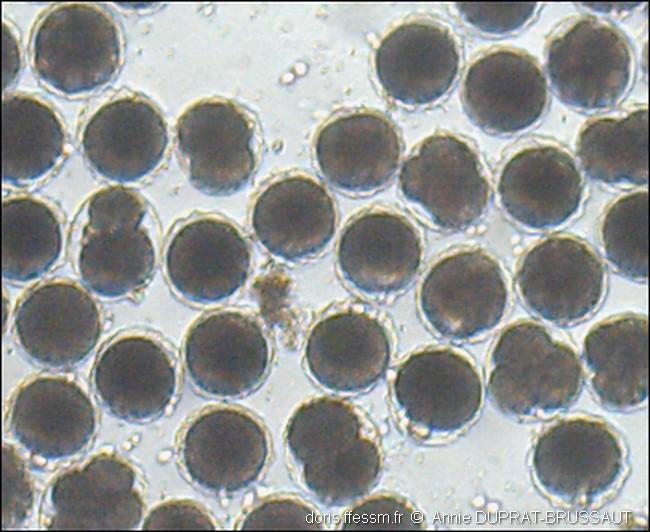
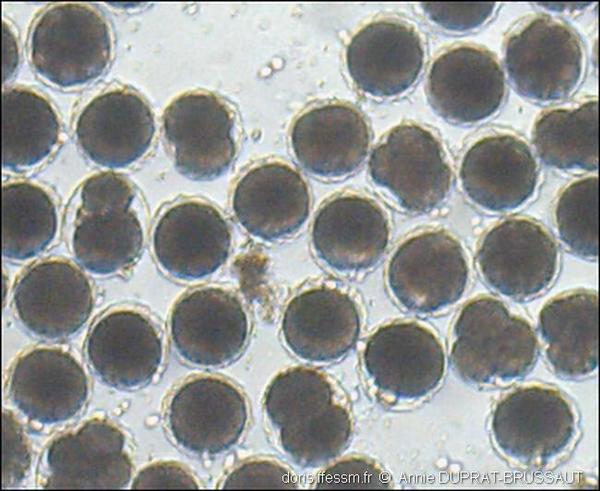
Segmentation des œufs
Dix à douze heures après la fécondation, on peut observer ici différents stades de division des œufs : en 2 ou 4 cellules. En haut à droite de la photo, on voit un petit ensemble de cellules, une morula*, ressemblant à une petite mûre, qui donnera naissance à une larve planctonique.
Récoltés à La Vigne, Bassin d’ Arcachon (33), photo ex-situ
13/06/2008
Rédacteur principal : Annie DUPRAT-BRUSSAUT
Vérificateur : Michel BARRABES
Correcteur : Patrick SCAPS
Responsable régional : Michel BARRABES
Cazaux C., 1970, RECHERCHES SUR L' ECOLOGIE ET LE DEVELOPPEMENT LARVAIRES DES POLYCHETES DE LA REGION D'ARCACHON, Thèse présentée à la Faculté des Sciences de l' Université de Bordeaux, tome 1, texte, 350p.
Dubois S., Retière C., Olivier F., 2002, Biodiversity associated with Sabellaria alveolata (Polychaeta : Sabellariidae) reefs : effects of human disturbances, Journal of the Marine Biological Association of the United Kingdom, 82, 817-826.
Dubois S., 2003, Ecologie des formations récifales à Sabellaria alveolata (L) : valeur fonctionnelle et patrimoniale, Thèse 3ème cycle MNHN.
Porras R., Bataller J. V., Murguie E., Torregrosa M. T., 1996, Trophic structure and community composition of polychaetes inhabiting some Sabellaria alveolata (L.) reefs along the Valencia Gulf coast, western Mediterranean, Marine ecology, 17, 583-602.
La page de Sabellaria alveolata dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.