En surface :
Eau de mer verte ou brune
Odeur assez forte
Mousse ou écume sur l’estran (surtout après un coup de vent)
En plongée :
Visibilité très réduite
Petites sphères de quelques millimètres de diamètre en suspension dans l’eau de mer
Vert de mai, eaux brunes, eaux fleuries, crasse (synonyme d'écume) ou gluant ou limon …
Tobacco juice, baccy juice, fisherman's signs, foul water, stinking water, Dutchman's baccy juice,weedy water, (GB), Schaumalge, Gallertalge, Algenblüte (ce dernier est un nom générique) (D), Schumalg (NL)
Autrefois avec l'orthographe Phœcystis.
Mer du Nord, Manche orientale
Zones DORIS : ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]Cette espèce est présente en mer du Nord (Allemagne, Pays-Bas, Belgique et jusqu'aux côtes du Pas-de-Calais et du Pays de Caux en Manche orientale), mais également en mer Noire, en Floride, au Brésil et au Surinam, en Afrique du Sud, dans le sud de la Chine, en Thaïlande, en Nouvelle-Zélande, en Tasmanie, et dans des îles de l' océan Pacifique (Palau, Galapagos) (Lassus & al. 2016).
Les données actuelles indiquent que Phaeocystis globosa est présente presque partout dans le monde, y compris sous les tropiques, mais peut-être à l'exclusion des pôles.
Les scientifiques ont constaté qu'elle se développait dans une fenêtre de température de 4 à 22 degrés Celsius et dans des eaux enrichies en nutriments (eutrophes*).
L'écume de couleur blanc crème à brunâtre voire grisâtre couvre l'eau (qui peut être verte ou brune) ou est déposée sur les plages et les rochers du littoral par la marée descendante. Cette écume est formée par une mer agitée, de mars à juin selon les années, à partir du mucus algal à la fin des efflorescences (ou blooms*) planctoniques*. Elle peut devenir nauséabonde quand elle est épaisse (elle a pu atteindre voire dépasser 2 mètres là où le vent et le courant l'accumulent).
Les organismes à l’origine de cette écume sont de petites algues unicellulaires, microscopiques, dépourvues de flagelle*. Elles sécrètent une matrice gélatineuse commune formant des colonies flottant librement. Ces colonies gélatineuses, sphériques, non mobiles, peuvent atteindre 8 à 9 mm de diamètre (et sont donc visibles à l’œil nu). Elles peuvent prendre également une forme ovale ou une forme de saucisse. Les cellules (d’environ 6 µm de diamètre) non flagellées, de couleur jaune-brun pâle sont uniformément réparties à la périphérie de la colonie (environ 10 000 cellules par colonies).
Le stade non colonial est représenté par des algues unicellulaires isolées (3 à 7 µm de diamètre) plus ou moins sphériques, munies de deux flagelles et d’un haptonème (appendice filiforme translucide plus ou moins long). Elles sont visibles uniquement au microscope. Trois types de cellules différentes peuvent être distingués, au microscope, par les spécialistes.
Selon WoRMS, il y aurait 10 espèces décrites de Phaeocystis, mais seules huit sont reconnues et trois espèces seulement présentent un stade colonial, les cellules des autres espèces sont solitaires.
Les espèces coloniales sont : Actuellement, il existe deux espèces méditerranéennes (P. cordata et P. jahnii), mais elles ne produisent pas de colonies comme les précédentes.
Ces algues microscopiques possèdent deux chloroplastes* qui leur permettent d’effectuer la photosynthèse* en présence de lumière et des mitochondries (centrales énergétiques de la cellule) qui assurent la respiration à l'obscurité.
En présence de lumière, les cellules de la colonie sécrètent l'enveloppe gélatineuse. Les polysaccharides composant cette enveloppe seraient utilisés par les cellules pendant la période d'obscurité, ce qui permet à ces cellules de continuer à croître.
La présence de bactéries dans des vacuoles* de phagocytose de P. globosa ainsi que des analyses bioinformatiques à partir de données de génomique et de transcriptomique de plusieurs espèces d'Haptophytes laissent supposer que plusieurs (mais pas toutes) souches de P. globosa et de P. antarctica peuvent mettre en place une stratégie d’alimentation mixotrophe (les organismes pratiquant la mixotrophie sont autotrophes* -par la photosynthèse- aussi bien que hétérotrophes* consécutivement ou simultanément).
Les Phaeocystis avec un stade colonial comme P. globosa ont un cycle de vie complexe avec deux phases principales bien distinctes :
Une proposition de cycle est visible dans l'iconographie de cette fiche.
Ces micro-algues sont aussi impliquées dans des symbioses*, par exemple avec l'organisme unicellulaire Lithoptera fenestrata, un acanthaire (Sardet 2013 et 2023).
A l’intérieur des colonies de P. globosa, Scherffel a observé le dinoflagellé Oxyrrhis phaeocysticola Scherffel,1900.
Quelques espèces de diatomées* utilisent les colonies de Phaeocystis en tant qu'habitat mais aussi la gangue muqueuse comme substrat* de croissance (Sahzin, 2007).
De jeunes colonies de Phaeocystis commenceraient leur croissance accrochées aux soies* des diatomées du genre Chaetoceros.
C’est le seul organisme du phytoplancton*
connu pour être capable de devenir très rapidement l’espèce dominante d'un écosystème*.
Les colonies de P. globosa sont caractéristiques des zones eutrophes* et rares dans les colonnes d'eau stratifiée. La mer du Nord, de faible profondeur, est brassée du fond à la surface par les tempêtes d'hiver et n'est donc pas stratifiée.
Lors des efflorescences, on peut dénombrer de 1 à 100 millions de cellules par litre d'eau de mer (voire 4 milliards en août 2001 aux Pays-Bas).
Les efflorescences de P. globosa se développent après les multiplications des populations de diatomées* (printemps phytoplanctonique). Ces dernières sont à l'origine du processus d'épuisement des nutriments (l'azote et le phosphore plus particulièrement).
Du fait de la grande taille des colonies de P. globosa, les consommateurs de phytoplancton comme les copépodes* et les organismes unicellulaires hétérotrophes* peuvent difficilement les manger. Ces organismes ne peuvent donc pas participer à la limitation du développement de l'efflorescence.
Phaeocystis inhibe l’essor des autres organismes
par l’utilisation massive des nutriments et par excrétion de substances
nuisibles aux autres êtres vivants.
Après épuisement complet des nutriments, les colonies se déforment et commencent à se désintégrer. C'est alors la fin du printemps phytoplanctonique. Une partie tombe sur le fond et une autre est attaquée et consommée par de nombreux micro-organismes : virus spécifiques (provoquant la lyse des cellules), protozoaires* ciliés (comme Strombidium sulcatum), dinoflagellés (comme Gymnodium spp.), etc...
La sédimentation des colonies sur le fond marin peut entraîner un appauvrissement en oxygène (consommé par des bactéries) et la mort des organismes benthiques*.
Lors de la décomposition, en pleine eau, il y a libération de matière organique dissoute riche, entre autres, en mucopolysaccharides. Lors d'une tempête, le vent et l'agitation des vagues déferlantes vont favoriser la formation de la mousse qui se déposera sur le littoral.
La première observation de P. globosa, en mer du Nord, à Heilgoland (archipel du nord de l'Allemagne), a été faite par Scherffeln en 1893.
Une efflorescence a été observée en 1923, devant l’estuaire de la Tamise (Royaume-Uni).
Dans le sud de la mer du Nord et en Manche orientale, depuis 1977, les efflorescences ont lieu pratiquement tous les ans de mars à juin et certaines années un petit peu en octobre.
Les efflorescences dans le sud de la mer du Nord seraient liées aux importants apports fluviaux de sels nutritifs, à l'augmentation de la durée du jour et de la température.
Des observations de
poissons comme les harengs (Clupea harengus) ou les maquereaux (Scomber scombrus) évitant les zones d'efflorescences sont
citées par l'Ifremer et des effets nuisibles sont observés par les conchyliculteurs.
Les fortes
pullulations gênent la pêche, surtout au filet fixe. Les fileyeurs sont plus gênés
que les pêcheurs au chalut, notamment à cause du colmatage des filets fixes et des filets
à mailles fines. Pour la pêche à la crevette en particulier, les filets
sont colmatés ou alourdis par les mucilages* algaux. Par ailleurs, les crépines de prise d'eau
de refroidissement des moteurs tendent à se boucher. Les pêcheurs signalent que
le phénomène est de plus en plus précoce et long, et que le poisson pêché dans
ces filets est anormalement gluant et malodorant et doit être
lavé.
Prolifération et coloration des eaux peuvent
s’accompagner de mortalité importante de poissons (en Chine, en 1999).
Les colonies de Phaeocystis à l'origine des efflorescences produisent également de grandes quantités d'une molécule soufrée comme le diméthylsulfide (ou DMS). Cette molécule diffuse dans l'air et intervient dans le cycle global du soufre, lequel permet la nucléation des gouttes d'eau et la formation d'une grande partie des nuages qui contribuent à la régulation climatique et aux pluies. En augmentant les pluies, ce type de phénomène peut se traduire par une augmentation du lessivage des terres et donc d'une augmentation de l'eutrophisation* des eaux littorales.
Mousse de mai : une des dénominations donnée par les marins pêcheurs.
Phaeocystis : du grec [phaeo- ou phaios] = sombre, brun-verdâtre et du grec [cysti- ou kistis] = vessie, sac, cellule.
globosa : du latin [globosa] = sphérique, rond.
pouchetii : le phycologue (botaniste spécialisé dans l’étude des algues) français Paul Auguste Hariot a décrit cette espèce en 1892 (alors sous le nom deTetraspora pouchetii) en la dédiant au biologiste marin et anatomiste français Georges Pouchet (1833-1894) qui lui avait donné des échantillons provenant des environs des îles Lofoten et des îles Feroe. Il s’agit de la première espèce de Phaeocystis observée et étudiée. Toutefois, le genre Tetraspora appartient à la classe des Chlorophycées (algues vertes, embranchement des Chlorophytes = plantes vertes). En 1893, le phycologue suédois Nils Gustaf Lagerheim (1860-1926) en étudiant ces organismes a précisé que ce taxon appartenait plutôt à un autre embranchement (les Haptophytes), une autre classe (les Coccolithophycées) et à une autre sous-classe (les Prymnesiophycidées) et il a créé le genre Phaeocystis.
Numéro d'entrée WoRMS : 160538
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Haptophyta | Haptophytes | |
| Sous-embranchement | Haptophytina | Haptophytinés | |
| Classe | Coccolithophyceae | Coccolithophycés | |
| Sous-classe | Prymnesiophycideae | Prymnesiophycidés | |
| Ordre | Phaeocystales | Phaeocystales | |
| Famille | Phaeocystaceae | Phaeocystacées | |
| Genre | Phaeocystis | ||
| Espèce | globosa |
 Diatomées et autre phytoplancton
Diatomées et autre phytoplancton

En pleine eau
Le long du mouillage du bateau, le flash éclaire les colonies de Phaeocystis globosa.
Dunkerque (59)
1995
 Diatomées et autre phytoplancton
Diatomées et autre phytoplancton

En plongée
Le flash a éclairé les colonies sphériques de Phaeocystis globosa.
Epave du Havant, Dunkerque (59), 20 m
11/03/2012


Visibilité
Sans flash, lors de la remontée. Les colonies sphériques limitent la visibilité.
Sur l'épave du Brighton Queen, Dunkerque (59), 5 m.
27/05/2020
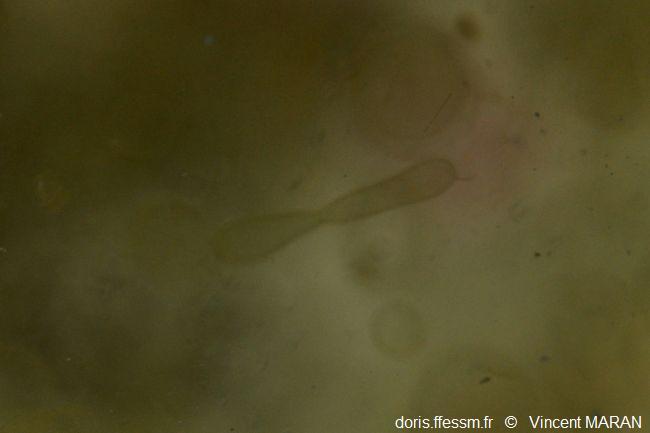
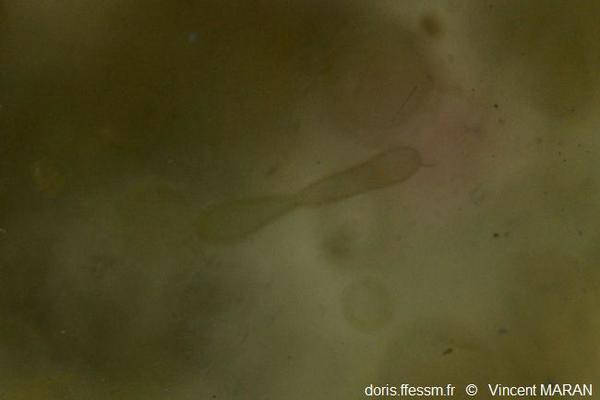
En plongée au large
Colonie en forme de saucisse.
En plongée, agrandissement d'une photo, les Ridens au large de Boulogne (62), 26 m
14/04/2012
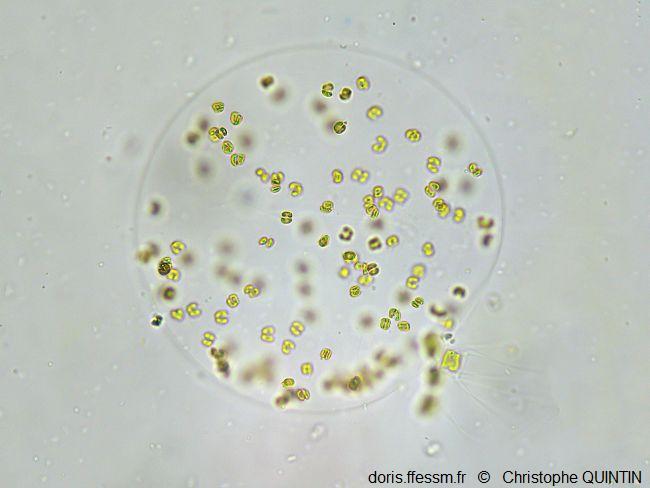
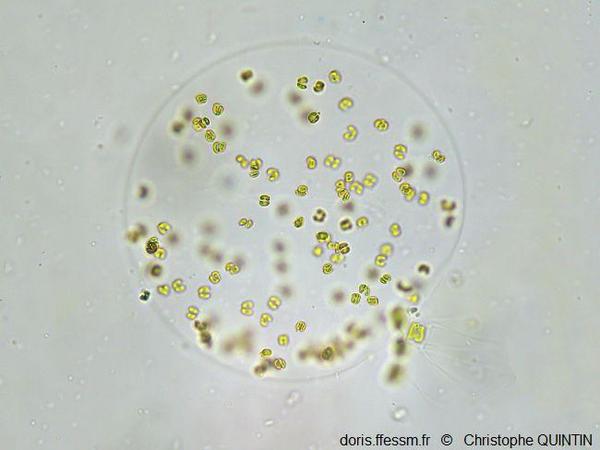
Une sphère vue au microscope
Les cellules de cette jeune colonie sont distribuées à la périphérie de la sphère. En bas à droite on devine la présence d'une diatomée (probablement du genre Chaetoceros). Les colonies se forment probablement à partir de cellules solitaires, que l’on trouve souvent attachées aux soies des Chaetoceros.
Photographie au microscope (grossissement x400), Binic (22)
08/2023


En surface
L'eau de mer est bien verte. En bas à droite, un peu de la vague d'étrave du bateau.
Au large de Dunkerque (59)
20/05/2001


Sur la plage après un petit coup de vent
Quelques masses d'écume sont poussées par le vent.
Sur la plage à Dunkerque (59)
01/05/1999


Sur la plage après une tempête
Le haut de la plage est recouvert d'écume mal odorante.
Plage de Dunkerque (59)
mai/1999


Après le retrait de la mer
Quelques jours après un bel épisode d'efflorescence.
Plage de Leffrinckoucke (59)
06/04/2010



Sur un estran rocheux
Accumulation de mousse après une tempête.
Ambleteuse (62)
06/06/2015


Avec une Coryphelle
En haut à gauche, deux sphères transparentes de Phaeocystis globosa sont visibles
Haut-fond des Ridens (62), 26 m.
14/04/2012
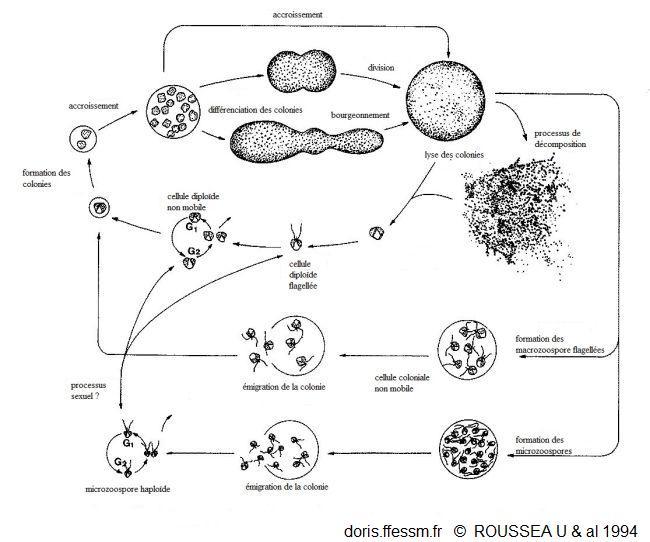
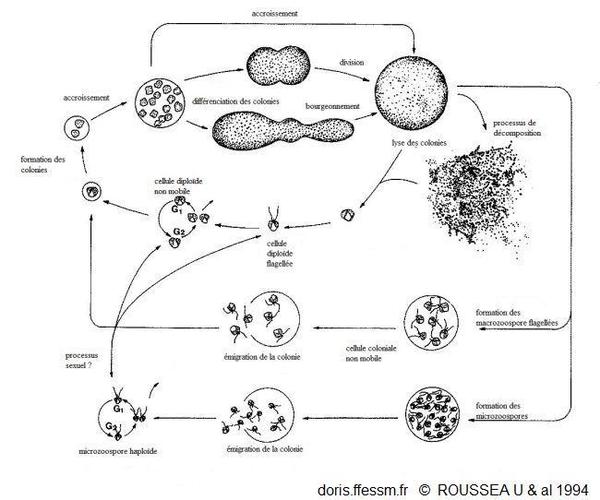
Cycle de vie de Phaeocystis
Situation actuelle du cycle de vie de Phaeocyistis globosa d'après des observations en culture et sur le terrain.
(diploïde = 2 jeux de chromosomes et haploïde = 1 seul jeu de chromosome (comme nos cellules sexuelles).
Figure 9, page 36, Rousseau & al. 1994, The life cycle of Phaeocystis (Prymnesiophycaea): evidence and hypotheses
Reproduction de documents anciens
1994
Rédacteur principal : Yves MÜLLER
Rédacteur : Vincent MARAN
Vérificateur : Jean-Luc MOUGET
Responsable régional : Yves MÜLLER
Bätje M., Michaelis H., 1986, Phaeocystis pouchetii blooms in the East Frisian coastal waters (German Bight, North Sea), Marine Biology, 93(1), 21-27.
Broutin M., Artigas L.F., Prygiel J., Lesniak C., Lefebvre A., XXXX, Les blooms à Phaeocystis globosa, poster, 2p.
Brussaard C.P.D., Bratbak G., Baudoux A., Ruardij P., 2007, Phaeocystis and its interaction with viruses, Biogeochemistry, 83, 201-215.
Cadée G.C., Hegeman J., 1986, Seasonal and annual variation in Phaeocystis pouchetii (Haptophyceae) in the westernmost inlet of the Wadden Sea during the 1973 to 1985 period, Netherlands Journal of Sea Research, 20(1), 29- 36.
Drebes G., 1974, MARINE PHYTOPLANKTON, Georg Thieme Verlag, 186p.
Grossel H., 1984, Le milieu marin, un milieu vivant et fluctuant : perception par les populations littorales du Nord de la France d’un phénomène planctonique caractérisé, Colloque national « Le littoral, milieux et sociétés » Société d’Ethnologie Française, 1-6.Jahnke J., Baumann M., 1987, Differentiation between Phaeocystis pouchetii (Har.) Lagerheim and Phaeocystis globosa Scherffel, I. Colony shapes and temperature tolerances, Hydrobiological Bulletin, 21, 141-147.
Koppelle S., López-Escardó D., Brussaard C.P.D, Huisman J., Philippart C.J.M, Massana R., Wilken S., 2022, Mixotrophy in the bloom-forming genus Phaeocystis and other haptophytes, Harmful Algae, 117.
Kornmann P., 1955, Beobachtungen an Phaeocystis-Kulturen, Helgoländer Wissenschaftliche Meeresuntersuchungen, 5, 218-233.
Lagerheim
G., 1893, Phæocystis, nov. gen., grundadt på Tetraspora
Poucheti Har., Botaniska Notiser, 32–33.
Lamy D., 2006, Dynamique bactérienne en Manche orientale - Relation avec les poussées de Phaeocystis globosa, Thèse, Université du Littoral Côte d’Opale, 387p.
Lancelot C., Billen G., Sournia A., Weisse T., Colijin F., Veldhuis M.J.W., Davies A., Wassman P., 1987, Phaeocystis blooms and nutrient enrichment in the continental coastal zones of the North Sea, AMBIO, 16(1), 38-46.
Lancelot C., Wassmann P., Barth H., 1994, Ecology of Phaeocystis dominated ecosystems, Journal of Marine Systems, 5(1), 1-4.
Lassus P., Chomérat N., Hess P., Nézan E., 2017-2016, Toxic and harmful microalgae of the world ocean. Micro-algues toxiques et nuisibles de l'océan mondial, I.O.C. Manuals and guides, 68 (Bilingual English/French). pp. 1-523, 54 pls. Denmark: International Society for the Study of Harmful Algae/ Intergovernmental Oceanographic Commission of UNESCO.
Lefebvre A., Delpech J-P., 2004, Le bloom de Phaeocystis en Manche orientale : nuisances socio-économiques et/ou écologiques?, Centre IFREMER - Manche Mer du Nord, 36p.
Peperzak L., 2002, The wax and wane of Phaeocystis globosa blooms, Thesis, University of Groningen, 254p.
Rousseau V., Vaulot D., Casotti R., Cariou V., Lenz J., Gunkel J., Baumann M., 1994, The life cycle of Phaeocystis (Prymnesiophycaea): evidence and hypotheses, Journal of Marine Systems, 5(1), 23-39.
Sazhin A., Artigas L.F., Nejstgaard J.C., Frischer M.E., 2007, The colonization of two Phaeocystis species (Prymnesiophyceae) by pennate diatoms and other protists: a significant contribution to colony biomass, Biogeochemistry, 83, 137–145.
Scherffel A., 1899, Phaeocystis globosa n. sp. (Vorläufige Mittheilung). Berichte der Deutschen Botanische Gesellschaft, 17, 317-318.
Scherffel A., 1900, Phaeocystis globosa nov. spec. nebst einigen Betrachtungen über die Phylogenie niederer, insbesondere brauner Organismen, Wissenschaftliche Meeresuntersuchungen, Abteilung Helgoland 4, 1-29, figs 80, 81.
Schmitt F.G., Landry Y., Revillion M., Gentilhomme V., Borde C., Herbert V., 2011, Blooms de Phaeocystis sur la Côte d’Opale : investigations historiques, in Observation des écosystèmes marin et terrestre de la Côte d’Opale : du naturalisme à l’écologie, Schmitt F.G. (coord.), Union des océanographes de France,183-195.
Sournia A., Belin C., Berland B., Erard-Le Denn E., Gentien P., Grzebyk D., Marcaillou-Le Baut C., Lassus P., Partensky F., 1991, Le phytoplancton nuisible des côtes de France. De la biologie à la prévention, Programme national "Efflorescences algales marines", Ifremer / Centre National de la Recherche Scientifique, 155p.
Veldhuis M.J.W., Colijn F., Venekamp L.A.H., 1986, The spring bloom of Phaeocystis pouchetii (Haptophyceae) in Dutch coastal waters, Netherlands Journal of Sea Research, 20(1), 37-48.
Vong L., 2012, De la mousse sur les plages du Nord - Pas de Calais…, Phaeocystis globosa, Note scientifique n° 2 - 1p.
La page de Phaeocystis globosa dans l'Inventaire National du Patrimoine Naturel : INPN
La page de Phaeocystis globosa sur le site de référence pour les algues : Algaebase
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.