Taille de 1 à 2 cm, de couleur brune ou brun-vert
Tête avec 2 paires d'antennes dont la première est nettement plus courte que la seconde
Antennes d’aspect relativement lisse
Dernier article du pédoncule des antennes 2 à peine plus long que l’avant-dernier article
Yeux noirs, ronds
Corps aplati latéralement et arqué ventralement
7 paires de péréiopodes thoraciques dont les 3 dernières sont de sens opposé aux 4 premières
3 paires de pléopodes abdominaux
Puce de mer, Orchestie (Canada) (noms donnés également au talitre).
Orchestia laevis
Eaux européennes et côtes nord-américaines
Zones DORIS : ● Europe (côtes françaises), ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ○ [Méditerranée française]Orchestia mediterranea se rencontre sur les côtes de l’Atlantique Est, depuis la Grande Bretagne jusqu’à l’Espagne. Elle est également rencontrée en Méditerranée.
Orchestia mediterranea se rencontre sur le haut de l’estran*, parmi la laisse de mer* ou sous les pierres, mais on peut également la rencontrer en eaux peu profondes. Elle peut fréquenter les estuaires, mais se limite aux concentrations en sel de l’ordre de 6 à 8 pour mille.
Les Orchestia sont des espèces indicatrices de l’habitat EUNIS 1140-2 – Galets et cailloutis des hauts de plage à Orchestia (façade atlantique).
Ce petit crustacé est de couleur généralement brune, sa taille peut atteindre deux centimètres. Le corps est comprimé latéralement et un peu arqué ventralement.
La tête porte deux paires d’antennes*, la première étant nettement plus courte que la seconde (atteignant approximativement l’extrémité du pédoncule* de l’article 4 de l’antenne 2). Les yeux, noirs, sont bien ronds. Il n’y a pas de flagelle* accessoire sur la paire d’antennes 1.
Le thorax porte sept paires de pattes (les péréiopodes*) :
- les deux premières paires sont préhensiles, ce sont les gnathopodes**,
- en cas d'immersion, la troisième et la quatrième paires s'agitent sans arrêt pour amener l'eau aux branchies situées sur la face ventrale du thorax,
- les trois dernières paires servent à la marche.
L'abdomen porte 3 paires d'appendices (les pléopodes*) aplatis et garnis de soies*. Ils servent à la nage et à la ventilation des œufs fécondés.
L’extrémité du corps, l’urosome*, est constitué de trois segments portant chacun une paire d’uropodes*, qui servent à sauter. Les uropodes sont biramés, à l’exception du dernier qui ne comporte qu’une seule branche.
Le telson* porte de petites épines dorsales.
Au microscope : chez Orchestia mediterranea, les pléopodes ont une allure relativement élancée et le pédoncule représente environ la moitié de la longueur totale.
Il est possible d’identifier les mâles à l’observation des gnathopodes 2, fortement hypertrophiés. Chez cette espèce, la paume des gnathopodes est sinueuse.
Chez les Orchestia mâles âgés, le mérus et le carpe du péréiopode 7 (le dernier) s’élargissent de manière importante.
La famille des Talitridés comporte de nombreuses espèces qui présentent le même habitus (aspect extérieur). Dans cette famille, les antennes* 1 sont très courtes, et démunies de flagelle* accessoire, tandis que les antennes 2 ont une taille plus habituelle. Les yeux sont bien ronds. La distinction entre ces espèces n’est souvent pas simple.
Orchestia mediterranea est principalement un détritivore*, consommant des végétaux divers échoués sur l’estran*. Ces animaux peuvent également se nourrir de déchets animaux. Ils jouent un rôle important dans le recyclage de la matière organique. Natalia Dias et al. (2005) ont montré que, lorsque le choix de nourriture leur est laissé, les Orchestia s’alimentent en priorité à partir d’algues vertes, puis à partir d’animaux morts, puis de spartines et de feuilles fraîches de zostères, et en dernier ressort de feuilles décomposées de zostères. Cette étude portait également sur l’analyse comparative du rythme d’ingurgitation des amphipodes par rapport aux isopodes présents dans les prés salés. Les amphipodes (dont Orchestia gammarellus et Orchestia mediterranea) ont un rythme alimentaire beaucoup plus élevé que les isopodes (2 fois plus élevé pour la consommation des algues vertes, 4 fois plus élevé pour la consommation d’animaux morts, 8 fois plus élevé pour la consommation de spartines). Leur rythme de croissance relative est, en conséquence, beaucoup plus élevé, Orchestia mediterranea surpassant sur ce point Orchestia gammarellus, avec un taux de croissance relative deux fois plus élevé.
Orchestia mediterranea est gonochorique*. Le dimorphisme* sexuel est particulièrement marqué au niveau des gnathopodes* 2, beaucoup plus imposants chez les mâles que chez les femelles. Les femelles en âge de procréer développent des oostégites*, sortes de membranes situées à la base des péréiopodes* et qui permettent de maintenir les œufs et les larves* au sein de la poche marsupiale. Chez Orchestia mediterranea, les oostégites* comportent des soies* sur leur face interne. Il n’est pas rare de rencontrer des individus présentant simultanément des caractères sexuels propres aux deux sexes (intersexualité). Cette intersexualité est plus fréquente chez les mâles, qui portent alors des oostégites ou ont des gnathopodes atrophiés.
Les gnathopodes hypertrophiés sont utilisés par les mâles, légèrement plus grands que les femelles, pour s’accrocher sur le dos de la femelle avant l’accouplement (gardiennage pré-copulatoire), après la mue de cette dernière. Au moment de l’accouplement, le mâle bascule sur le ventre de la femelle et dépose son sperme dans la poche marsupiale face à la sortie des oviductes, au niveau du cinquième segment thoracique. Le mâle reprend ensuite sa position dorsale et stimule la femelle avec sa seconde paire de gnathopodes. Il quitte ensuite la femelle qui pond immédiatement après. Au moment de la ponte, les œufs sont enveloppés dans un sac muqueux qui disparaît rapidement et qui joue probablement un rôle dans la fécondation des œufs. Les œufs se développent dans la poche marsupiale et donnent naissance à des larves*. Les larves restent au sein de la poche marsupiale durant leurs premières phases de développement.Orchestia mediterranea peut être parasité par le protiste* Paramarteilia orchestiae qui induit l’apparition d’intersexualité chez les mâles, voire les transforme en femelles parfaitement fonctionnelles (on parle alors de thélygénie, la descendance des femelles infectées n’étant constituée que de femelles). La thélygénie de Orchestia mediterranea est sensible à la température et disparaît lorsque les femelles sont élevées au-dessus d’une température critique. Ce parasitisme conduit donc à déséquilibrer davantage le sex-ratio des populations, en faveur des femelles.
Un autre parasite classique de Orchestia mediterranea est la microsporidie (un champignon) Dictyocoela gammarellum, qui pourrait être en réalité un hyperparasite de Paramarteilia orchestiae. Un long débat scientifique a eu lieu sur la capacité de cette microsporidie à induire la féminisation des Orchestia (ces champignons sont en effet connus pour cette propriété chez d’autres espèces). Les travaux expérimentaux de James Pickup et Joseph Edward Ironside (2017) ont conclu par la négative, mais le débat n’est semble-t-il pas encore clos et Orchestia mediterranea pourrait donc être « bénéficiaire » de deux parasites féminisants.
Cette espèce est caractéristique de l'habitat Biocénose des laisses à dessiccation lente en contact avec les salicornes du supralittoral* méditerranéen.
Compte tenu de son abondance, Orchestia mediterranea joue un rôle important dans le réseau trophique* de nombreuses espèces, qu’elles soient aquatiques (O. meditteranea peut constituer la majeure partie de l’alimentation des bars juvéniles dans certaines zones) ou terrestres (les oiseaux en particulier).
Les Orchestia, comme les autres Talitridés, sont capables de se mouvoir dans l’eau en nageant et de se déplacer hors de l’eau en sautant. Le mouvement natatoire repose sur un mouvement métachronal des pléopodes (c’est-à-dire avec un léger décalage dans le temps du déplacement de chaque paire) conjugué à un mouvement vertical de la « queue » (abdomen et urosome*). Des études conduites sur deux espèces de Talitridés (Talitrus saltator et Cryptorchestia garbinii) et une espèce de Hyalidés (Hyale nilssoni, aujourd’hui appelé Apohyale prevostii) ont montré que les espèces présentant les meilleures capacités de saut sont les moins bonnes nageuses. Les performances respectives sont liées aux habitats préférentiels de chaque espèce (une espèce à prédominance semi-terrestre comme Talitrus saltator aura de meilleures capacités de saut). Sur ce point, la comparaison entre les pléopodes* de Orchestia gammarellus et de Orchestia mediterranea montre que cette dernière espèce est plus adaptée à la nage (longueur des rami). En aquarium, il est possible d’observer une différence de comportement entre les deux espèces : Orchestia gammarellus se maintiendra droit pour se déplacer, tandis que Orchestia mediterranea tendra naturellement à prendre la posture des Gammaridés, espèces typiquement aquatiques, avec un déplacement du corps à l’horizontal. Par ailleurs, il est possible de retrouver Orchestia mediterranea dans des algues dérivantes, ce qui n’est presque jamais le cas de Orchestia gammarellus (qui ne montre aucun attrait pour des algues flottantes maintenues dans l’aquarium où l’espèce est maintenue).
Le niveau de salinité a un impact sur la fréquence des mues*. Ces dernières s’espacent lorsque la salinité décroit, ce qui conduit une vitesse de croissance plus faible.
Orchestia mediterranea vit entre 12 et 18 mois.
Comme pour la plupart des autres espèces de la famille des Talitridés, les populations de cette espèce sont menacées par les activités touristiques et l'hyper fréquentation des plages en été. Le criblage des laisses de mer est en particulier néfaste à de nombreux Talitridae.
Orchestie de Méditerranée : le nom français proposé est directement issu du nom scientifique.
Le nom de genre Orchestia provient directement du grec ancien [Orchestra/Orchestria] = danseur, allusion directe aux sauts de ces animaux lorsqu’ils sont dérangés.
Le nom d’espèce mediterranea provient du nom latin [mediterranea] de la mer Méditerranée, où cette espèce a été observée la première fois, à Naples, par le naturaliste italien Achille Costa (1828-1898).
Numéro d'entrée WoRMS : 103208
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Arthropoda | Arthropodes | Animaux invertébrés au corps segmenté, articulé, pourvu d’appendices articulés, et couvert d’une cuticule rigide constituant leur exosquelette. |
| Sous-embranchement | Crustacea | Crustacés | Arthropodes à exosquelette chitineux, souvent imprégné de carbonate de calcium, ayant deux paires d'antennes. |
| Super classe | Multicrustacea | ||
| Classe | Malacostraca | Malacostracés | 8 segments thoraciques, 6 segments abdominaux. Appendices présents sur le thorax et l’abdomen. |
| Sous-classe | Eumalacostraca | Eumalacostracés | Présence d’une carapace recouvrant la tête et tout ou partie du thorax. |
| Super ordre | Peracarida | Péracarides | Les femelles sont dotées d'une cavité d'incubation formée par des expansions lamelleuses des péréiopodes. |
| Ordre | Amphipoda | Amphipodes | Péracarides comprimés latéralement, dépourvus de carapace, et possédant de nombreuses paires d'appendices souvent modifiés. Ils sont représentés par les gammares, les talitres, les caprelles... |
| Sous-ordre | Senticaudata | ||
| Famille | Talitridae | Talitridés | |
| Sous-famille | Talitrinae | Talitrinés | |
| Genre | Orchestia | ||
| Espèce | mediterranea |
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Vue d’ensemble
Vue d’ensemble d’un individu capturé sous des blocs rocheux en haut de plage. Il s’agit de Orchestia mediterranea. L’individu s’est réfugiée dans une algue placée dans l’aquarium où elle était maintenue, comportement qu’on ne verra pas chez Orchestia gammarellus.
Macrophotographie rapport 1:1 – Individu capturé, Binic-Etables-sur-mer (22)
23/12/2022
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Vue de profil d’un individu
Cette photographie de profil d'Orchestia mediterranea permet de voir nettement les yeux ronds et les 2 paires d’antennes, la paire 1 étant nettement plus courte que la paire 2. La posture prise par le dernier péréiopode (relevé) est classique chez les amphipodes sauteurs.
Macrophotographie rapport 1:1 – Individu capturé sous des blocs rocheux et maintenu en aquarium, Binic-Etables-sur-mer (22)
23/10/2022


Vue de dessus
Cette photographie de profil d'Orchestia mediterranea permet également de voir nettement les yeux ronds et les 2 paires d’antennes, la paire 1 étant nettement plus courte que la paire 2. La posture prise par les dernière paires de péréiopodes (relevés) est classique chez les amphipodes sauteurs.
Macrophotographie rapport 1:1 – Individu capturé sous des blocs rocheux et maintenu en aquarium, Binic-Etables-sur-mer (22)
23/10/2022


Vue de face de Orchestia mediterranea
La vue de face de cet individu d'Orchestia mediterranea permet de différencier les Orchestia de Talitrus saltator. Chez ce dernier, la position des yeux donne l’impression que l’animal louche lorsqu’on le regarde de face, ce qui n’est pas le cas des autres Orchestia.
Macrophotographie rapport 1:1 – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
23/12/2022
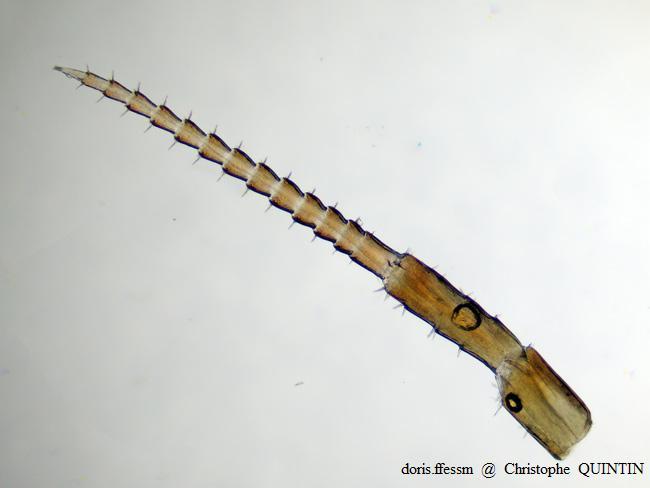
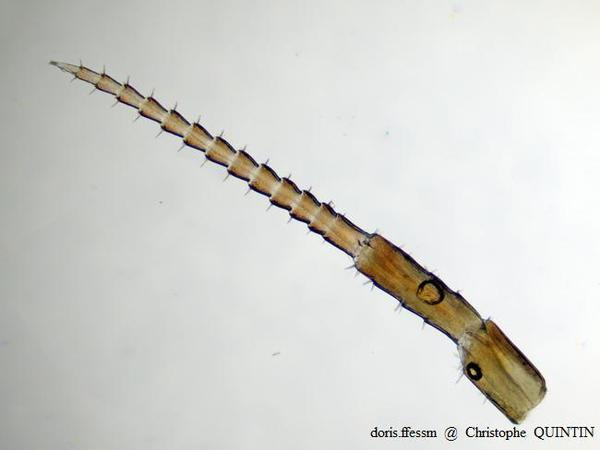
Vue au microscope de l’antenne 2 de Orchestia mediterranea
Les flagelles des antennes des Orchestia, bien que munis de nombreuses soies, présentent un aspect plus lisse que celles de Talitrus saltator. Ils sont aussi proportionnellement plus courts.
Photographie au microscope – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
15/10/2022
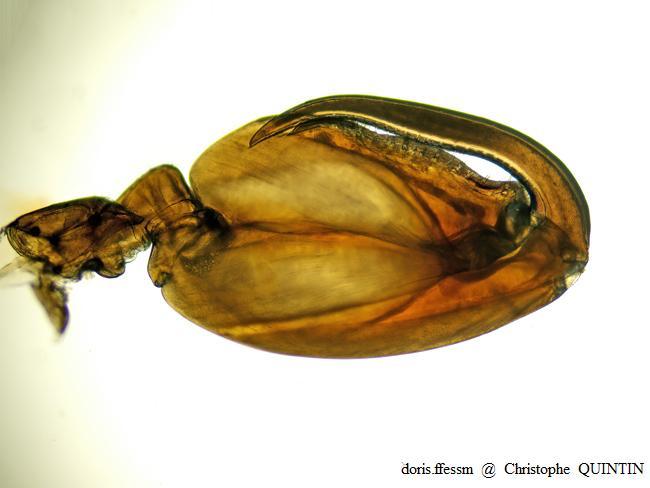
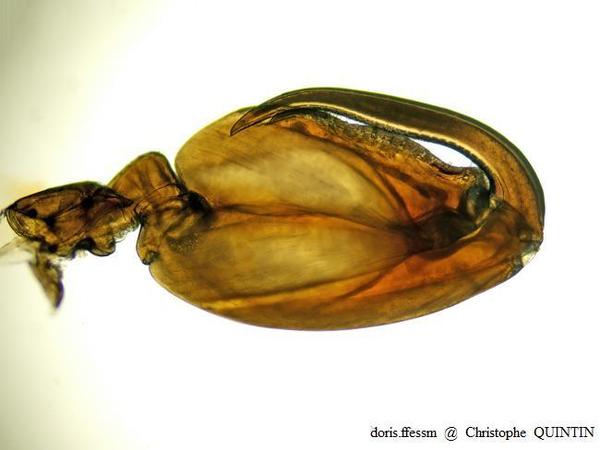
Vue au microscope du gnathopode 2 d’un mâle de Orchestia mediterranea
Chez les mâles de Orchestia mediterranea, la paume (partie du gnathopode qui fait face au dactyle) présente un aspect sinueux. On peut observer une bosse près de l’articulation entre dactyle et propode.
Photographie au microscope – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
23/12/2022
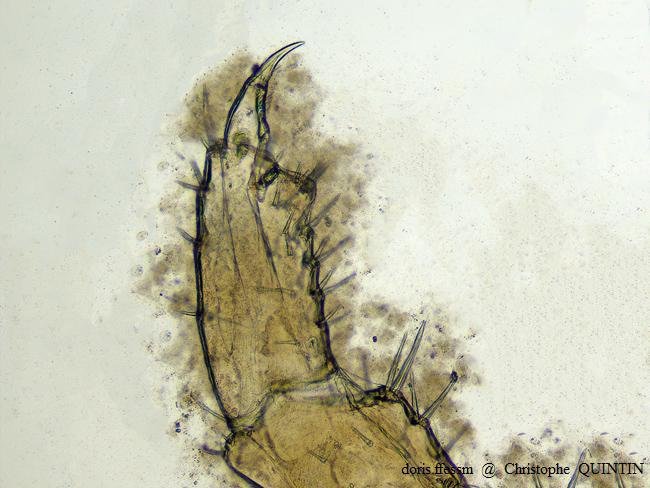
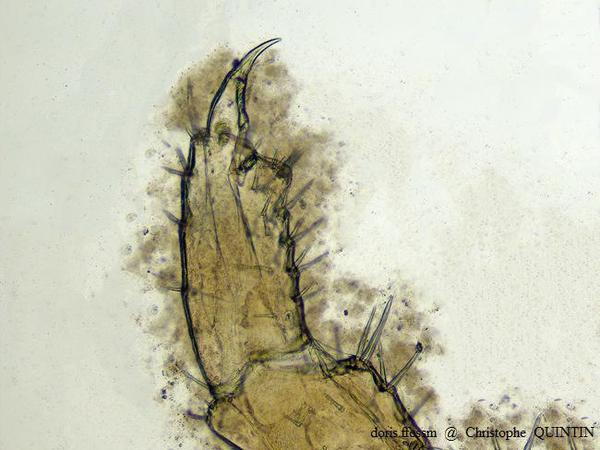
Vue au microscope du gnathopode 2 d’une femelle de Orchestia mediterranea
Les gnathopodes des femelles de Orchestia mediterranea et de Orchestia gammarellus sont semblables. Ils sont de plus petite taille que ceux des mâles.
Photographie au microscope – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
01/01/2023
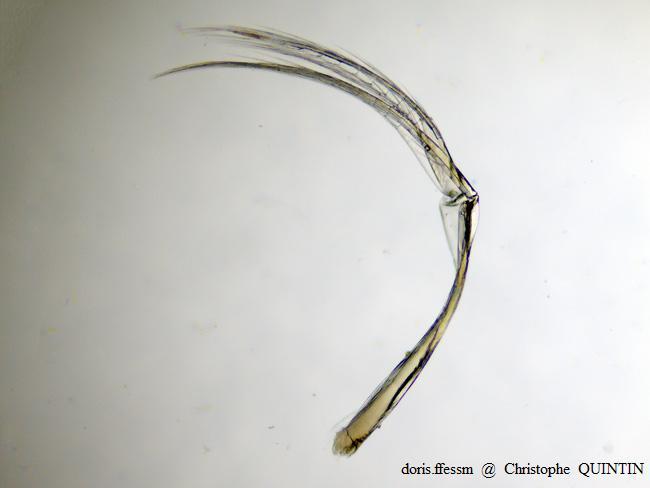

Vue au microscope d’un pléopode de Orchestia mediterranea
Chez Orchestia mediterranea, les pléopodes sont constitués de deux parties de longueur sensiblement égale : un pédoncule et des rami.
Photographie au microscope – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
15/10/2022
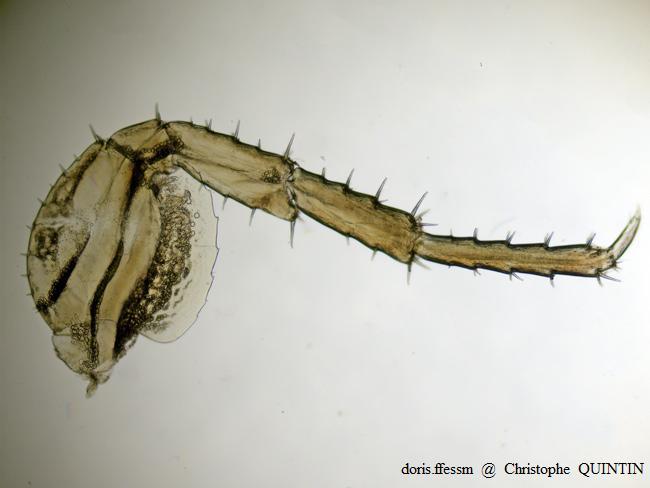
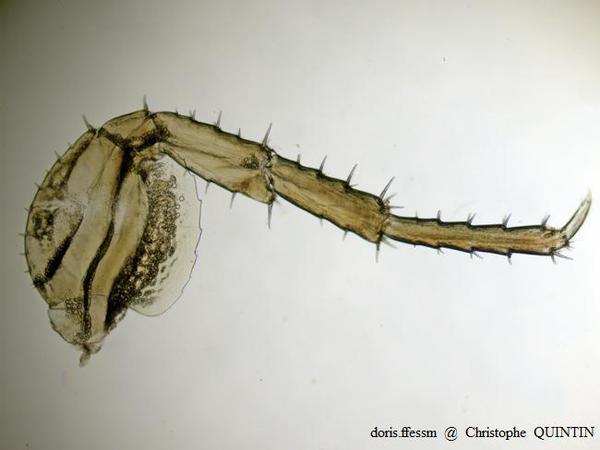
Vue au microscope d’un péréiopode 7 de Orchestia mediterranea
Les péréiopodes peuvent être utilisés pour la détermination des espèces, chacune d’entre elles présentant, notamment au niveau du fémur, des proportions spécifiques. Il ne s’agit pas du critère le plus aisé à observer.
Photographie au microscope – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
15/10/2022


Vue de l’urosome de Orchestia mediterranea
L’urosome porte 3 paires d’uropodes, la première paire étant la plus longue. La troisième paire est très petite, approximativement de la même longueur que le telson, et n’est pas visible ici (masquée par la deuxième paire). Le telson porte de petites épines dorsales.
Macrophotographie – Individu capturé dans des algues échouées, Port-Béni, Pleubian (22)
13/08/2022
Rédacteur principal : Christophe QUINTIN
Vérificateur : Pierre NOËL
Responsable régional : Yves MÜLLER
Abdelrhman K. F. A., Bacci G., Nistri A., Mengoni A., Ugolini A., 2017, Diet and gut microbiota of two supralittoral amphipods Orchestia montagui and Talitrus saltator living in different microhabitats, Estuarine, Coastal and Shelf Science, 197, 119–125.
Amanieu M., Salvat B., 1963, Orchestia microphtalma Amanieu et Salvat, 1963, Description et affinités (Crustacea Amphipoda Talitridae), Bulletin du Muséum National d'Histoire Naturelle, 35, 3, 302-310.
Clément J.L., 1978, Invertébrés du littoral armoricain, Cercle naturaliste des étudiants nantais, Faculté des Sciences de Nantes, 95 p.
Conlan K.E., 1991, Precopulatory mating behavior and sexual dimorphism in the amphipod Crustacea, Hydrobiologia, 223, 255-282.
Costello M.J., McGrath D., Emblow C., 1998, A review of the distribution of marine Talitridae (Amphipoda) in Ireland, including the results of a new survey of sandy beaches, Proceedings of the Fourth International Crustacean Congress, 473-488.
Costa A., 1853, Relazione sulla memoria del Dottor Achille Costa, di Ricerche su' Crostacei Amfipodi del Regno di Napoli, Rendiconti della Societa Reale Borbonica, Accademia delle Scienze, new series, 2, 167-178.
Dias N., Hassall M., 2005, Food, feeding and growth rates of peracarid macro-decomposers in a Ria Formosa salt marsh, southern Portugal, Journal of Experimental Marine Biology and Ecology, 325 (1), 84-94.
Dupont W., Salier J.P., 1979, Faune de normandie - Le littoral, Cercle naturaliste des étudiants de Haute-Normandie, Faculté des Sciences, Université de Rouen, 67 p.
Ginsburger-Vogel T., 1991, Intersexuality in Orchestia mediterranea Costa, 1853, and Orchestia aestuarensis Wildish, 1987 (Amphipoda): a consequence of hybridization or parasitic infestation?, Journal of Crustacean Biology, 11(4), 530–539.
Grintsov V., Sezgin M, 2011, Manual for identification of Amphipoda from the Black Sea, A.O. Kovalevsky Institute of Biology of the Southern Seas, National Academy of Sciences of Ukraine, Sinop University Fisheries Faculty Department of Hydrobiology, Sevastopol, Crimea, Ukraine, 1-151
Lafaille P., Lefeuvre J.C., Schricke M.T., Feunteun E., 2001, Feeding ecology of 0-group sea bass Dicentrarchus labrax in salt marshes of Mont Saint-Michel bay (France), Estuaries, 24, 116-125.
Lowry, J.K.; Myers, A.A.,2019., Talitrus saltator (Montagu, 1808), a species complex (Amphipoda, Senticaudata, Talitroidea, Talitridae). Zootaxa. 4664(4): 451-480.
Myers A.A., Lowry J.K., 2020, A revision of the genus Orchestia Leach, 1814 with the reinstatement of O. inaequipalpes (K.H. Barnard, 1951), the designation of a neotype for Orchestia gammarellus (Pallas, 1776) and the description of three new species (Crustacea: Amphipoda: Talitridae: Talitrinae), Zootaxa, 4808 (2), 201-250.
Pickup J., Ironside J. E., 2017, Multiple origins of parasitic feminization: thelygeny and intersexuality in beach-hoppers are caused by paramyxid parasites, not microsporidia, Parasitology, 145(3), 408–415.
Rainbow P. S., Moore P. G., Watson, D., 1989, Talitrid amphipods (Crustacea) as biomonitors for copper and zinc, Estuarine, Coastal and Shelf Science, 28(6), 567–582.
Spicer J. I., Taylor A. C., 1986, A comparative study of the gill area relationships in some talitrid amphipods, Journal of Natural History, 20(4), 935–947.
Vogel F., 1985, Das Schwimmen der Talitridae (Crustacea, Amphipoda): Funktionsmorphologie, Phänomenologie und Energetik, Helgoländer Meeresuntersuchungen, 39, 303-339.
Wildish, D. J. , 1970, Some factors affecting the distribution of Orchestia Leach in estuaries, Journal of Experimental Marine Biology and Ecology, 5(3), 276–284.
Wildish D. J., 1987, Estuarine species of Orchestia (Crustacea: Amphipoda: Talitroidea) from Britain, Journal of the Marine Biological Association of the United Kingdom, 67(03), 571-583.
La page de Orchestia mediterranea dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.