Taille de 1 à 2 cm, de couleur brune ou brun-vert
Tête avec 2 paires d'antennes dont la première est nettement plus courte que la seconde
Antennes d’aspect relativement lisse
Dernier article du pédoncule des antennes 2 à peine plus long que l’avant-dernier article
Yeux noirs et ronds
Corps aplati latéralement et arqué ventralement
7 paires de péréiopodes thoraciques dont les 3 dernières sont de sens opposé aux 4 premières
3 paires de pléopodes abdominaux
Orchestie, puce d'algues (Canada), piulé (provencal et catalan), puça de sorra (catalan), puce de mer, puce de sable.
La plupart de ces noms sont donnés également au talitre.
Shore-hoppercommon, shore-skippercommon, scudbeach-flea, semi-terrestrial beach flea (GB), Sandhüpfer, Küstenhüpfer (D), Gewone kwelderspringer (NL), Mørk sandhopper (DK)
Oniscus gammarellus Pallas,
1766
Orchestia gammarella Pallas,
1766
Orchestia littorea (Montagu,
1808)
Eaux européennes et côtes nord-américaines
Zones DORIS : ● Europe (côtes françaises), ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ● Atlantique Nord-Ouest, ○ [Méditerranée française]Orchestia gammarellus se rencontre dans toutes les eaux européennes ainsi que sur les côtes atlantiques nord-américaines.
Elle est potentiellement présente à Saint-Pierre-et-Miquelon.
Des populations auraient été introduites en Afrique du Sud..
Orchestia gammarellus se rencontre sur le haut de l’estran*, parmi la laisse de mer* ou sous les pierres, mais on peut également la rencontrer en eaux peu profondes ou bien au-dessus du niveau de la haute mer.
Elle peut également être observée en milieu nettement terrestre, si le milieu est suffisamment humide.
Cette espèce est souvent prédominante dans les schorres* à Obione.
Orchestia gammarellus peut fréquenter les estuaires. Sa tolérance à la dessalure est beaucoup plus élevée que chez Orchestia mediterranea, qui fréquente approximativement les mêmes biotopes*. Elle pourra remonter dans les estuaires jusqu’à rencontrer la zone de vie de Cryptorchestia garbinii, une espèce dulçaquicole*.
Les Orchestia sont des espèces indicatrices de l’habitat EUNIS 1140-2 – Galets et cailloutis des hauts de plage à Orchestia (façade atlantique). L'espèce est déterminante de l'inventaire ZNIEFF.
Ce petit crustacé est de couleur généralement brune, sa taille peut atteindre deux centimètres. Le corps est comprimé latéralement et un peu arqué ventralement.
La tête porte deux paires d’antennes*, la première étant nettement plus courte que la seconde (atteignant approximativement l’extrémité du pédoncule* de l’article 4 de l’antenne 2). Les yeux, noirs, sont bien ronds.
Il n’y a pas de flagelle* accessoire sur la paire d’antennes 1.
Le thorax porte sept paires de pattes (les péréiopodes*) :
L'abdomen porte 3 paires d'appendices (les pléopodes*) aplatis et garnis de soies*. Ils servent à la nage et à la ventilation des œufs fécondés.
L’extrémité du corps, l’urosome*, est constitué de trois segments portant chacun une paire d’uropodes*, qui servent à sauter. Les uropodes sont biramés, à l’exception du dernier qui ne comporte qu’une seule branche.
Le telson* porte de petites épines dorsales.
Au microscope : chez Orchestia gammarellus, les pléopodes ont une allure relativement robuste et le pédoncule représente au moins les 2/3 de la longueur totale.
Il est possible d’identifier les mâles à l’observation des gnathopodes 2, fortement hypertrophiés. Chez Orchestia gammarellus, la paume des gnathopodes est convexe.
Chez les Orchestia mâles âgés, le mérus et le carpe du péréiopode 7 (le dernier) s’élargissent de manière importante.
La famille des Talitridés comporte de nombreuses espèces qui présentent le même habitus (aspect extérieur). Dans cette famille, les antennes* 1 sont très courtes, et démunies de flagelle* accessoire, tandis que les antennes 2 ont une taille plus habituelle. Les yeux sont bien ronds. La distinction entre ces espèces n’est souvent pas simple.
Orchestia gammarellus est essentiellement détritivore*, consommant des végétaux divers échoués sur l’estran*. Ces animaux peuvent également se nourrir de déchets animaux. Ils jouent un rôle important dans le recyclage de la matière organique. Natalia Dias et al. (2005) ont montré que, lorsque le choix de nourriture leur est laissé, les Orchestia s’alimentent en priorité à partir d’algues vertes, puis à partir d’animaux morts, puis de spartines et de feuilles fraîches de zostères, et en dernier ressort de feuilles décomposées de zostères. Cette étude portait également sur l’analyse comparative du rythme d’ingurgitation des amphipodes par rapport aux isopodes présents dans les prés salés. Les amphipodes (dont Orchestia gammarellus et Orchestia mediterranea) ont un rythme alimentaire beaucoup plus élevé que les isopodes (2 fois plus élevé pour la consommation des algues vertes, 4 fois plus élevé pour la consommation d’animaux morts, 8 fois plus élevé pour la consommation de spartines). Leur rythme de croissance relative est, en conséquence, beaucoup plus élevé, Orchestia mediterranea surpassant sur ce point Orchestia gammarellus, avec un taux de croissance relative deux fois plus élevé.
Orchestia gammarellus est gonochorique*. Le dimorphisme* sexuel est particulièrement marqué au niveau des gnathopodes* 2, beaucoup plus imposants chez les mâles que chez les femelles. Les femelles en âge de procréer développent des oostégites*, sortes de membranes situées à la base des péréiopodes* et qui permettent de maintenir les œufs et les larves* au sein de la poche marsupiale.
Chez Orchestia gammarellus, les oostégites* comportent des soies* sur leur face interne. Il n’est pas rare de rencontrer des individus présentant simultanément des caractères sexuels propres aux deux sexes (intersexualité). Cette intersexualité est plus fréquente chez les mâles, qui portent alors des oostégites ou ont des gnathopodes atrophiés. Ce phénomène est plus fréquent chez Orchestia aestuarensis.
Les gnathopodes hypertrophiés sont utilisés par les mâles, légèrement plus grands que les femelles, pour s’accrocher sur le dos de la femelle avant l’accouplement (gardiennage pré-copulatoire), après la mue de cette dernière. Au moment de l’accouplement, le mâle bascule sur le ventre de la femelle et dépose son sperme dans la poche marsupiale face à la sortie des oviductes, au niveau du cinquième segment thoracique. Le mâle reprend ensuite sa position dorsale et stimule la femelle avec sa seconde paire de gnathopodes. Il quitte ensuite la femelle qui pond immédiatement après. Au moment de la ponte, les œufs sont enveloppés dans un sac muqueux qui disparaît rapidement et qui joue probablement un rôle dans la fécondation des œufs. Les œufs se développent dans la poche marsupiale et donnent naissance à des larves*. Les larves restent au sein de la poche marsupiale durant leurs premières phases de développement.
L’accouplement peut avoir lieu relativement tôt (mars/avril dans nos eaux) chez Orchestia gammarellus, ce qui permet aux jeunes de l’année de se reproduire une première fois dans l’année.
Le cycle de reproduction peut varier considérablement avec les conditions du milieu. Ainsi, une étude réalisée sur la population de Orchestia gammarellus du lac Smir au Maroc (limite méridionale de répartition de l’espèce) a montré que l’espèce se reproduisait localement d’octobre à mai, avec une grosse interruption durant la période chaude.
Le sex-ratio est nettement déséquilibré, les femelles étant trouvées en plus grand nombre sur l’estran* (bien qu’on puisse trouver des populations où les mâles dominent et des populations à sex-ratio équilibré chez Orchestia gammarellus). Il a été démontré que ce déséquilibre avait, pour partie, une origine génétique. Ce déséquilibre favorisait le développement rapide des populations (stratégie r).
Orchestia gammarellus peut être parasité par le protiste* Paramarteilia orchestiae qui induit l’apparition d’intersexualité chez les mâles, voire les transforme en femelles parfaitement fonctionnelles (on parle alors de thélygénie, la descendance des femelles infectées n’étant constituée que de femelles). La thélygénie de Orchestia gammarellus est sensible à la température et disparaît lorsque les femelles sont élevées au-dessus d’une température critique. Ce parasitisme conduit donc à déséquilibrer davantage le sex-ratio des populations, en faveur des femelles.
Un autre parasite classique de Orchestia gammarellus est la microsporidie (un champignon) Dictyocoela gammarellum, qui pourrait être en réalité un hyperparasite de Paramarteilia orchestiae. Un long débat scientifique a eu lieu sur la capacité de cette microsporidie à induire la féminisation des Orchestia (ces champignons sont en effet connus pour cette propriété chez d’autres espèces). Les travaux expérimentaux de James Pickup et Joseph Edward Ironside (2017) ont conclu par la négative, mais le débat n’est semble-t-il pas encore clos et Orchestia gammarellus pourrait donc être « bénéficiaire » de deux parasites féminisants.
Cette espèce est caractéristique de l'habitat Biocénose des laisses à dessiccation lente en contact avec les salicornes du supralittoral* méditerranéen.
Compte tenu de leur abondance, Orchestia gammarellus, comme Orchestia mediterranea jouent un rôle important dans le réseau trophique* de nombreuses espèces, qu’elles soient aquatiques (es Orchestia peuvent constituer la majeure partie de l’alimentation des bars juvéniles dans certaines zones) ou terrestres (les oiseaux en particulier). Même certaines araignées comme la lycose Arctosa fulvolineata sont prédatrices des Orchestia gammarellus.
Orchestia gammarellus, comme les autres Talitridés, est capable de se mouvoir dans l’eau en nageant et de se déplacer hors de l’eau en sautant. Le mouvement natatoire repose sur un mouvement métachronal des pléopodes (c’est-à-dire avec un léger décalage dans le temps du déplacement de chaque paire) conjugué à un mouvement vertical de la « queue » (abdomen et urosome*). Des études conduites sur deux espèces de Talitridés (Talitrus saltator) et Cryptorchestia garbinii) et une espèce de Hyalidés (Hyale nilssoni, aujourd’hui appelé Apohyale prevostii) ont montré que les espèces présentant les meilleures capacités de saut sont les moins bonnes nageuses. Les performances respectives sont liées aux habitats préférentiels de chaque espèce (une espèce à prédominance semi-terrestre comme Talitrus saltator aura de meilleures capacités de saut). Sur ce point, la comparaison entre les pléopodes* de Orchestia gammarellus et de Orchestia mediterranea montre que cette dernière espèce est plus adaptée à la nage (longueur des rami).
En aquarium, il est possible d’observer une différence de comportement entre les deux espèces : Orchestia gammarellus se maintiendra droit pour se déplacer, tandis que Orchestia mediterranea tendra naturellement à prendre la posture des Gammaridés, espèces typiquement aquatiques, avec un déplacement du corps à l’horizontal. Par ailleurs, on ne retrouvera jamais Orchestia gammarellus dans des algues dérivantes.
Des études comparatives portant sur la taille des branchies ont également montré que ces organes étaient l’objet d’une adaptation spécifique à la conquête du milieu terrestre. Les branchies sont plus petites chez les espèces semi-terrestres (comme Orchestia gammarellus) que chez les espèces aquatiques.
La tolérance de Orchestia gammarellus à la variation des paramètres abiotiques du milieu a fait l’objet d’études intéressantes (voir Moore & Francis, 1986). L’espèce survit parfaitement dans une plage de température comprise entre 0 °C et 30 °C. Elle résiste moins d’une heure dans une eau à 35 °C. L’espèce tolère également une large plage de salinité (entre 1 et 60 pour mille). Les individus ne survivent cependant pas dans une eau totalement douce, ni dans une eau saturée en sel. L’espèce présente par ailleurs une grande résistance aux ions ammonium, ce qui constitue probablement une adaptation particulière à son milieu (algues en décomposition) et est capable de survivre près de 5 heures en milieu anoxique*.
Le niveau de salinité a un impact sur la fréquence des mues*. Ces dernières s’espacent lorsque la salinité décroit, ce qui conduit une vitesse de croissance plus faible.
Orchestia gammarellus vit entre 12 et 18 mois.
Le genre Orchestia a longtemps été utilisé comme « fourre-tout » pour les espèces appartenant à la famille des Talitridés. Un gros travail de rationalisation a été réalisé ces vingt dernières années, comportant notamment la création du genre Cryptorchestia pour les espèces terrestres et dulçaquicoles. Les difficultés de détermination des espèces du genre ont par ailleurs longtemps conduit à considérer des espèces extra-européennes comme étant des Orchestia gammarellus. Des travaux récents comme ceux de Alan A. Meyers (2020) ont permis d’affiner la connaissance de cette espèce, en confirmant que les espèces rencontrées sur les côtes non-européennes sont souvent des espèces différentes. Il reste probablement un travail « moderne » de phylogénie* moléculaire à réaliser sur ce genre.
Des études ont montré que Orchestia gammarellus pourrait être utilisé pour réaliser l’analyse de la concentration en cuivre et en zinc de certains milieux pollués. Il n’existe pas actuellement de protocole normalisé utilisant cette possibilité.
Orchestie littorale : proposition de nom commun qui se réfère au nom de genre francisé et au nom d’espèce pour son milieu de vie afin de distinguer cette espèce des « puces de mer » comme les talitres.
Le nom de genre Orchestia provient directement du grec ancien [Orchestra/Orchestria] = danseur, allusion directe aux sauts de ces animaux lorsqu’ils sont dérangés.
gammarellus : du grec puis du latin [gammarus] = un crustacé indéterminé, crevette, écrevisse, sauterelle et le suffixe [-ellus] est un diminutif.
Numéro d'entrée WoRMS : 103202
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Arthropoda | Arthropodes | Animaux invertébrés au corps segmenté, articulé, pourvu d’appendices articulés, et couvert d’une cuticule rigide constituant leur exosquelette. |
| Sous-embranchement | Crustacea | Crustacés | Arthropodes à exosquelette chitineux, souvent imprégné de carbonate de calcium, ayant deux paires d'antennes. |
| Super classe | Multicrustacea | ||
| Classe | Malacostraca | Malacostracés | 8 segments thoraciques, 6 segments abdominaux. Appendices présents sur le thorax et l’abdomen. |
| Sous-classe | Eumalacostraca | Eumalacostracés | Présence d’une carapace recouvrant la tête et tout ou partie du thorax. |
| Super ordre | Peracarida | Péracarides | Les femelles sont dotées d'une cavité d'incubation formée par des expansions lamelleuses des péréiopodes. |
| Ordre | Amphipoda | Amphipodes | Péracarides comprimés latéralement, dépourvus de carapace, et possédant de nombreuses paires d'appendices souvent modifiés. Ils sont représentés par les gammares, les talitres, les caprelles... |
| Sous-ordre | Senticaudata | ||
| Famille | Talitridae | Talitridés | |
| Sous-famille | Talitrinae | Talitrinés | |
| Genre | Orchestia | ||
| Espèce | gammarellus |
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Vue de profil de Orchestia gammarellus mâle
Cette photographie de profil permet de voir la modification des péréiopodes 7 observable chez les mâles âgés.
Macrophotographie rapport 1:1 – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
23/12/2022
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Vue au microscope du gnathopode 2 d’un mâle de Orchestia gammarellus
Chez les mâles de Orchestia gammarellus, la paume (partie du gnathopode qui fait face au dactyle) est totalement convexe.
Photographie au microscope – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
23/12/2022
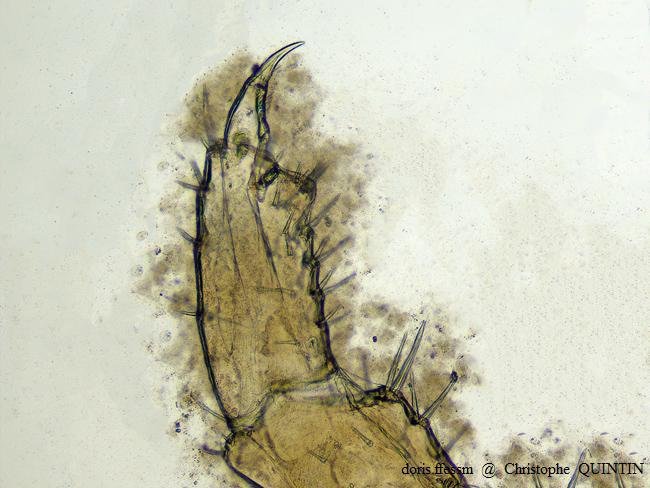
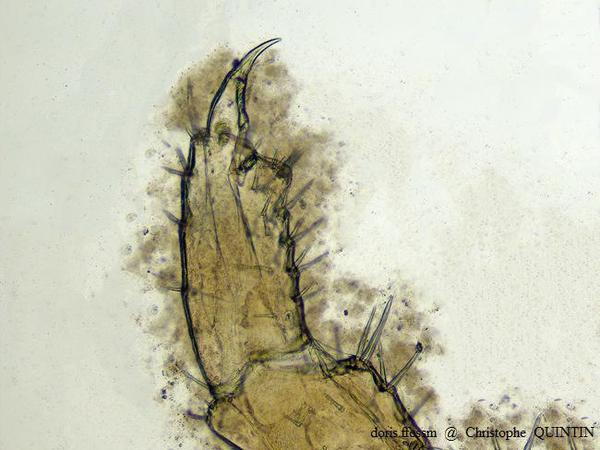
Vue au microscope du gnathopode 2 d’une femelle de Orchestia mediterranea
Les gnathopodes des femelles de Orchestia mediterranea et de Orchestia gammarellus sont semblables. Ils sont de plus petite taille que ceux des mâles.
Photographie au microscope – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
01/01/2023


Vue au microscope d’un pléopode de Orchestia gammarellus
Chez Orchestia gammarellus, le pédoncule des pléopodes est environ deux fois plus longs que les rami. Le pédoncule présente par ailleurs un aspect plus robuste que chez Orchestia mediterranea.
Photographie au microscope – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
23/12/2022


Vue au microscope du mérus et du carpe élargis chez un Orchestia gammarellus mâle
Chez les Orchestia mâles âgés, à l’exception notable de Speziorchestia stephenseni, le mérus et le carpe des péréiopodes 7 s’élargissent.
Photographie au microscope – Individu capturé sous des blocs rocheux, Binic-Etables-sur-mer (22)
23/12/2022


Scène de cannibalisme
Les Orchestia
sont des détritivores qui sont également capables de cannibalisme. On voit ici,
dans un aquarium, deux individus qui dévorent un autre individu (celui de
droite) fraîchement décédé.
Macrophotographie
prise en laboratoire, Binic-Etables-sur-Mer (22)
21/01/2023
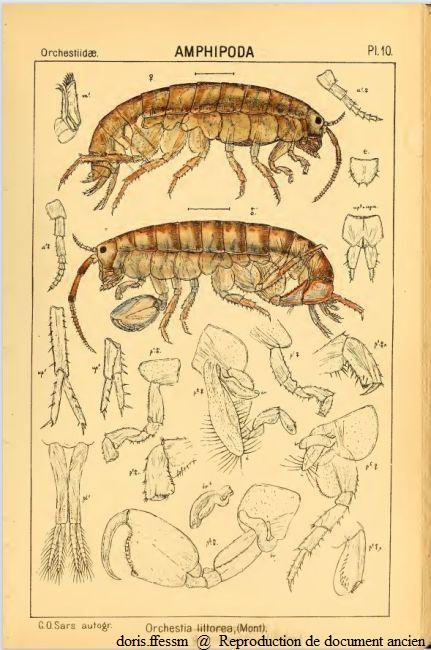
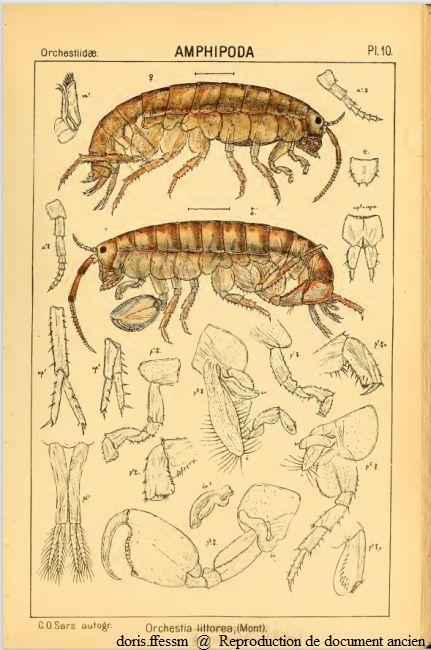
Orchestia gammarellus
Orchestia littorea est un ancien synonyme de Orchestia gammarellus.
en haut la femelle
en dessous le mâle
a = antenne, m = maxille, p = péreiopode, pl = pléopode, t = telson, up = uropode
Seuls les appendices d'un côté ont été dessinés.
Planche 10 de G.O. Sars, 1895
Reproduction de documents anciens
1895
Rédacteur principal : Christophe QUINTIN
Vérificateur : Pierre NOËL
Responsable régional : Yves MÜLLER
Aksissou M., Elkaïm B., 1996, Cycle reproducteur d’une population d’Orchestia gammarellus (Crustacea, Amphipoda) dans le lac Smir (Maroc), Mediterranea, Serie de estudios biológicos, 5-11.
Clément J.L., 1978, Invertébrés du littoral armoricain, Cercle naturaliste des étudiants nantais, Faculté des Sciences de Nantes, 95 p.
Conlan K.E., 1991, Precopulatory mating behavior and sexual dimorphism in the amphipod Crustacea, Hydrobiologia, 223, 255-282.
Costello M.J., McGrath D., Emblow C., 1998, A review of the distribution of marine Talitridae (Amphipoda) in Ireland, including the results of a new survey of sandy beaches, Proceedings of the Fourth International Crustacean Congress, 473-488.
Dias N., Hassall M., 2005, Food, feeding and growth rates of peracarid macro-decomposers in a Ria Formosa salt marsh, southern Portugal, Journal of Experimental Marine Biology and Ecology, 325 (1), 84-94.
Dupont W., Salier J.P., 1979, Faune de normandie - Le littoral, Cercle naturaliste des étudiants de Haute-Normandie, Faculté des Sciences, Université de Rouen, 67 p.
Ginsburger-Vogel T., 1975, Temperature-Sensitive Intersexuality and Its Determinism in Orchestia gammarella Pallas, Intersexuality in the Animal Kingdom, 106–120.
Ginsburger-Vogel T., 1989, Déterminisme des anomalies de sex ratio à hérédité paternelle chez le crustacé amphipode Orchestia gammarellus Pallas, Invertebrate Reproduction & Development, 16(1-3), 183–194.
Grintsov V., Sezgin M, 2011, Manual for identification of Amphipoda from the Black Sea, A.O. Kovalevsky Institute of Biology of the Southern Seas, National Academy of Sciences of Ukraine, Sinop University Fisheries Faculty Department of Hydrobiology, .Sevastopol, Crimea, Ukraine, 1-151.
Henzler C. M., Ingólfsson A., 2008, The biogeography of the beachflea, Orchestia gammarellus (Crustacea, Amphipoda, Talitridae), in the North Atlantic with special reference to Iceland: a morphometric and genetic study, Zoologica Scripta, 37(1), 57-70.
Jones M. B., Wigham G. D., 1993, Reproductive biology of Orchestia gammarellus (Crustacea: Amphipoda) living in a sewage treatment works, Journal of the Marine Biological Association of the United Kingdom, 73(02), 405-416.
Lafaille P., Lefeuvre J.C., Schricke M.T., Feunteun E., 2001, Feeding ecology of 0-group sea bass Dicentrarchus labrax in salt marshes of Mont Saint-Michel bay (France), Estuaries, 24, 116-125.
Lowry J. K., Fanni L., 2013, Substrate dependent talitrid amphipods from fragmented beaches on the north coast of Crete (Crustacea, Amphipoda, Talitridae), including a redefinition of the genus Orchestia and descriptions of Orchestia xylino sp. nov. and Cryptorchestia gen. nov., Zootaxa, 3709(3), 201-229.
Lowry, J. K. & Coleman, C. O. 2011. Africorchestia a new genus of sand-hoppers (Crustacea, Amphipoda, Talitridae) from western Africa and south-western Europe. Zootaxa, 2825: 55-68.
Moore P. G., Francis C. H., 1986, Environmental tolerances of the beach-hopper Orchestia gammarellus (Pallas) (Crustacea:Amphipoda), Marine Environmental Research, 19(2), 115–129.
Myers A.A., Lowry J.K., 2020, A revision of the genus Orchestia Leach, 1814 with the reinstatement of O. inaequipalpes (K.H. Barnard, 1951), the designation of a neotype for Orchestia gammarellus (Pallas, 1776) and the description of three new species (Crustacea: Amphipoda: Talitridae: Talitrinae), Zootaxa, 4808 (2), 201-250.
Pétillon J., Foucreau N., Renault D., 2009. A propos de la consommation d’Amphipodes par l’espèce de marais salés Arctosa fulvolineata (Araneae Lycosidae). Nieuwsbrief van de Belgische Arachnologische Vereniging, 24, 147-152.
Pickup J., Ironside J. E., 2017, Multiple origins of parasitic feminization: thelygeny and intersexuality in beach-hoppers are caused by paramyxid parasites, not microsporidia, Parasitology, 145(3), 408–415.
Rainbow P. S., Moore P. G., Watson, D., 1989, Talitrid amphipods (Crustacea) as biomonitors for copper and zinc, Estuarine, Coastal and Shelf Science, 28(6), 567–582.
Vogel F., 1985, Das Schwimmen der Talitridae (Crustacea, Amphipoda): Funktionsmorphologie, Phänomenologie und Energetik, Helgoländer Meeresuntersuchungen, 39, 33-339.
Wildish, D. J. , 1970, Some factors affecting the distribution of Orchestia Leach in estuaries, Journal of Experimental Marine Biology and Ecology, 5(3), 276–284.
Wildish D. J., 1979, Reproductive consequences of the terrestrial habit in Orchestia (Crustacea: Amphipoda), International Journal of Invertebrate Reproduction, 1(1), 9–20.
Wildish D. J., 1987, Estuarine species of Orchestia (Crustacea: Amphipoda: Talitroidea) from Britain, Journal of the Marine Biological Association of the United Kingdom, 67(03), 571-583La page de Orchestia gammarellus dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.