Couleur variable : à dominante grise et blanche, ou rose orangé à rouge vif, ou brun presque noir
Bande jaune longitudinale sur les flancs, bordée des deux côtés de taches bleu pâle
Deux longs barbillons blancs sous le menton
Nageoires généralement jaunes à l’exception des pectorales
Dorsale séparée en deux parties, caudale fourchue
Capucin à nageoires jaunes, surmulet sans tache, capucin à bande jaune (NB : ce dernier nom commun est aussi utilisé pour Mulloidichthys flavolineatus)
Banded goatfish, golden banded goatfish, goldenstripe goatfish, goldstripe goatfish, red goatfish, yellowfin goatfish, yellow goatfish, yellowstripe goatfish (GB), Gulfinnet mulle (Danemark), Flame goatfish, vlam-bokvis (Afrique du Sud), Red weke (Hawaï)
Upeneus vanicolensis Valenciennes, 1831
Mulloides vanicolensis (Valenciennes, 1831)
Pseudopeneus vanicolensis (Valenciennes, 1831)
Pseudupeneus vanicolensis (Valenciennes, 1831)
Mulloides erythrinus Klunzinger, 1884
Mer Rouge, océan Indien et zones tropicales et subtropicales de l’ouest et du centre de l’océan Pacifique
Zones DORIS : ● Indo-Pacifique, ○ [Mer Rouge] On peut trouver cette espèce en mer Rouge et dans l’océan Indien ainsi que dans les zones tropicales et subtropicales de l’ouest et du centre de l’océan Pacifique.
Dans le Pacifique, sa distribution s’étend, du nord au sud, depuis le sud du Japon jusqu’à l’Australie, la Nouvelle-Calédonie et les îles Kermadec, Tonga et Gambier. Vers l’est, elle s’étend jusqu’à Hawaï, aux îles de la Ligne, aux îles Pitcairn et à l’île de Pâques. Des signalements ont été faits dans l’est du Pacifique (Mexique et Panama), mais ils sont considérés comme devant être confirmés du fait d’une confusion possible avec Mulloidichthys dentatus.
L’espèce fréquente les zones sableuses des lagons et des pentes récifales externes, de même que celles des côtes et des baies, de 1 à 113 mètres. Mais on la rencontre le plus souvent à faible profondeur.
Description sommaire : poisson de taille moyenne et de couleur variable. Dans la livrée la plus commune, le dos est gris jaunissant ou rosissant et la partie ventrale est blanche. Ces parties sont séparées par une bande jaune bordée de taches bleues. Les écailles sont bordées d’ocre foncé en partie dorsale. Les autres livrées, liées au stress, sont rose orangé à rouge vif, ou brun foncé. Le menton porte deux longs barbillons blancs. Les deux parties de la nageoire dorsale sont séparées. La nageoire caudale est fourchue. Toutes les nageoires hormis les pectorales sont jaunes mais cette couleur peut s’estomper jusqu’à disparaître, en fonction de l’humeur de l’animal.
Description détaillée :
Le corps est long, fuselé et légèrement comprimé latéralement ; sa hauteur (distance entre la base du troisième rayon dur de la dorsale et celle du premier rayon des pelviennes) entre environ 3,3 à 3,9 fois dans sa longueur standard (longueur sans la queue). La taille maximale documentée est de 38 cm, la taille la plus communément rencontrée étant de 25 cm.
La couleur du corps est variable : elle est le plus souvent à dominante grise et blanche mais en cas de stress, elle peut devenir rose orangé à rouge vif ou, plus rarement, d’un brun presque noir sur les 4/5èmes supérieurs du corps. Pour ce qui concerne la livrée ordinaire : la partie dorsale du corps est d’un gris jaunissant à rosâtre. Sous cette partie se trouve une bande jaune bordée des deux côtés de taches bleu pâle, qui part de la partie postérieure des yeux et traverse les flancs jusqu’au pédoncule* caudal. Les taches bleues s’estompent et disparaissent sur le pédoncule caudal. Cette bande jaune et ses bords bleus peuvent être pâlis ou disparaître, en fonction de l’humeur des individus. Sous cette bande, le corps est blanc argenté parfois grisé ou rosissant. Les écailles sont de grande taille. Leur bordure est fortement soulignée d’ocre plus ou moins grisé dans la partie dorsale, ces marques s’atténuant régulièrement sous la bande jaune jusqu’à disparaître dans la zone abdominale.
Le profil dorsal de la tête est fortement convexe, son profil ventral est presque rectiligne de la lèvre inférieure à l’angle des opercules*. La tête est souvent rosâtre du museau à la nuque. La ligne inférieure de taches bleu pâle qui borde la bande jaune sur les flancs se prolonge sous l’œil et légèrement devant lui. Sous cette ligne, une série de courts traits alternant le bleu et le jaune colorent les joues mais ces marques sont généralement discrètes, voire absentes. Les bords postérieurs du préopercule* et de l’opercule sont jaunes.
L’œil est de taille moyenne (son diamètre entre environ 3,6 fois dans la longueur de la tête) ; il est blanc avec ou sans taches rouges. La bouche est terminale ; les lèvres sont proéminentes et charnues, la lèvre supérieure étant protractile*. Le menton porte deux longs barbillons blancs, dont la longueur entre de 1,2 à 1,6 fois dans la longueur de la tête. En pleine eau les barbillons sont plaqués contre la gorge et ne sont visibles que quand l'individu est sur le fond à la recherche de nourriture.
Toutes les nageoires sont jaunes à l’exception des pectorales. Cette couleur peut s’estomper jusqu’à disparaître, en fonction de l’humeur de l’animal. La partie épineuse de la nageoire dorsale et sa partie molle sont séparées par cinq rangées d’écailles. La première dorsale est schématiquement triangulaire. La dorsale molle et l’anale sont symétriques. La nageoire caudale est fortement fourchue.
Livrées rouge et brune : la livrée rouge est arborée en cas de stress et peut rendre orange les nageoires et la ligne jaune longitudinale sur les flancs (les taches bleues étant toujours visibles). Elle est généralement arborée dans un abri ou à son approche. Elle peut devenir uniformément rouge vif, la ligne jaune bordée de taches bleues présentes sur les flancs devenant alors indistincte. Un stress intense peut aussi faire passer ce rouge vif à un brun noirâtre dans les 4/5èmes supérieurs du corps, toutes les nageoires sauf les pectorales prenant alors une couleur gris fumé. Les barbillons restent blancs en livrée rose, rouge ou brune.
Livrée de nuit : la couleur de fond est blanche. Elle est marquée par trois à quatre selles rouges à gris foncé en partie dorsale, qui recouvrent en la rougissant ou la grisant la bande jaune longitudinale présente sur les flancs. Cette bande est généralement très pâle et peut devenir rougeâtre, les taches bleues qui la bordent s’estompant alors. La partie ventrale est largement maculée par de grandes plaques rouges de taille, forme, nombre et emplacement variés. Elle peut devenir entièrement rose à rouge. Les nageoires prennent une teinte jaune fumé. Une livrée « extrême » montre une partie dorsale blanche avec quatre selles d’un jaune très pâle à peine perceptible et une partie ventrale majoritairement rosâtre. La bande jaune longitudinale est réduite à une alternance de quatre rectangles rouges aux emplacements des selles dorsales et quatre rectangles blancs entre ces marques.
Dans sa distribution, il est possible de confondre M. vanicolensis avec Mulloidichthys flavolineatus, d’autant plus que ce dernier peut faire disparaître la tache noire qui marque la ligne jaune bordée de bleu qu’il porte sur les flancs, notamment quand il se mêle aux groupes de M. vanicolensis. Cependant, chez M. flavolineatus toutes les nageoires sont le plus souvent translucides (vs jaunes à l’exception des pectorales chez M. vanicolensis). Toutefois, M. flavolineatus peut faire jaunir ses nageoires et M. vanicolensis peut décolorer les siennes : quand les nageoires sont jaunes chez les deux espèces, il reste à observer la nageoire anale, qui n’est jamais jaune chez M. flavolineatus et, quand les deux espèces ont des nageoires translucides, à comparer les museaux : celui de M. vanicolensis est plus court.
A plus grande profondeur (au-delà de 30 m), M. vanicolensis pourrait être confondu avec Mulloidichthys pfluegeri, mais ce dernier est généralement d’un rose saumon plus ou moins soutenu avec ou sans quatre larges bandes verticales plus claires. Quand il est gris, on distingue une bande jaune longitudinale peu marquée et les deux dorsales et l’anale sont légèrement rosées. Quelle que soit la couleur, ses yeux sont plus petits que ceux de M. vanicolensis (leur diamètre entre environ 5,6 fois dans la longueur de la tête, vs environ 3,6 fois pour M. vanicolensis). On trouve cette espèce dans le Pacifique, son seul signalement dans l’océan Indien étant La Réunion, ce qui permet de supposer que sa distribution dans cet océan est encore mal connue.
M. vanicolensis est un carnivore benthique*. Il se nourrit de jour comme de nuit (mais principalement de nuit) de petits crustacés (crabes et crevettes notamment), de vers polychètes et d’autres vers, de gastéropodes à coquille et de foraminifères, de spatangues, etc. Il cherche ses proies dans un substrat* sableux avec ses barbillons pourvus de cellules chémoréceptrices* et il les capture en labourant le sédiment avec son museau.
L’espèce est gonochorique*. La saison de reproduction se situe en saison chaude, elle donne lieu à des agrégations. Les gamètes* sont émis en pleine eau, les larves* sont donc pélagiques*. Ces dernières dérivent en surface et passent au stade juvénile avant de coloniser un récif. Cette métamorphose* amène l’apparition des barbillons et une mutation de la structure des yeux adaptée à la vie près du fond. Au moment de l’installation*, les juvéniles descendent vers le substrat.
Le corps des juvéniles est plus élancé que celui des adultes et leur profil dorsal de tête est beaucoup moins bombé. Les patrons de couleurs ne diffèrent pas sensiblement de ceux des adultes.
Les Mullidés, entre autres M. vanicolensis, sont fréquemment parasités par des vers du genre Haliotrema. Ces vers se fixent essentiellement sur les branchies, la peau et les nageoires.
Une nouvelle espèce de ver plathelminthe, Homalometron moraveci, a été décrite suite à la capture de capucins de Vanicolo. Cinq espèces, distribuées en deux nouveaux genres (Volsellituba et Pennulituba), ont ensuite été décrites après avoir été découvertes dans ses branchies.
Un autre plathelminthe, Phthinomita sp., qui se nourrit du sang de son hôte et parvient jusqu’à son cœur, a été trouvé parasitant M. vanicolensis.
Ajoutons que de nombreux poissons suivent généralement les capucins lorsque que ceux-ci fouillent le sédiment, afin de profiter des proies débusquées.
Cette espèce nocturne partage son temps entre deux types de sites : les sites diurnes, consacrés au repos, et les sites nocturnes, consacrés à la recherche de nourriture, ce qui produit une migration quotidienne dans les deux sens. En journée, les individus s’agrègent en groupes stationnant, immobiles, en pleine eau au-dessus des massifs coralliens et plus rarement sur le substrat. Quelques-uns cherchent de la nourriture en journée, en solitaires pour les adultes et en groupes pour les plus jeunes.
Les agrégations diurnes peuvent s’associer à des groupes formés par d’autres Mullidés, notamment Mulloidichthys flavolineatus, mais aussi à des groupes de vivaneaux comme Lutjanus kasmira, ou de capitaines, comme Gnathodentex aureolineatus. Les groupes de capucins de Vanicolo ne sont pas toujours bien accueillis : une étude menée à Hawaï montre qu’il peut y avoir compétition pour la nourriture et les abris entre les groupes de Lutjanus kasmira et ceux de M. vanicolensis : les vivaneaux chassent les capucins plus haut dans la colonne d’eau et les isolent ainsi de leurs sources de nourriture et de leurs refuges. Plusieurs autres espèces du genre Mulloidichthys se mêlent aux groupes de poissons de familles différentes à la livrée proche de la leur (M. martinicus avec Haemulon chrysargyreum, M. mimicus avec Lutjanus kasmira). Ce comportement est supposé lié à une recherche de protection au sein d’un banc plus important et on suppose aussi que la chair des espèces hôtes est moins appréciée que celle des intrus par les prédateurs, ce qui devrait éloigner ces derniers du banc !
La caractéristique principale des Mullidés réside dans leurs barbillons équipés de cellules chémoréceptrices. Ces barbillons sont à la fois indépendants et très mobiles. Deux systèmes musculaires et osseux distincts leur permettent de se mouvoir latéralement, d‘être abaissés et relevés. Les parties charnues de chaque barbillon s’organisent autour d’un rayon modifié issu de la membrane branchiostège* (attachée aux opercules et couvrant les branchies), qui leur donne leur solidité. Ces rayons se déplacent de la zone operculaire vers le menton au cours de la croissance des larves, les barbillons apparaissant chez les juvéniles prêts à mener une existence benthique*.
Ces barbillons ne sont déployés que près du sol, lors de la recherche de nourriture.
La première nageoire dorsale de M. vanicolensis comprend 8 rayons durs, la seconde 9 rayons mous. L’anale comprend 1 rayon dur et 7 rayons mous. La nageoire pectorale a de 16 et 17 rayons. La ligne latérale* comprend 35 à 38 écailles
Les genres de la famille des Mullidés sont principalement distingués par leur dentition. Celle du genre Mulloidichthys est constituée par une rangée de très petites dents coniques villiformes* sur chacune des mâchoires, sans dents vomériennes* (fixées sur le vomer*) ni palatines* (fixées sur les os du palais).
Le travail de fouissage des Mullidés a pour conséquence une resuspension des particules organiques contenues dans le sédiment, qui peut profiter entre autres au plancton*, aux coraux et aux organismes suspensivores*. De plus, le mélange continuel des éléments composant le sédiment est un obstacle aux invasions algales.
Ce travail est vigoureusement mené : il n’est pas rare d’apercevoir un nuage de suspensions de plus d’un mètre de haut et de deux mètres carrés de surface au-dessus d’un capucin adulte en train de traquer une proie dans le sable. Une étude faite en mer Rouge montre que Parupeneus forsskali fouit chaque mètre carré de la zone d’étude 4,4 secondes par heure et peut creuser avec son museau une tranchée de 10 à 15 cm de profondeur et de quelques décimètres de longueur.
Les espèces Mulloidichthys dentatus (Pacifique tropical Est) et M. martinicus (Atlantique tropical Ouest) ont une morphologie et un patron de couleur si semblables à ceux de M. vanicolensis que des scientifiques rangent les trois espèces dans un « complexe » circumtropical* appelé le « complexe martinicus ».
La pêche des capucins, dont la chair est prisée, est une composante importante de la pêche artisanale et de la pêche commerciale. Une étude a montré un déclin des prises de l’ordre des deux-tiers entre 2013 et 2016 en mer Rouge. Ce pourquoi des recommandations de taille minimale de capture et d’interdiction de la pêche pendant la saison de reproduction, ont été formulées par les scientifiques dans des zones critiques.
Les capucins sont pêchés au filet maillant, au trémail, au harpon, au casier ou à la ligne. Les plus jeunes individus (jusqu’à une quinzaine de centimètres), pêchés à la senne ou au filet épervier, sont capturés pour servir d’appât pour la pêche.
Le statut de M. vanicolensis pour l’UICN* est LC (Least Concerned, traduit par « Préoccupation mineure »), ce qui signifie que les informations recueillies sur l’espèce ne permettent pas de la classer dans les autres catégories, notamment dans les trois qui alertent sur une menace (CR : en danger critique d’extinction, EN : en danger, VU : vulnérable). Fonction de quoi elle n’est pas actuellement concernée par des mesures de protection.
Capucin : le mot vient du nom d’un ordre religieux faisant partie du mouvement franciscain, les Frères mineurs capucins. Ce nom tient à leur robe de bure munie d’une longue capuche, qu’ils nommaient d’un nom d’origine italienne, « le capuce ». Ces religieux se caractérisaient entre autres par le port d’une longue barbe, ce qui pourrait avoir motivé le nom français de ces poissons, tous dotés de deux longs « barbillons » sous la lèvre inférieure. On trouve la même inspiration dans le nom anglais de « goatfish » (poisson chèvre), employé pour toute la famille des Mullidés, en référence à la « barbiche » que peuvent avoir les chèvres sous le menton.
de Vanicolo : en référence à la localité du type* (voir ci-dessous).
Mulloidichthys : le genre est décrit par Whitley en 1929 dans Studies in ichthyology (n° 3, 17, 3, pp. 122-123). Ce nom de genre remplace celui de Mulloides, créé par Bleeker en 1849 mais déjà employé pour un autre groupe de Mullidés par Richarson en 1843. Le principe d‘antériorité en nomenclature exige dans ce cas de figure de trouver un substitut au nom indûment réutilisé.
Le nom Mulloides vient du nom latin [mullus], qui désignait les surmulets chez les Romains et du suffixe grec [-oïdes], qui signifie « qui a la forme de, ressemblant à », et par extension, « faux ». Pour composer le substitut nécessaire, Whitley ajoute au nom donné indûment par Bleeker le nom grec [ichthys ], qui désigne les poissons. Le nouveau nom de genre signifie donc « poissons ressemblant aux surmulets », ou « faux surmulets ».
vanicolensis : de Vanicolo.
Valenciennes décrit l'espèce en 1831 dans Histoire naturelle des poissons (Tome septième, Livre septième, Additions et corrections aux tomes II, III et IV, p. 521) sous le nom scientifique d’Upeneus vanicolensis et lui donne le nom commun d’Upénéus de Vanicolo, le spécimen ayant été ramené de l’île de « Vanicolo » par Quoy et Gaimard. Cette île, actuellement appelée Vanikoro, fait partie de l’archipel Santa-Cruz, appartenant aux îles Salomon, dans la mer de Corail. L’épithète spécifique lie le nom de l’île au suffixe latin [–ensis], qui signifie « originaire de ».
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Chordata | Chordés | Animaux à l’organisation complexe définie par 3 caractères originaux : tube nerveux dorsal, chorde dorsale, et tube digestif ventral. Il existe 3 grands groupes de Chordés : les Tuniciers, les Céphalocordés et les Vertébrés. |
| Sous-embranchement | Vertebrata | Vertébrés | Chordés possédant une colonne vertébrale et un crâne qui contient la partie antérieure du système nerveux. |
| Classe | Actinopteri | ||
| Sous-classe | Neopterygii Teleostei | Néoptérygiens Téléostéens | Poissons à arêtes osseuses, présence d’un opercule, écailles minces et imbriquées. |
| Ordre | Mulliformes | Mulliformes | |
| Famille | Mullidae | Mullidés | Percoïdes possédant une paire de longs barbillons mentonniers. |
| Genre | Mulloidichthys | ||
| Espèce | vanicolensis |
 Poissons osseux posés sur le fond et « Agnathes »
Poissons osseux posés sur le fond et « Agnathes »

Capucin à nageoires jaunes
Des noms communs français et anglais se fondent sur la couleur caractéristique des nageoires de l’espèce (capucin à nageoires jaunes, yellowfin goatfish) : à l’exception des pectorales, elles sont toutes jaunes vif. D’autres noms communs privilégient la bande jaune longitudinale qui traverse les flancs. Ces deux caractéristiques permettent d’identifier aisément l’espèce quand les individus, qui peuvent les faire disparaître, jouent le jeu…
Sipadan Middle reef, Malaysie, mer des Célèbes, 15 m
14/05/1999
 Poissons osseux posés sur le fond et « Agnathes »
Poissons osseux posés sur le fond et « Agnathes »

Marques faciales
Les marques faciales peuvent être discrètes, voire absentes. Quand elles sont manifestes, une ligne bleu pâle souligne le bord inférieur de l’œil, ligne sous laquelle une série de courtes marques alternent le bleu et le jaune sur les joues. Chez cet individu, les chromatophores responsables du bleu ne sont pas suffisamment activés pour manifester clairement cette alternance. En revanche, les bords jaunes du préopercule et de l’opercule sont bien visibles.
Mer Rouge
11/10/2010


Livrée rose
La couleur du corps est le plus souvent à dominante grise et blanche, mais elle peut devenir rose, rouge vif ou brun foncé. La livrée rose préserve la ligne longitudinale sur les flancs, mais elle passe à l’orangé et les lignes de taches qui la bordent sont alors parme. Le jaune des nageoires ternit et prend une teinte fumée.
Lagon de l'Ermitage, La Réunion, océan Indien, 1,5 m, en PMT
17/04/2012


Livrée rouge
La livrée rouge estompe généralement la bande jaune longitudinale présente sur les flancs jusqu’à la faire disparaître, ce qui est presque achevé chez l’individu au centre de la photo. Ceux qui l’accompagnent sont en train de passer à la livrée brune.
Lagon de l'Ermitage, La Réunion, océan Indien, 1,5 m, en PMT
03/03/2012


Livrée brune
Ce juvénile est particulièrement stressé, ce que montre sa livrée passée à un brun noirâtre sur les 4/5e supérieurs du corps. Toutes les nageoires sauf les pectorales sont gris fumé. La longueur et le faible bombement du museau attestent qu’il s’agit d’un juvénile.
Lagon de l'Ermitage, La Réunion, océan Indien, 1,5 m, en PMT
29/12/2011


Variabilité de la couleur des nageoires
Certains des individus de ce groupe ont les nageoires jaunes, chez d’autres elles sont translucides. Chez d’autres encore, la caudale est bicolore, ce qui manifeste le passage d’une couleur à l’autre.
Lagon de l'Ermitage, La Réunion, océan Indien, 1,5 m, en PMT
27/04/2013


Livrées nocturnes
La livrée de nuit est variable, en voici quelques aspects :
Photo A : la couleur de fond est blanche et marquée par trois à quatre selles d’un rouge plus ou moins terne en partie dorsale. Ces selles recouvrent en la rougissant la bande jaune longitudinale présente sur les flancs, qui reste discrète. Le jaune des nageoires prend une teinte fumée.
Photo B : on trouve trois larges selles grises en partie dorsale, et une partie ventrale entièrement rouge à l’exception du pédoncule caudal. La bande jaune longitudinale est effacée, mais ses bordures de taches bleues sont perceptibles.
Photo C : cette livrée « extrême » est discrètement colorée relativement aux précédentes. Quatre selles d’un jaune très pâle à peine perceptible marquent une partie dorsale blanche, et la partie ventrale est parme. La marque des selles sur la bande longitudinale produit des rectangles rouges, qui alternent avec des rectangles blancs où se distinguent à peine des traces de la bande jaune presqu’entièrement effacée.
Lagon de l'Ermitage, La Réunion, océan Indien, 1,5 m, en PMT et de nuit
-


Juvéniles
Le corps des juvéniles est plus élancé que celui des adultes (la hauteur de leur corps est proportionnellement moins importante), et leur profil dorsal de tête est moins bombé. Ils ont les mêmes livrées que les adultes, comme on le voit ici avec une livrée rose et une livrée grise et blanche.
Lagon de l'Ermitage, La Réunion, océan Indien, 1,5 m, en PMT
09/02/2013
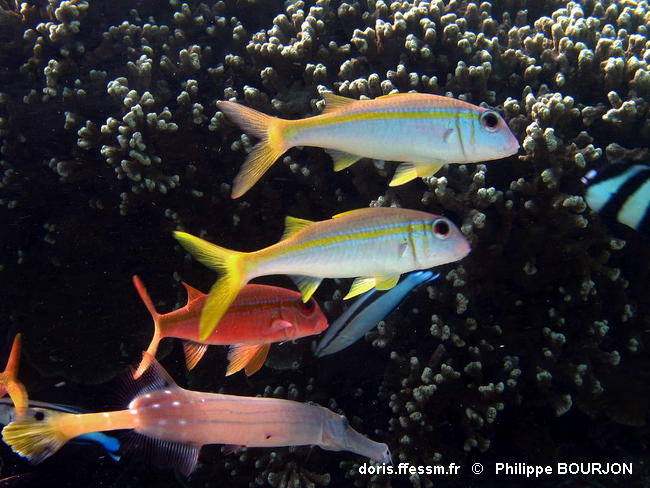

A la station de nettoyage
Les capucins sont victimes de nombreux ectoparasites, ce pourquoi ils sont des « clients » assidus des stations de nettoyage. En bas de la photo, un poisson trompette Aulostomus chinensis attend son tour pour profiter des services de l’un des deux prestataires de cette station, des labres nettoyeurs Labroides dimidiatus.
Lagon de l'Ermitage, La Réunion, océan Indien, 1,5 m, en PMT
21/06/2019


Avec Lutjanus kasmira
On voit ici un groupe de Mulloidichthys vanicolensis se diriger vers un groupe de Lutjanus kasmira. Plusieurs espèces du genre Mulloidichthys se mêlent aux groupes de poissons de familles différentes à la livrée proche de la leur. Les scientifiques supposent que ce comportement est lié à la sécurité apportée par un banc plus important. L. kasmira n’accepte pas toujours les capucins de Vanicolo quand il y a compétition pour la nourriture et les abris.
Passe de Gié, île des Pins, Nouvelle-Calédonie, océan Pacifique, 20 m
05/10/2009


Distribution : en mer Rouge
Mulloidichthys vanicolensis est présent en mer Rouge, ce qui n’est pas toujours le cas des espèces à distribution indo-Pacifique.
Abu Galawa Kebir, archipel des Fury Shoals, Egypte, mer Rouge, 10 m
14/10/2008


Distribution : en Indonésie
L’île de Sulawesi, en Indonésie, est un « hotspot » de la photo sous-marine. On peut y admirer, entre autres, le capucin de Vanicolo
Bira, sud Sulawesi, Indonésie, océan Pacifique,10 m
08/2006


Distribution : aux Philippines
Cette photo a été prise dans le parc naturel de Tubbataha, situé au milieu de la mer de Sulu aux Philippines. Ce parc est inscrit depuis 1993 sur sa liste du patrimoine mondial par l’Unesco.
Récif de Tubbataha, Philippines, océan Pacifique, 15 m
2017


Distribution : en Nouvelle-Calédonie
La Nouvelle-Calédonie se situe dans la limite sud de la distribution de l’espèce dans le Pacifique.
Passe Boulari, Nouvelle-Calédonie, 6 m
17/03/2019
Rédacteur principal : Philippe BOURJON
Vérificateur : Alain-Pierre SITTLER
Responsable régional : Alain-Pierre SITTLER
Bray R., Justine J-L., 2007, Homalometron moraveci n. sp. (Digenea: Apocreadiidae) in the yellowfin goatfish, Mulloidichthys vanicolensis (Valenciennes, 1831) (Perciformes: Mullidae), from New Caledonia and the Great Barrier Reef, with a checklist of digeneans of Mulloidichthys species, Zootaxa, 1525, 41-49.
Farrag M.M.S., Osman A.G.M., Mehanna S. F., Osman Y.A.A, 2018, Fisheries status of the common species of family Mullidae in the Southern Red Sea, Egypt, Egyptian journal of Aquatic Biology and Fisheries, 22(5), 249-265.
Krajewski J.P., Bonaldo R.M., Sazima C., Sazima I., 2004, The association of the goatfish Mulloidichthys martinicus with the grunt Haemulon chrysargyreum: an example of protective mimicry, Biota Neotropica, 4(2), 1–4.
McCormick M.I., 1993, Development and changes at settlement in the barbel structure of the reef fish, Upeneus tragula (Mullidae), Environmental Biology of Fishes, 37, 269-282.
Randall J.E., 2001, Mullidae. Goatfishes (surmulets), In: K.E. Carpenter and V. Niem (eds), The living marine resources of the Western Central Pacific, Vol. 5, Bony fishes part 3 (Menidae to Pomacentridae), pp. 3175-3200, Food and Agricultural Organization of the United Nations, Rome.
Randall J.E., Gueze P., 1980, The goatfish Mulloidichthys mimicus n. sp. (Pisces, Mullidae) from Oceania, a mimic of the snapper Lutjanus kasmira (Pisces, Lutjanidae), Bulletin du Muséum National d'Histoire Naturelle, Section A Zoologie Biologie et Ecologie Animales, 2(2), 603–609.
Rajan P.T., Sreeraj C.R., Titus I., 2012, The goatfishes (family Mullidae) of Andaman and Nicobar Islands, Records of the Zoological Survey of India, 111(3), 35–48.
Rasha Saeed A.A., Moharram S.G., Al-Abbasi F.A., 2016, A comparative gametogenesis and biochemical differentiation of goatfish (Family: Mullidae) from the Red Sea, Russian Journal of Marine Biology, 42(1), 42-50.
Řehulková E., Justine J.-L., Gelnar M., 2010, Five new monogenean species from the gills of Mulloidichthys vanicolensis (Perciformes: Mullidae) off New Caledonia, with the proposal of Volsellituba n. g. and Pennulituba n. g. (Monogenea: Dactylogyridae), Systematic Parasitology, 75, 125-145.
Schumacher B.D., Parrish J.D., 2005, Spatial Relationships Between an Introduced Snapper and Native Goatfishes on Hawaiian Reefs, Biological Invasions, 7(6), 925-933.
Stefien C.A., Randall J.E., Rosenblatt R.H., 1994, Genetic and morphological divergence of a circumtropical complex of goatfishes: Mulloidichthys vanicolensis, M. dentatus, and M. martinicus, Pacific Science, 48, 44-56.
Uiblein F., 2007, Goatfishes (Mullidae) as indicators in tropical and temperate coastal habitat monitoring and management, Maine Biology Research, 3(5), 275–288.
Uiblein F., 2011, Taxonomic review of Western Indian Ocean goatfishes of the genus Mulloidichthys (Family Mullidae), with description of a new species and remarks on colour and body form variation in Indo-West Pacific species, Smithiana Bulletin, South African Institute for Aquatic Biodiversity, 13, 51-73.
Whitley G.P., 1929, Studies in ichthyology, No. 3, Records of the Australian Museum, 17(3), 101–143.
Yahel R., Yahel G., Genin A., 2002, Daily cycles of suspended sand at coral reefs: a biological control, Limnology and Oceanography, 47(4), 1071-1083.
La page de Mulloidichthys vanicolensis sur le site de référence de DORIS pour les poissons : FishBase
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.