Taille allant jusqu’à 25 mm, couleur brun ou brun-vert
Tête avec 2 paires d'antennes assez longues, dont la seconde paire est plus courte que la première
Antennes 1 avec un flagelle accessoire
Antennes 2 pileuses
Yeux réniformes
Uropode 3 avec exopode de taille normale, pileux, et endopode résiduel
Urosome présentant de nombreuses épines dorsales
Corps aplati latéralement et arqué ventralement
7 paires de péréiopodes* thoraciques dont les 3 dernières sont de sens opposé aux 4 premières et avec de nombreuses épines, ainsi que 3 paires de pléopodes* abdominaux
Gammare d'eau douce : ce nom est issu de l’INPN, il s’applique plutôt à Gammarus pulex. La demande pour Gammare marin est faite à l'INPN.
Scuds (nom général pour les Gammaridés) (GB)
Gammarus marinus Leach, 1815
Chaetogammarus marinus (Leach, 1815)
Echinogammarus marinus (Leach, 1816)
Atlantique Nord-Est
Zones DORIS : ● Europe (côtes françaises)Cette espèce fréquente les eaux de l’Atlantique Nord-Est, depuis le Portugal jusqu’à la Norvège. Elle est absente en Méditerranée.
Marinogammarus marinus est une espèce de la zone de balancement des marées, rencontrée sous les pierres ou parmi les algues. Elle fréquente également les plages de sable fin à proximité des zones rocheuses. Elle se rencontre depuis le haut de l’estran (plus bas que les Orchestia cependant) jusqu’au niveau de mi-marées (bien que des rapports mentionnent des prélèvements à la drague de cette espèce par une vingtaine de mètres de fond). L’espèce est fortement eurhyaline* et peut être rencontrée en estuaire. Elle peut supporter de longues périodes d’émersion.
C'est un petit crustacé de couleur gris-brun à vert, dont la taille peut atteindre 25 mm pour les mâles et 20 mm pour les femelles. Le corps est comprimé latéralement et un peu arqué ventralement.
La tête porte deux paires d’antennes* dont la longueur atteint un peu moins de la moitié de la longueur du corps. La première paire d’antennes est un peu plus longue que la seconde et porte un flagelle* accessoire de 7 à 9 articles. Les antennes 2 sont très pileuses, particulièrement sur le flagelle. Celui-ci est lisse. Le flagelle des antennes 2 fait approximativement la même longueur que le pédoncule*.
Les yeux sont réniformes.
Le thorax porte sept paires de pattes (les péréiopodes*) :
- les deux premières paires sont préhensiles, ce sont les gnathopodes*. Chez les mâles, les gnathopodes 1 et 2 sont de taille presque similaire, le gnathopode 2 étant légèrement plus large et plus court que le gnathopode 1,
- la troisième et la quatrième paires s'agitent sans arrêt pour amener l'eau aux branchies situées sur la face ventrale du thorax,
- les trois dernières servent à la marche.
Les péréiopodes 5 à 7 comportent des épines.
L'abdomen porte 3 paires d'appendices (les pléopodes*) aplatis et garnis de soies. Ils servent à la nage et à la ventilation des œufs fécondés.
L’extrémité du corps, l’urosome*, est constituée de trois segments portant chacun une paire d’uropodes*. Les uropodes sont biramés. L’uropode 3 comporte un exopode* normal et un endopode* rudimentaire. Le coin postéro-ventral de la plaque épimérale 3 comporte une pointe bien visible à la loupe binoculaire.
L’urosome comporte de nombreuses épines dorsales sur chaque segment.
L’angle postéro-ventral des plaques épimérales présente une pointe.
Tous les représentants de la famille des Gammaridés se ressemblent fortement au premier abord et il est nécessaire d’être très attentif pour avancer dans la détermination, celle-ci n’étant généralement possible que sous loupe binoculaire. Il sera ici pertinent, après avoir constaté que les deux paires d’antennes* ont une taille sensiblement similaire (les antennes 1 sont légèrement plus longues que les antennes 2), d’examiner les uropodes* 3, marqués par une forte asymétrie entre les endopodes* et les exopodes*.
Plusieurs espèces appartenant aux genres Marinogammarus et Echinogammarus peuvent être rencontrées :
Les Gammaridés sont des détritivores*, se nourrissant de débris animaux ou végétaux. Marinogammarus marinus est connu pour être également un prédateur actif de vers oligochètes comme Tubificoides benedii, de petits isopodes comme Jaera nordmanni, voire du collembole Anurida maritima. Les études conduites par Jaimie Dick & al. (2005) ont montré que les femelles pourraient consommer davantage d’aliments d’origine animale que les mâles, ce qui peut surprendre compte tenu de leur taille plus faible mais qui se comprend facilement en raison des besoins particuliers au moment de la reproduction (vitellogenèse*).
Les sexes sont séparés et il existe un dimorphisme* sexuel, les mâles étant plus grands que les femelles (25 mm maximum contre 20 mm). Les gnathopodes* du mâle sont beaucoup plus imposants que ceux des femelles. Les femelles matures disposent d’une poche marsupiale constituée de quatre paires d’oostégites*, situées entre les paires de péréiopodes* 2 à 5. Ces oostégites sont dotés de longs poils (ou soies*) sur leurs bords, facilitant le maintien des œufs dans la poche marsupiale ou marsupium*.
Le sex-ratio des populations est généralement déséquilibré. Selon les périodes de l’année et les populations observées, il peut arriver que ce déséquilibre s’annule ou s’inverse. La photopériode joue un rôle dans le sex-ratio, les jours longs conduisant à un déséquilibre en faveur des mâles.
Le rythme de reproduction varie en fonction de la température de l’eau. En Norvège, l’espèce est univoltine (une reproduction par an). En Normandie, l’espèce est bivoltine. Au Portugal, dans l’estuaire du Mondego, l’espèce est multivoltine et se reproduit tout au long de l’année, avec des pics au printemps et à l’automne. Cependant, les travaux conduits par Yasmin Guler (2012) sur des populations de Langstone Harbour (sud de l’Angleterre) ont mis en évidence une reproduction multivoltine, avec des femelles ovigères* observables tout au long de l’année.
Les femelles arrivent à maturité sexuelle plus rapidement que les mâles. La fécondité est proportionnelle au poids des femelles (plus les femelles sont lourdes, plus elles portent de larves*). Chaque femelle porte en moyenne 20 œufs à chaque portée.
Comme chez beaucoup de gammaridés, le mâle repère la femelle prête à l’accouplement grâce aux phéromones* relâchées par cette dernière (il pourrait en fait s’agir d’une hormone impliquée dans la mue de la femelle, l’ecdysone). Il se positionne alors sur le dos de la femelle et reste dans cette position jusqu’à ce que la femelle mue*, en l’agrippant avec sa première paire de gnathopodes au niveau des premiers tergites*
Peu après sa mue, la femelle pond ses œufs dans le marsupium*. Le mâle change alors de position et vient se positionner ventralement pour déposer son sperme sur les œufs. La fécondation des œufs est donc externe. Le mâle libère ensuite la femelle.
Après l’éclosion, les larves restent au sein du marsupium pendant quelques jours.
La contamination par les champignons Dictyocoela duebenum et Dictyocoela berillonum conduit à l’apparition d’individus intersexués, dont les capacités reproductives sont beaucoup plus faibles.
Il existe deux phénotypes de mâles intersexués : l’un présente des oostégites*, et parfois des ovaires, rudimentaires (intersexualité externe). L’autre ne présente pas d’oostégites rudimentaires (intersexualité interne). Des études ont montré que, si l’intersexualité externe peut bien être reliée à la contamination par Dictyocoela, l’intersexualité interne doit être expliquée par un autre phénomène.
Il est intéressant de noter que les individus intersexués ont un poids plus important que les individus normaux et ont un rythme de nutrition plus élevé. Ce poids plus important conduit à des difficultés pour la phase pré-copulatoire (les mâles normaux ont du mal à s’accrocher à une femelle plus grosse, et les mâles intersexués ont des gnathopodes plus petits qui nuisent à l’accrochage). Les femelles intersexuées ont par ailleurs une capacité reproductive plus faible que les femelles normales. L’intersexualité a un impact important sur les populations de Marinogammarus marinus.
Marinogammarus marinus peut être parasité par les microsporidies (des champignons) Dictyocoela berillonum et Dictyocoela duebenum. Cette espèce peut également être parasitée par des protistes* du genre Paramarteila, dont les microsporidies seraient des hyperparasites. Cette infection conduit à une féminisation des mâles. Cette espèce peut également être parasitée par des vers trématodes pour lesquels M. marinus servirait d’hôte intermédiaire (l’hôte final étant un poisson).
La durée de vie des individus est généralement comprise entre 10 et 12 mois. Les femelles semblent mourir plus jeunes que les mâles, sans doute en raison du coût énergétique lié à la reproduction. Les populations sont plus nombreuses en été.
Gammare marin : francisation du nom scientifique.
Le nom de genre Marinogammarus est constitué du préfixe marino-, provenant du néolatin [marinus] = marin et du suffixe gammarus, qui provient du latin [gammarus] ou [cammarus] = nom d'un crustacé indéterminé, crevette, écrevisse. Ce nom de genre a été créé en 1937 par Adolf Schellenberg (1882-1954), par dérivation du nom de genre Gammarus.
Le nom d’espèce marinus provient du néolatin [marinus] = marin.
Numéro d'entrée WoRMS : 102261
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Arthropoda | Arthropodes | Animaux invertébrés au corps segmenté, articulé, pourvu d’appendices articulés, et couvert d’une cuticule rigide constituant leur exosquelette. |
| Sous-embranchement | Crustacea | Crustacés | Arthropodes à exosquelette chitineux, souvent imprégné de carbonate de calcium, ayant deux paires d'antennes. |
| Super classe | Multicrustacea | ||
| Classe | Malacostraca | Malacostracés | 8 segments thoraciques, 6 segments abdominaux. Appendices présents sur le thorax et l’abdomen. |
| Sous-classe | Eumalacostraca | Eumalacostracés | Présence d’une carapace recouvrant la tête et tout ou partie du thorax. |
| Super ordre | Peracarida | Péracarides | Les femelles sont dotées d'une cavité d'incubation formée par des expansions lamelleuses des péréiopodes. |
| Ordre | Amphipoda | Amphipodes | Péracarides comprimés latéralement, dépourvus de carapace, et possédant de nombreuses paires d'appendices souvent modifiés. Ils sont représentés par les gammares, les talitres, les caprelles... |
| Sous-ordre | Senticaudata | ||
| Famille | Gammaridae | Gammaridés | |
| Genre | Marinogammarus | ||
| Espèce | marinus |


Vue générale d'une femelle
Cette photo permet de voir les flagelles accessoires sur les antennes 1, les yeux réniformes et les gnathopodes des 2 premières paires de péréiopodes, bien développés chez les mâles. Les antennes 1 sont plus longues que les antennes 2.
Photo ex-situ d'un individu capturé sur l'estran, Pointe de la Rognouse, Binic (22)
29/10/2022


Vue du péréiopode 1 d’un mâle
Cette photo permet de voir le premier gnathopode*, qui présente une forme relativement allongée.
Photo prise au microscope d’un individu capturé sur l'estran, Pointe de la Rognouse, Binic (22)
29/10/2022


Vue du péréiopode 2 d’un mâle
Cette photo permet de voir le second gnathopode*. Son allure générale est très proche de celle du premier gnathopode. Il est sensiblement de la même taille que le premier, plus court et plus large, ce qui permet de faire la distinction avec Marinogammarus obtusatus, chez qui le second gnathopode est nettement plus gros que le premier.
Photo prise au microscope d’un individu capturé sur l'estran, Pointe de la Rognouse, Binic (22)
29/10/2022


Vue de l’uropode 3
Cette photo permet de voir un demi-uropode* 3. L’endopode* est beaucoup plus court que l’exopode*, ce qui permet de différencier rapidement les Gammarus des Echinogammarus.
Photo prise au microscope d’un individu capturé sur l'estran, Pointe de la Rognouse, Binic (22)
29/10/2022


Vue des pièces buccales
Chez les amphipodes, la première paire de pattes thoraciques, qui s’achèvent par un dactyle*, est transformée en maxillipèdes*. Elles ne servent donc pas à la locomotion mais à la mastication. Les maxillipèdes encadrent les maxilles.
Photo prise au microscope d’un individu capturé sur l'estran, Pointe de la Rognouse, Binic (22)
29/10/2022
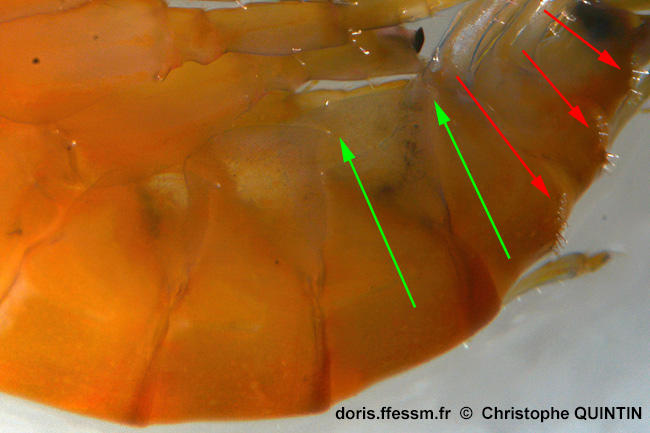
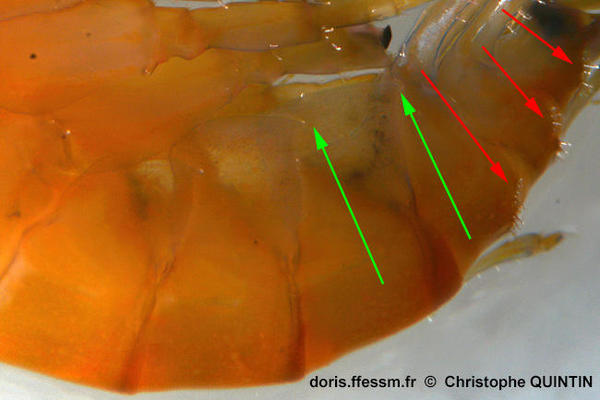
Vue de la plaque épimérale
Les flèches vertes pointent vers l’angle inférieur des plaques épimérales 2 et 3, qui présentent, comme la plaque épimérale 1, une pointe très nette chez Marinogammarus marinus, ce qui n’est pas le cas chez Marinogammarus obtusatus. Les flèches rouges pointent vers les nombreuses épines présentes sur le dos des segments de l’urosome qui sont à l'origine de l'ancien nom de genre Echinogammarus.
Photo prise au microscope d'un individu capturé sur l'estran, Pointe de la Rognouse, Binic (22)
29/10/2022

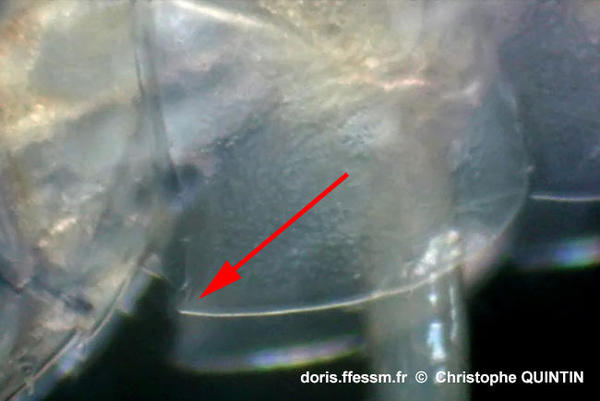
Vue des plaques épimérales
Les plaques
épimérales présentent une pointe très caractéristique
Photographie
prise en laboratoire (loupe binoculaire) d'un individu capturé à la pointe de la Rognouse, Binic (22)
29/04/2023
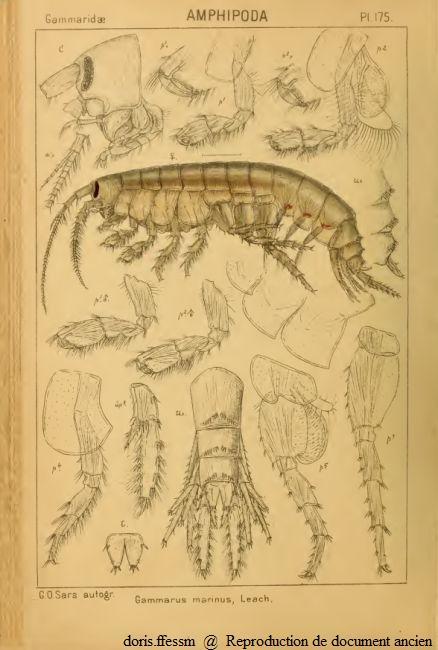
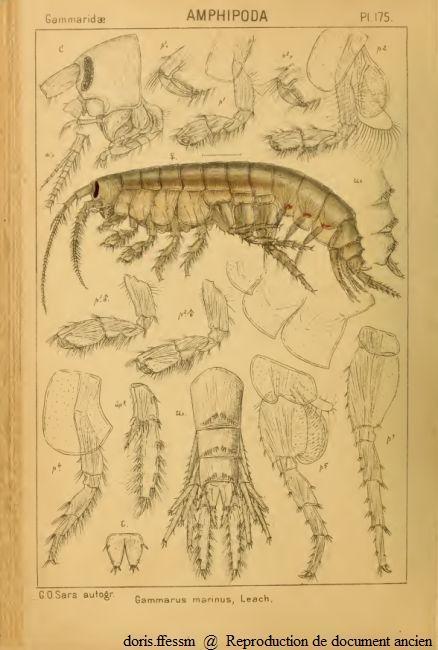
Marinogammarus marinus
Gammarus marinus est un ancien nom (= synonyme) de Marinogammarus marinus.
a = antenne, m = maxille, p = péreiopode, pl = pléopode, t = telson, up = uropode
Seuls les appendices du côté gauche ont été dessinés.
planche 175 de G.O. Sars, 1895
Reproduction de documents anciens
1895
Rédacteur principal : Christophe QUINTIN
Vérificateur : Pierre NOËL
Responsable régional : Yves MÜLLER
Alexander M.E., Dick J.T., O’Connor N.E., 2015, Predation in the marine intertidal amphipod Echinogammarus marinus Leach: Implication of inter- and intra-individual variation, Journal of Experimental Marine Biology and Ecology, 462: 50-54.
Barnett J.H., Yonge C.M., 19578, COLLINS POCKET GUIDE TO THE SEA SHORE, Collins, London, 272p.
Clément J.L., 1978, Invertébrés du littoral armoricain, Cercle naturaliste des étudiants nantais, Faculté des Sciences de Nantes, 95 p.
Dick J., Johnson M., McCambridge S., Johnson J., Carson V., Kelly D., MacNeil C., 2005, Predatory nature of the littoral amphipod Echinogammarus marinus : gut content analysis and effect of alternative food and substrate heterogeneity, Marine Ecology Progress Series, 291, 151-158.
Ford A.T., Fernandes T.F., Rider S.A., Read P.A., Robinson C.D., Davies I.M., 2003, Reproduction in the amphipod, Echinogammarus marinus : a comparison between normal and intersex specimens, Journal of the Marine Biological Association of U.K., 83, 937-940.
Ford A.T., Fernandes T.F., Rider S.A., Read P.A., Robinson C.D., Davies I.M., 2003, Measuring sublethal impacts of pollution on reproductive output of marine Crustacea, Marine Ecology Progress Series, 265, 303-309.
Ford A.T., Fernandes T.F., Read P.A., Robinson C.D., Davies I.M., 2004, The cost of intersexuality : A Crustacean Perspective, Marine Biology, 145 (5), 951-977.
Guler Y.Z., 2012, Population dynamics and sex-determining mechanisms in the marine amphipod Echinogammarus marinus, Doctor of Philosophy Thesis, University of Portsmouth, 200 p.
Le Mao P., Godet L., Fournier-Sowinski J., Desroy N., Thiébaut E., Gentil F., Pourinet L., Cabioch, L., Retière C., Chambers P., 2019, ATLAS DE LA FAUNE MARINE INVERTÉBRÉE DU GOLFE NORMANO-BRETON - VOLUME 4/7 ARTHROPODES, Editions de la Station biologique de Roscoff, 75p.
Marques J.C., Nogueira A., 1991, Life cycle, dynamics and production of Echinogammarus marinus [Leach (Amphipoda)] in the Mondego Estuary (Portugal), Oceanologica Acta, Proceedings of the International Colloquium on the environment of epicontinental seas, vol. sp. n°11, 213-223.
Short S., Yang G., Kille P., Ford A.T., 2012, A Widespread and Distinctive Form of Amphipod Intersexuality Not Induced by Known Feminising Parasites, Sexual Development (6), 320-324.
Stebbing, T. R. R., 1899, Amphipoda from the Copenhagen Museum and other sources, part II, The Transactions of the Linnean Society of London: Zoology. (ser 2) 8, 395-432, Pls 30-35.
Terry R.S., Smith J.E., Sharpe R.G., Rigaud T., Littlewood D.T., Ironside J.E., Rollinson D., Bouchon D., MacNeil C., Dick J.T., Dunn A.M., 2004, Widespread vertical transmission and associated host sex-ratio distorsion within the eukaryotic phylum Microspora, Proceedings of the Royal Society of London, 271, 1783-1789.
.La page de Marinogammarus marinus dans l'Inventaire National du Patrimoine Naturel : INPN (en attente de mise à jour)
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.