Colonies ressemblant à un bouquet en forme d'éventail et transparent comme de la gélatine
Taille maximum d'une colonie : 4 cm
Grands polypides se détachant nettement de la colonie
Couronne de tentacules en forme de fer à cheval
Lophopier
Bellflower animal, bell-flower animal, crystal moss animal (GB), Lappenmoostierchen, Lappenmoostier (D), Zakvormig mosdiertje (NL)
Tubularia crystallina (Pallas 1766)
Lophopus crystallinus Dumortier 1835
Lophopus trembleyi (Jullien 1885)
Europe, Moyen-Orient et Amérique
Zones DORIS : ● Eau douce d'Europe, ● Atlantique Nord-OuestL. crystallinus une espèce à distribution holarctique*. Il est présent un peu partout en Europe, et il est rare au Moyen-Orient (Israël, Perse) et en Amérique du Nord. Il semble être absent du Québec où on trouve une espèce fort proche d'aspect, Lophopodella carteri, cependant ses statoblastes* ont été trouvés dans les eaux de ballast de navires se rendant dans la région des grands lacs.
Dans la littérature scientifique anglaise, l'espèce a le statut "rare", un statut en partie peut-être dû au fait qu'elle passe souvent inaperçue. Elle est régulièrement rencontrée par les plongeurs du continent :
- en août 2007, des colonies ont été découvertes à 12 m de profondeur à Bosmolenplas aux Pays-Bas.
- en février 2010, des colonies ont été photographiées à 10 m de profondeur dans la carrière d'Opprebais en Belgique.
- en avril 2010, l'ONEMA et Serge Dumont (président de l'association Ried Bleu) ont découvert des colonies exceptionnellement nombreuses dans la gravière du Fort près de Strasbourg, à des profondeurs allant de 9 à 35 m ; en novembre 2012, les colonies sont toujours bien présentes.
- en mars 2013, confirmation de la présence de colonies dans le lac Bleu près d'Arras.
Si vous rencontrez cette espèce, un appel a signalement est en cours : RéseauDORIS.
On trouve les colonies principalement dans les lacs et les eaux à courant lent et calme, mais elles peuvent aussi être présentes dans des eaux à courant plus important. Elles sont fixées à différents substrats* solides : roches, bois, roseaux, plantes immergées ou flottantes, etc. (même sur des coquillages de mollusques et des étuis de trichoptères). L. crystallinus est plutôt eurytherme* (température de ≈3 °C à > 20 °C), avec néanmoins une préférence pour le froid. L. crystallinus persiste durant l'hiver ce qui, abstraction faite de Fredericella sp., est exceptionnel pour un bryozoaire dulcicole. Ses colonies peuvent donc s'épanouir pendant toute l'année dans les plans d'eau où la température reste froide.
Elles tolèrent une certaine eutrophisation* de l'eau.
Les Bryozoaires sont de minuscules animaux coloniaux dont les individus se présentent sous la forme d'une petite logette souple ou calcifiée (uniquement chez les espèces marines) appelée cystide* dans lequel se trouve le reste du corps (polypide*) qui comprend un grand estomac en U, une couronne de tentacules* formant le lophophore*, et un ganglion* nerveux cérébroïde*.
Lophopus cristallinus forme des colonies de couleur claire (blanc cassé à jaune clair selon son alimentation), d'aspect soyeux, transparentes comme de la gélatine et en forme de bouquet ou d'éventail (= rondes, dressées et reliées à leur base par une muqueuse transparente). Elles peuvent atteindre une taille de 40 mm et regroupent de 2 à 40 individus d'approximativement 2 mm. Le lophophore, en forme de fer à cheval, compte de 60 à 70 tentacules.
Souvent une fine membrane muqueuse transparente relie les colonies entre-elles. La base de cette membrane peut être encroûtée.
Lorsque les conditions sont favorables (basse température de l'eau), ces colonies peuvent se multiplier rapidement et recouvrir de grandes surfaces.
Cristatella mucedo : les jeunes colonies peuvent être confondues avec celles de L. crystallinus mais les colonies plus grandes sont allongées en forme de chenille gélatineuse ; à l'inverse de L. crystallinus, les colonies éclosent au printemps quand la température de l'eau dépasse 15 °C et disparaissent à l'automne quand elle redescend en-dessous de 8 °C ; les statoblastes sont parfaitement ronds et possèdent des crochets.
Lophopodella carteri : les colonies sont plus compactes (zoïdes* moins en éventail) avec un aspect globuleux, taille maximum d'un centimètre ; les statoblastes sont ovales avec plusieurs crochets aux extrémités mais pas de pointes donnant l'aspect d'un citron.
Si les lophophores sont rétractés, on peut également confondre Lophopus crystallinus avec des pontes de mollusques.
L. crystallinus se nourrit de toutes les particules qui peuvent passer par l'ouverture de la bouche des polypides, essentiellement du phytoplancton* et des bactéries. L'alimentation se fait aussi bien par filtration à l'aide des cils que par utilisation active des tentacules du lophophore.
Les colonies participent ainsi au filtrage de l'eau et au recyclage des nutriments.
Les bryozoaires se reproduisent par voie asexuée suivant deux modalités, et par voie sexuée.
Lophopus crystallinus a une reproduction principalement asexuée.
Elle peut se faire par accroissement de la colonie qui produit des nouveaux individus à partir de bourgeons d'accroissement. Chaque zoïde a sa face dorsale dirigée vers le haut. Sur sa face ventrale, se forment deux bourgeons en léger décalage gauche-droite qui se développent en deux nouveaux zoïdes. La colonie s'accroît ainsi en éventail, les nouvelles zoécies (= zoïdes) se disposant en un arc de cercle qui s'agrandit au fur et à mesure des générations. Quand une colonie compte de 20 à 40 individus, elle forme des lobules* et se découpe en petits groupes de deux ou trois individus qui reprennent leur croissance suive d'autotomie*.
Le deuxième mode est la production de statoblastes*. Ce sont des organes de résistance qui se développent dans la partie basse de l'animal. Ils ont la forme d'un minuscule citron de 1 mm de longueur pour 0,5 mm de largeur, de couleur brun clair à foncé. Flottants, ils sont emportés par les courants mais également par les oiseaux aquatiques (dans la boue attachée aux pattes ou dans l'intestin quand les colonies sont mangées) et probablement par les poissons. Quand les conditions environnementales redeviennent favorables (ces conditions sont encore mal connues : refroidissement de l'eau ?), les enveloppes des statoblastes s'ouvrent et donnent naissance à un jeune zoïde : l'ancestrule*. En comparaison avec d'autres espèces de bryozoaires dulcicoles, le nombre de statoblastes est relativement faible.
La reproduction sexuée semble être rare. L'espèce est hermaphrodite* et vivipare. Chaque individu possède ovaire et testicule. L'œuf fécondé s'installe dans un bourgeon modifié en poche incubatrice. Il en sort une larve ciliée* et nageuse. Cette larve est un zoïde primaire et, lors de son installation sur le substrat, elle se transforme en quelques minutes en zoïde.
L. crystallinus est l'hôte, peut-être unique, du parasite Buddenbrockia allmani qui appartient à la classe des myxozoaires (classe longtemps placée dans les protozoaires, mais dont les affinités se situent plutôt du côté de l'embranchement des cnidaires). L'infection ralentit la croissance de la colonie, son bourgeonnement et sa production de statoblastes. Il ne semble pas qu'il y ait contamination des poissons.
L. crystallinus peut encore héberger le microsporidien Nosema bryozoides.
Les colonies de L. crystallinus ont une mobilité restreinte ( 0,2 - 0,5 mm par heure, surtout les colonies jeunes). Elles se déplacent par des sortes de déformations de la partie du cystide qui adhère au support.
L. crystallinus arrive à se débarrasser des dépôts de vase. En effet, bien que le substrat environnant soit couvert de vase, la colonie est propre. Peut-être que la manière dont les zoécies sont groupées dans la colonie, favorise la création d'un courant d'eau qui maintient la colonie propre. Cependant, dans les situations où trop de vase se dépose sur la colonie, elle ne survit pas.
La colonie n'est pas non plus envahie par les algues ou les cyanobactéries. Cela pourrait-il indiquer une certaine forme de guerre chimique ?
Le système nerveux est rudimentaire et se réduit à un ganglion cérébroïde, situé à la base du lophophore, et à quelques fibres nerveuses qui en partent.
La respiration se fait par la peau, en particulier au niveau des tentacules.
C'est par la découverte faite par le suisse Abraham Trembley dans un étang près de La Haye en 1741, de colonies de Lophopus crystallinus (qu'il appelle « polype à panache »), que le groupe des bryozoaires apparaît dans l'histoire de la zoologie. En 1766, l'allemand Peter Simon Pallas baptise l'espèce Tubularia crystallina. En 1835, le belge Barthélémy-Charles Dumortier lui attribue le nom actuel.
Comme l'espèce est petite, elle n'attire pas l'attention et il est aisé de passer sans la voir.
Historique de son observation en France :
- à Paris même, dans les fossés du jardin d'acclimatation au bois de Boulogne et dans les bassins de l'école botanique du MNHN (Jullien 1885) ;
- dans le lac d'Orédon dans les Pyrénées (Despax 1926) ;
- à Gif-sur-Yvette et à Vaux-de-Cernay (Prenant et Bobin 1956) ;
- dans une gravière en Alsace (d'Hondt et Clauss 1999) ;
- dans le bief du moulin de Bohardy dans l'Èvre à Montrevault (Buton & Gabory 2008) ;
- dans deux autres gravières de la communauté urbaine de Strasbourg (Dumont 2010).
En Grande-Bretagne, L. crystallinus est une espèce prioritaire dans le cadre du Plan d'action pour la biodiversité. Ce plan a pour objectif de maintenir toutes les populations de bryozoaires d'eau douce et d'augmenter leur distribution géographique, éventuellement en utilisant des substrats artificiels pour faciliter la recherche et la surveillance : http://www.freshwaterhabitats.org.uk/projects/million-ponds/
Traduction française du nom scientifique.
Lophopus : du grec [lophos] = long poil, crinière, aigrette, panache ; en allusion au panache des lophophores ; et du grec [pus, podos] = pied.
crystallinus : du latin [crystallinus] = de cristal, en cristal, cristallin ; en allusion à l'aspect brillant et transparent de la colonie.
Numéro d'entrée WoRMS : 472353
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Bryozoa / Ectoprocta | Bryozoaires / Ectoproctes | Petits animaux coloniaux filtreurs aquatiques fixés à un substrat. Tous les zoïdes sont en continuité physique et issus de bourgeonnement à partir d’un individu unique. Chaque zoïde porte un lophophore rétractile et est abrité dans une logette. |
| Classe | Phylactolaemata | Phylactolèmes | Exclusivement en eau douce (sans vase excessive). Les zoïdes sont cylindriques et le lophophore est en forme de fer à cheval (sauf chez Fredericella). Les zoécies ne sont pas calcifiées et les zoïdes sont tous identiques. |
| Ordre | Plumatellida | Plumatellides | |
| Famille | Lophopodidae | Lophopodidés | |
| Genre | Lophopus | ||
| Espèce | crystallinus |
 Bryozoaires, Brachiopodes et Phoronidiens
Bryozoaires, Brachiopodes et Phoronidiens

Identification
Lophopus cristallinus forme des colonies de couleur claire (blanc cassé à jaune clair selon son alimentation), d’aspect soyeux, transparentes comme de la gélatine et en forme de bouquet ou d'éventail (= rondes, dressées et reliées à leur base par une membrane muqueuse transparente). Elles peuvent atteindre une taille de 40 mm et regroupent de 2 à 40 individus d'approximativement 2 mm.
Carrière d'Opprebais (Belgique), 10 m, de nuit
25/02/2010
 Bryozoaires, Brachiopodes et Phoronidiens
Bryozoaires, Brachiopodes et Phoronidiens

En plongée
On trouve les colonies principalement dans les lacs et les eaux à courant lent et calme, mais elles peuvent aussi être présentes dans des eaux à courant plus important. Elles s’épanouissent de septembre à mars, voire pendant toute l'année dans les plans d'eau où la température reste froide.
Remarque : sur la gauche, une éponge d'eau douce (peut-être Spongilla lacustris)
Gravière du Fort (Strasbourg), 13 m
08/02/2011


Discretion
L'auteur de la photo, Jean-Sébastien BOURGOIS, indique qu'il est très facile de passer sans voir les colonies : son binôme ne les a pas vues malgré qu'il les lui ait montrées.
Il faut nuancer le statut "rare" de l'espèce qui est peut-être en partie dû au fait qu'elle passe souvent inaperçue.
Lac Bleu (Roeux), 14 m
16/03/2014


Membrane muqueuse transparente
Souvent une fine membrane muqueuse transparente relie les colonies entre-elles.
Carrière d'Opprebais (Belgique), 10 m, de nuit
25/02/2010


Base encroûtée
La base de la membrane muqueuse peut être encroûtée.
Gravière du Fort (Strasbourg)
2011


Sur une moule zébrée
Les colonies sont fixées à différents substrats solides : ici, une moule zébrée (Dreissena polymorpha)
Gravière du Fort (Strasbourg)
2010



En hiver
L. crystallinus est plutôt eurytherme* (température de ≈3 °C à > 20 °C), avec néanmoins une préférence pour le froid. L. crystallinus persiste durant l'hiver ce qui, abstraction faite de Fredericella sp., est exceptionnel pour un bryozoaire dulcicole.
Lac Bleu (Roeux), 10 m
03/03/2013


Alimentation
L. crystallinus se nourrit de toutes les particules qui peuvent passer par l'ouverture de la bouche des polypides*, essentiellement du phytoplancton* et des bactéries.
Gravière du Fort (Strasbourg), 153 m
08/02/2011


Filtration
L'alimentation se fait aussi bien par filtration à l’aide des cils que par utilisation active des tentacules* du lophophore*.
Gravière du Fort (Strasbourg), 13 m
08/02/2010


Lophophore
La couronne de tentacules, en forme de fer à cheval, compte de 60 à 70 tentacules.
Gravière du Fort (Strasbourg)
2011
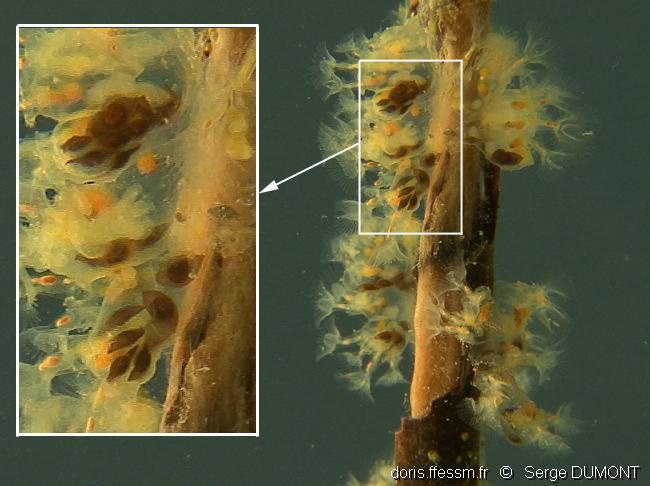
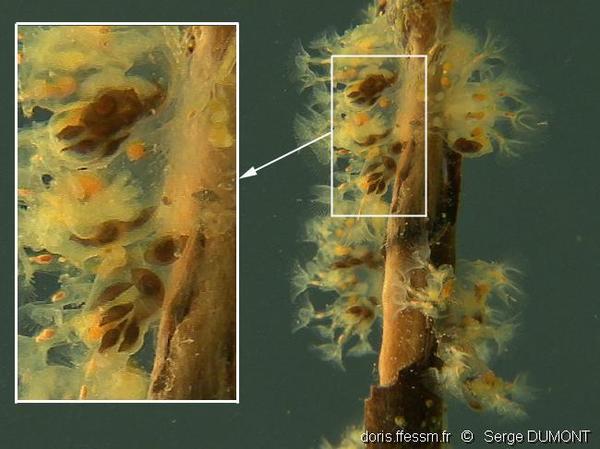
Statoblastes
Les statoblastes sont des organes de résistance qui se développent dans la partie basse de l’animal. Ils ont la forme d'un minuscule citron de 1 mm de longueur pour 0,5 mm de largeur, de couleur brun clair à foncé.
Gravière du Fort (Strasbourg), 14 m
08/03/2011


Bourgeons d’accroissement
Chaque zoïde a sa face dorsale dirigée vers le haut. Sur sa face ventrale, se forment deux bourgeons en léger décalage gauche-droite qui se développent en deux nouveaux zoïdes. La colonie s'accroît ainsi en éventail, les nouvelles zoécies (= zoïdes) se disposant en un arc de cercle qui s'agrandit au fur et à mesure des générations.
Lac Bleu (Roeux), 10 m
03/03/2013
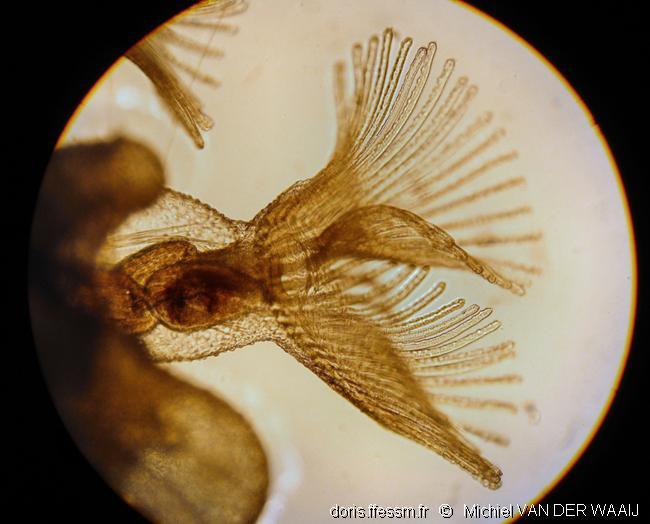
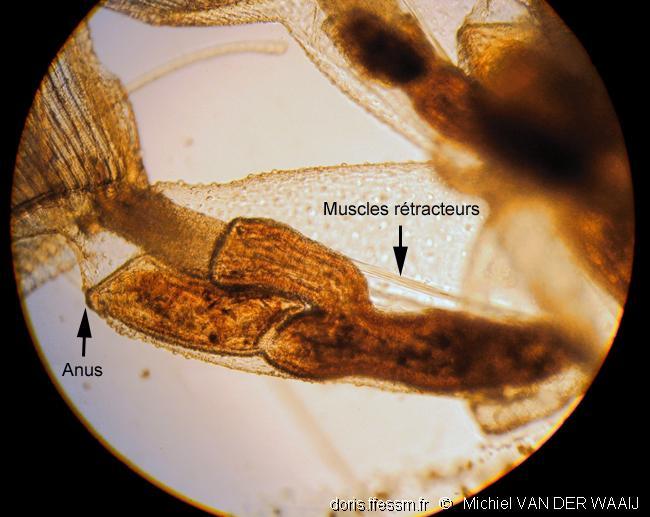
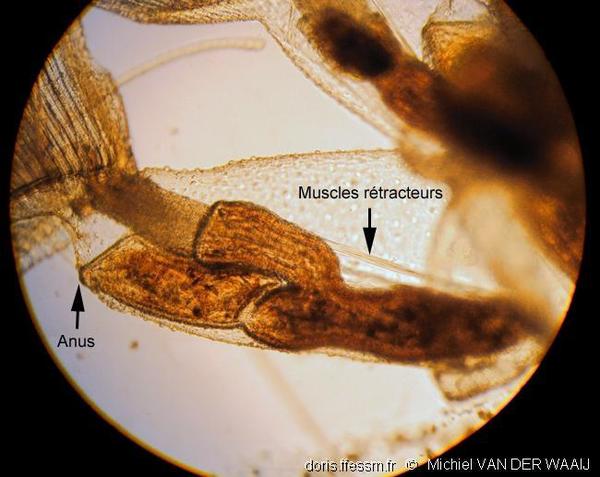
Polypide
Le polypide* comprend un grand estomac en U, une couronne de tentacules* formant le lophophore*, et un ganglion* nerveux cérébroïde*.
N/A
N/A
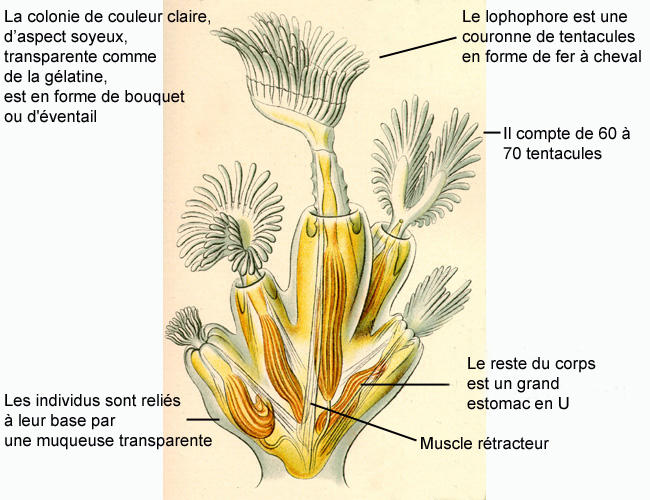
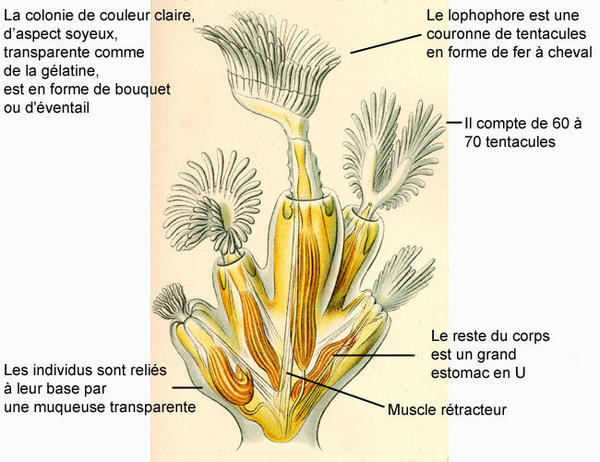
Planche naturaliste
Ernst Haeckel, 1900, KUNSTFORMEN DER NATUR, 100 TAFELN MIT TEXT
Cette image fait partie de Kurt Stübers Online Library
N/A
Reproduction de documents anciens
1900


Colonie formée à partir d'un statoblaste
in Grassé P.P., 1960, volume 5, fascicule 2
Reproduction de documents anciens
N/A
Rédacteur principal : Jean-Pierre COROLLA
Vérificateur : Frédéric ANDRÉ
Correcteur : Jos MASSARD
Correcteur : Gaby GEIMER
Responsable régional : Jean-Pierre COROLLA
Responsable régional : Michel KUPFER
Blanchard N., 2010, Découverte surprenante [faite par Serge Dumont] en Alsace : une espèce rarissime de bryozoaire dans une gravière, Dernières Nouvelles d’Alsace, 80.
Buton M., Gabory O., 2008, Les Bryozoaires des Mauges et des bords de Loire : historique et état des connaissances, Mauges Nature, Bulletin de liaison, 83, 1-6.
Canning E., Curry A., Hill S., Okamura B., 2007, Ultrastructure of Buddenbrockia allmani n. sp. (Myxozoa, Malacosporea), a parasite of Lophopus crystallinus (Bryozoa, Phylactolaemata), Journal of Eukaryotic Microbiology, 54(3), 247-262.
Despax R., 1926, Bryozoaires rencontrés dans quelques lacs pyrénéens, Bulletin de la Société d'Histoire naturelle de Toulouse, 54, 18-23.
D'Hondt J.L., Clauss T., 1999, Présence dans l’est de la France de Lophopus crystallinus (Pallas, 1768) (Bryozoaires, Phylactolaemates), Bulletin mensuel de la Société linnéenne de Lyon, 68(3), 49-54.
Hartikainen H., Hill S.L., Okamura B., 2008, Distribution and conservation of Lophopus crystallinus in the UK, in : Hageman S.J., Key M.M. & Winston J.E. (Eds), BRYOZOAN STUDIES 2007 : Proceedings of the 14th International Bryozoology Conference, Boone, North Carolina, July 1-8, 2007, Virginia Museum of Natural History Special Publication, 15, 57-56.
Hill S., Okamura, B., 2005, A review of the ecology of Lophopus crystallinus (Plumatellida, Lophopodidae), a rare species within the U.K., Denisia, 16, 193-201.
Hill S.L., Sayer C.D., Hammond P.M., Rimmer V.K., Davidson T.A., Hoare D.J., Burgess A., Okamura B., 2007, Are rare species rare or just overlooked ? Assessing the distribution of the freshwater bryozoan Lophopus crystallinus, Biological Conservation, 135, 223-234.
Jiménez-Gur E., Philippe H., Okamura B., Holland W.H., 2007, Buddenbrockia is a cnidarian worm, Science, 317(5834), 116-118.
Kipp R., Balley S.A., MacIsaac H.J., Ricciardi A., 2010, Transoceanic ships as vectors for nonindigenous freshwater bryozoans, Diversity and Distributions, 16(1), 77-83.
Marcus E., 1934, Über Lophopus crystallinus (Pall.), Zoologische Jahrbücher (Abteilung für Anatomie und Ontogenie der Tiere), 58(4), 501-606.
Massard J., Geimer G., 2008, Global diversity of bryozoans (Bryozoa or Ectoprocta) in freshwater: an update, Bulletin de la Société des naturalistes luxembourgeois, 109, 139-148.
Okamura B., Hill S., 2004, Phylogeography of the rare bryozoan, Lophopus crystallinus, Freshwater Biological Association, 3p.
Ricciardi A., 1992, Taxonomy, distribution and ecology of the freshwater sponges (Porifera: Spongillidae) and bryozoans (Ectoprocta) of Eastern Canada, Department of Entomology McGill University Montreal, Quebec, 162p.
Waajen S., 2007, Lophopus crystallinus : een zeldzaam zoetwater mosdiertje in de Bosmolenplas, Stichting Anemoon.
La page sur Lophopus crystallinus dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.