Corps cylindrique fusiforme et musculeux
Tête entourée de 8 bras avec 2 rangées de ventouses et 2 tentacules
2 gros yeux
Extrémité des tentacules en massue avec 4 rangées de ventouses de même taille
Nageoires se rejoignant à l’extrémité du corps s’étendant sur les 3/4 de la longueur du manteau
Changements de couleur rapides
Les 2 sexes portent des marques colorées (flammes) fusiformes sur les côtés latéraux antérieurs du manteau
Longueur du manteau 20 à 40 cm (jusqu'à 90 cm chez les mâles et 40 cm pour les femelles)
Encornet veiné, encornet de Forbes, calmar, calamar, casseron, chipiron (Pays Basque), supion (midi de la France).
Cette espèce est souvent confondue avec Loligo vulgaris.
Squid, long-finned squid, veined squid, northern squid, lura, Forbe's squid, common squid (GB), Calamaro comune (I), Calamar, calamar veteado, calamar de Forbes (E), Gewöhnlicher Kalmar, Langflossenkalmar, nordische Kalmar, Kurzschwanzkrebs rote, Forbes Kalmar (D), Noordse pijlintvis (NL), Lula-riscada (P).
Loligo fusus Risso, 1854
Loligo moulinsi Laffont, 1871
Mer du Nord, Manche, Atlantique Est, Méditerranée
Zones DORIS : ● Europe (côtes françaises), ○ [Méditerranée française], ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]Cette espèce est présente aux îles Féroë et sur la côte nord-ouest de la Norvège (63°N), en mer du Nord (mais elle semble absente de la Baltique), dans l'Atlantique Est jusqu'aux Açores (mais est relativement rare dans le golfe de Gascogne), et en mer Méditerranée.
C'est le seul représentant de la famille des Loliginidés présent aux Açores.
Le calmar veiné est une espèce néritique* et démersale* présente entre la surface et 400 m de profondeur, dans les eaux tempérées et subtropicales peu profondes et sur le plateau continental. En Méditerranée, le calmar veiné vit plutôt sur le rebord du plateau continental et la partie supérieure du talus.
Loligo forbesii est très proche de L. vulgaris mais la surface ventrale et les côtés latéraux antérieurs du manteau* portent des marques (flammes) longitudinales de couleur orangé-rouge. Ces marques sont plus grandes, plus nombreuses et plus intensément colorées que chez L. vulgaris et sont présentes chez les deux sexes.
La longueur du manteau* des mâles peut atteindre 90 cm et 40 cm chez les femelles. Mais la taille commune est de 20 à 40 cm de longueur. La longueur du manteau est la mesure de longueur utilisée chez ces animaux (la tête et les tentacules ne sont pas pris en compte dans cette mesure).
Les nageoires en position dorsolatérale, en forme de losange, couvrent les 3/4 de la longueur du manteau. L'extrémité apparaît pointue par la jonction des 2 nageoires.
Comme les autres décapodiformes (ou Decabrachia), ce calmar possède 8 bras et 2 tentacules*. Chaque bras porte 2 rangées de ventouses sur toute sa longueur. Les tentacules sont terminés par une massue tentaculaire qui porte les ventouses ; les 2 rangées médianes de ventouses des massues tentaculaires ont la même taille que les autres rangées. Les 2 tentacules servent à la capture des proies et ne sont visibles que lors de la capture de celles-ci ou chez l'animal mort.
Chez le mâle, le bras ventral gauche est modifié en bras copulateur (ou bras hectocotyle*). Il porte des papilles (des ventouses modifiées) sur le tiers de son extrémité.
La tête porte 2 grands yeux recouverts d’une mince membrane cornéenne transparente (caractéristique de l’ordre des Myopsides).
Le calmar veiné peut changer rapidement de couleur grâce au contrôle nerveux des chromatophores*.
D'autres calmars sont également présents dans les mêmes eaux :
Des Loliginidés comme :
Loligo vulgaris est souvent confondu avec L. forbesii. Toutefois quelques caractéristiques permettent de les distinguer :
Loligo pealei Lesueur, 1821, dans l'Atlantique Nord-Ouest ;
Loligo reynaudii d'Orbigny [in Férussac & d'Orbigny], 1839-1841, en Afrique du Sud ;
Alloteuthis media (Linnaeus, 1758) et Alloteuthis subulata (Lamarck, 1798) chez ces espèces l’extrémité postérieure du manteau est très pointue. Les Alloteuthis sont souvent confondus avec les jeunes Loligo.
Des Ommastrephidés comme
Illex coindetii (Vérany, 1839) Le manteau est long et étroit plus large à l’extrémité antérieure. Les nageoires disposées à l’extrémité du manteau forment un cœur un peu évasé , l'extrémité postérieure apparaît ainsi pointue. L’extrémité en massue des deux tentacules porte de petites ventouses disposées en 8 rangées longitudinales. C’est une caractéristique du genre Illex car les autres Ommastrephidés n’ont que 4 rangées de ventouses à cet endroit.
Dans la famille des Ommastrephidés, six autres espèces sont présentes dans l’Atlantique nord est. Les représentants de cette famille (sauf le genre Illex) possèdent 4 rangées longitudinales de petites ventouses sur les massues des tentacules.
Les Loliginidés sont des prédateurs actifs jouant un rôle important dans le réseau trophique*.
Les calmars capturent leur proie en faisant jaillir les deux tentacules* munis de ventouses uniquement sur leurs extrémités en forme de massues et la ramènent dans la couronne des bras pour la maintenir. Leur bec corné (bec de perroquet) sert à déchiqueter la proie. Leur salive contient des substances neurotoxiques* (et entre autres de très nombreux enzymes et neurotransmetteurs). La radula* sert à convoyer la nourriture.
L’identification des proies consommées est possible (mais délicate car il y a peu de restes solides), par l’étude du contenu stomacal, grâce aux otolithes* des poissons (qui sont bien préservés dans l’estomac faiblement acide), aux vertèbres et aux écailles, aux becs des céphalopodes et à des fragments des exosquelettes des crustacés.
L. forbesii se nourrrit de poissons téléostéens démersaux*, et pélagiques, de Clupéidés (Clupea harengus, Sprattus sprattus), de Gadidés (Merlangius merlangius, Trisopterus spp.), de Gobiidés, de Carangidés (Trachurus picturatus), et d'Ammodytidés, de Callyonymidés, des crustacés et des céphalopodes.
En Mediterranée il consomme des espèces de la pente continentale comme des poissons de la famille des Myctophidés et crustacés Euphausiacés.
Le cannibalisme est commun.
Loligo forbesii est une espèce annuelle semelpare* présentant une saison de reproduction prolongée mais unique.
Chez le mâle, les spermatozoïdes sont enfermés dans une structure très élaborée, le spermatophore*. Ce spermatophore est un tube chitineux* étroit que le mâle passe à la femelle au moyen d’un bras modifié, l’hectocotyle*. Un mâle possède de nombreux spermatophores qu'il transmet à la femelle, lors de l'accouplement.
Ces accouplements ont en commun un caractère plus ou moins agressif, tournant souvent à la violence.
En captivité, l'accouplement "tête à tête" a été observé. Le mâle face à la femelle la saisit par la tête et dépose, avec son bras hectocotyle, ses spermatophores sur la membrane buccale de la femelle. Les spermatophores se dévaginent et libèrent les spermatozoïdes qui pénètrent dans la bourse copulatrice (réceptacle séminal) où ils sont immobilisés par un liquide sécrété par la paroi de cette bourse.
Lors de la ponte, d'autres comportements ont été observés :La fécondation des ovules* a lieu au moment de la ponte. Les œufs, un peu allongés, sont plus grands (3.2 X 1.9 mm), et moins nombreux (une cinquantaine) que chez L. vulgaris. Ils sont emballés dans un cordon relativement épais, d’aspect laiteux lorsqu'ils viennent d'être pondus. La "gelée" entourant les œufs sécrétée par les glandes nidamentaires de la femelle serait plus transparente et brillante que chez L. vulgaris, de sorte que chaque œuf peut être vu à travers la gelée.
La durée du développement dépend de la température de l'eau (140 jours à 6 °C et 30 jours à 16 °C). A l'éclosion, les petits ont une longueur de manteau de 3,5 à 4,9 mm et nagent activement.
Cette espèce aurait un cycle de vie d'environ 16 mois. Les individus meurent après la reproduction.
Le calmar veiné serait grégaire, mais on ignore s'il vit en banc tout au long de sa vie (Pierce 1994).
Les calmars, comme les seiches, possèdent deux façons de se déplacer.
Lors de leur fuite en arrière, les calmars (ainsi que les seiches et les poulpes) peuvent éjecter un nuage d’encre afin de perturber ou leurrer l’agresseur.
Les rapides changements de couleurs sont assurés par l’expansion de cellules pigmentées, les chromatophores*, présentes sur tout le corps. Au repos les chromatophores sont petits et grands quand ils sont étendus. Quand les fibres musculaires des chromatophores cessent de se contracter le chromatophore revient à son état (petit) initial.
De nombreux comportements et motifs colorés ont été observés et décrits chez des individus en captivité (Porteiro & al 1990).
La rigidité du corps est en partie assurée par une mince lame chitineuse* transparente présente dorsalement presque droite et un peu dilatée à la partie supérieure, la plume (ou gladius). Cette structure correspond à la base chitineuse d'une coquille régressée dont la calcification a été perdue.
Les jeunes individus plus particulièrement, effectuent des migrations verticales quotidiennes liées à l’alimentation. Ils restent près du fond pendant la journée puis se dispersent dans la colonne d’eau pendant la nuit.
Les populations de l'Atlantique nord-est hivernent dans les eaux plus profondes au large des côtes françaises puis migrent plus au nord de mai à juin-juillet, dans la mer du Nord pour frayer. Une migration similaire, du golfe de Gascogne et des eaux plus méridionales vers la Manche se produit probablement également. Les migrations vers le sud ont lieu à l'automne.
En Méditerranée occidentale, les calmars européens migrent vers des eaux plus profondes à la fin de l'automne ; les plus gros individus commencent leur migration vers les côtes dès janvier et février, suivis en été par les plus petits.
Bien que vivant normalement près du fond, l’animal peut monter bien au-dessus, notamment en chassant des proies.
Les Loligo sont des espèces comestibles faisant l'objet d'une pêche occasionnelle ou ciblée, intense et réglementée (chalut de fond, chalut pélagique, filets, lamparos, lignes). Le maintien des populations semble satisfaisant.
Les céphalopodes ont tendance à concentrer rapidement les métaux lourds (ou éléments traces métalliques) et autres substances toxiques dans leurs tissus, ce qui joue un rôle important dans la bioaccumulation* de ces polluants chez les prédateurs marins et a des implications pour la consommation humaine. Des niveaux élevés de cadmium et de mercure sont souvent enregistrés dans les tissus des céphalopodes mais uniquement dans la glande digestive (qui ne se consomme pas). Il n'y a aucune accumulation de métaux dans les tissus musculaires (le manteau* qui se mange).
Les calmars font partie des réseaux trophiques* marins. Des becs de Loliginidae ont été identifiés dans les contenus stomacaux de mammifères marins et de poissons prédateurs :
La baleine à bec commune (Hyperoodon ampullatus), le dauphin commun (Delphinus delphis ), le dauphin rayé (Stenella coeruleolba), le grand dauphin (Tursiops truncatus), le dauphin à flancs blancs de l'Atlantique (Lagenorhynchus acutus), l’épaulard ou orque (Orcinus orca), le globicéphale noir (Globicephala melas), le dauphin de Risso (Grampus griseus), le marsouin (Phocoena phocoena), le cachalot pygmée (Kogia breviceps), le grand cachalot (Physeter macrocephalus), le phoque gris (Halichoerus grypus), le phoque veau marin (Phoca vitulina), des poissons comme la morue franche (Gadus morhua) et la baudroie (Lophius piscatorius), la grande sériole (Seriola dumerili), l’espadon (Xiphias gladius), le sabre (famille des Trichiuridés) et même un oiseau, le grand labbe (Catharacta skua).
Les calmars possèdent des axones (fibres nerveuses des neurones) géants qui peuvent avoir un diamètre de 1,5 mm. Ces axones permettent une transmission de l'information nerveuse optimale et rapide aux muscles, ce qui permet une locomotion performante.
Ces axones géants ont été observés par L.W. Williams en 1909 et redécouverts par J.Z. Young en 1939. Cette caractéristique particulière a permis l'étude du fonctionnement des messages nerveux par Sir A. Huxley et Sir A. Hodgkin (tous les deux prix Nobel en 1963 pour ces travaux).
Les calmars sont répartis dans deux ordres: les Myopsides et les Œgopsides, selon la présence (Myopsides) ou l’absence (Œgopsides) d’une membrane cornéenne transparente couvrant l’œil. Les Loliginidés sont des Myopsides.
Calamar : du latin [calamus] = calame, roseau. La plume étant, comme le roseau, taillée pour l'écriture dans l'Antiquité.
Ce terme est, de nos jours, davantage utilisé sur les étalages des poissonniers et en gastronomie,
Encornet : nom littéral qui exprime sa forme,
Calmar serait l'appellation utilisée par les naturalistes.
veiné : ce terme correspond aux "veines", flammules, présentes sur les côtés antérieurs du manteau.
Loligo : du latin [lolligo]= seiche, calmar, nom utilisé par Pline, repris et modifié le naturaliste allemand Johann Gottlib Schneider (1750-1822) en 1784 puis en 1798 par le naturaliste français Jean Baptiste de Lamarck (1744-1829) pour établir les caractéristiques du genre.
forbesii : espèce dédiée à Edward Forbes, zoologiste marin britannique (1815-1854) par Japetus Steenstrup, zoologiste danois (1813-1897). L'usage est d'écrire plutôt forbesi mais les deux sont possibles. Le site de référence WORMS utilise forbesii.
Numéro d'entrée WoRMS : 140270
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Cephalopoda | Céphalopodes | Yeux complexes, coquille interne, externe cloisonnée ou absente, cavité palléale musclée, siphon musculeux, tentacules ou bras (munis de ventouses). |
| Sous-classe | Coleoidea | Coléoïdes | Ventouses sur les bras, au nombre de 8 au moins. Bras hectocotyle chez le mâle pour le transfert des spermatophores. 2 branchies, 2 néphridies, une coquille interne ou vestigiale, des chromatophores, une poche à encre, un grand cerveau. |
| Super ordre | Decapodiformes | Décapodiformes / Decabrachia | Céphalopodes à 8 bras et 2 tentacules de chasse. |
| Ordre | Myopsida | Myopsides | Calmars possédant une membrane cornéenne transparente recouvrant l'œil. Les tentacules et les bras portent des ventouses mais jamais de crochets. Cet ordre comprend 2 familles (dont les Loliginidés) et peu d'espèces mais ces dernières sont pour la plupart côtières et donc plus familières. |
| Famille | Loliginidae | Loliginidés | Calmars côtiers et peu profonds. Certaines espèces tolèrent de faibles salinités. Les nageoires se rejoignent à l'extrémité postérieure du corps et peuvent s'étendre sur une partie ou sur toute la longueur du manteau. Les bras portent généralement 2 rangées de ventouses et les massues tentaculaires en portent 4 rangées. Le bras inférieur gauche est généralement modifié chez les mâles adultes (bras hectocotyle). |
| Genre | Loligo | ||
| Espèce | forbesii |
 Céphalopodes
Céphalopodes

Dessin de Loligo forbesii
Il est regrettable qu’on ne voie pas les marques (flammes) longitudinales de couleur orangé-rouge sur les côtés latéraux antérieurs du manteau.
Dessin de l'atlas de Giuseppe Jatta, 1896, pl. 8 fig. 5
Reproduction de documents anciens
1896
 Céphalopodes
Céphalopodes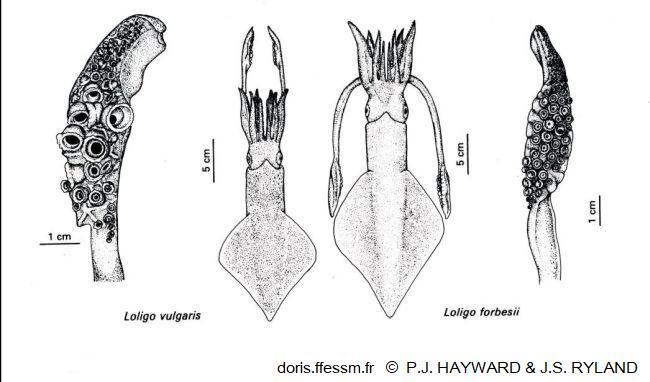
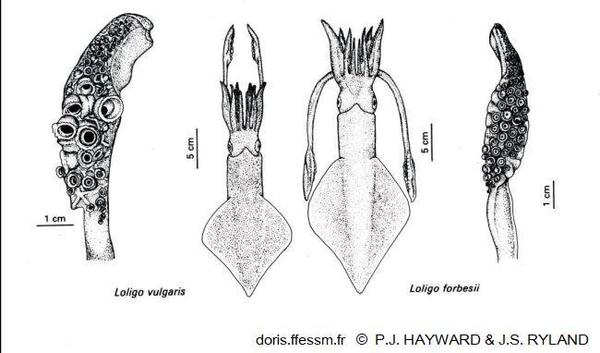
Comparaison de Loligo vulgaris et Loligo forbesii
La longueur du manteau est plus importante chez le second et ses nageoires couvrent une plus grande longueur de ce manteau. Les massues des tentacules ont de plus grandes ventouses chez L. vulgaris.
Dessin extrait de la planche 13-18 page 791 de Hayward & Ryland 1990
Reproduction de documents anciens
1990
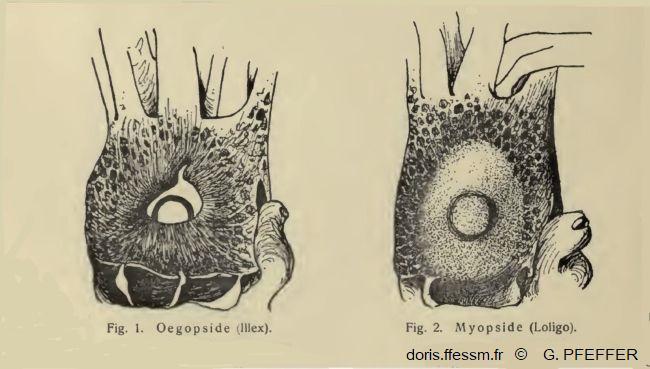
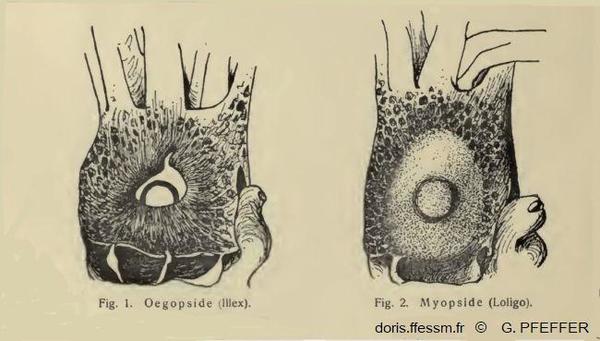
Comparaison de l'œil chez les Myopsides et les Œgopsides
Fig. 1 : Tête de Illex vue du côté droit, l'œil n'est pas recouvert d'une membrane cornéenne transparente. Ordre des Œgopsides.
Fig. 2 : Tête de Loligo vue du côté droit, l'œil est recouvert d'une membrane cornéenne transparente. Ordre des Myopsides.
Les calmars sont répartis dans deux ordres : les Myopsides et les Œgopsides, selon la présence ou l’absence d’une membrane cornéenne transparente couvrant l’œil. Les Loliginidés sont des Myopsides.
D'après deux dessins de G. Pfeffer 1901, IV, page 10.
Reproduction de documents anciens
1901


Plume ou gladius de calmar
C'est ce qui reste d'un calmar après disparition des tissus. Cette structure correspond à une coquille régressée à l'état d'une lamelle chitineuse, elle assure la rigidité du corps de l'animal.
Au fond de la forme 4, Dunkerque (59), 8 m
16/02/07
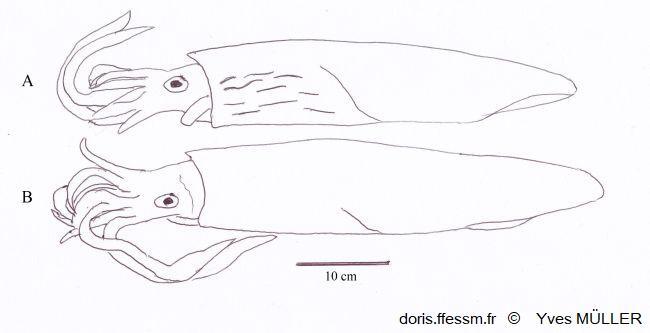
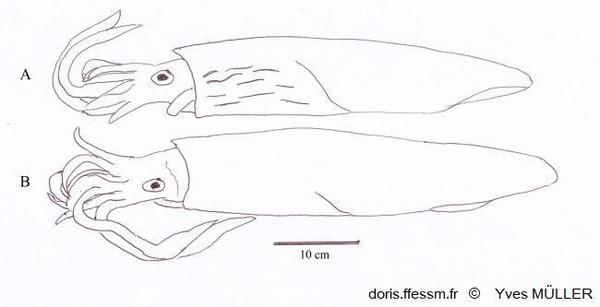
Comparaison de Loligo vulgaris et de Loligo forbesii
Apparence externe de deux grands mâles de :
A – Loligo forbesii montrant sur l’avant et le côté du manteau les marques (flammes) colorées et nombreuses, présentes chez les deux sexes.
B – Loligo vulgaris chez lequel de telles marques peuvent être présentes, moins nombreuses et uniquement chez les mâles (comme sur la vidéo présentée sur la fiche de Loligo vulgaris).
Schéma effectué d’après une photographie de Andy Lucas in Jereb & al, 2015, page 140, fig. 12.4
14/01/2022
Rédacteur principal : Yves MÜLLER
Rédacteur : Michel PEAN
Vérificateur : Laure BONNAUD-PONTICELLI
Responsable régional : Yves MÜLLER
Bidder A.M.,1950, The Digestive Mechanism of the European Squids Loligo vulgaris, Loligo forbesii, alloteuthis media and Alloteuthis subulata, Journal of Cell Science, s3-91(13), 1–43.
Boletzky S. v.,1998, Cephalopod eggs and egg masses, Oceanography and Marine Biology Annual Review, 36, 341–371.
Boletzky S. v., 1987, On egg and capsule dimensions in Loligo forbesii (Mollusca: Cephalopoda) : A note, Vie et Milieu, 37(3/4), 187-192.
Chen C.S., Pierce G.J., Wang J., Robin J-P., Poulard J.C., Pereira J., Zuur A.F., Boyle P.R., Bailey N., Beare D.J., Jereb P., Ragonese S., A. Mannini A., Orsi-Relini L., 2006, The apparent disappearance of Loligo forbesii from the south of its range in the 1990s: trends in Loligo spp. abundance in the north-east Atlantic and possible environmental influences, Fisheries Research, 78(1), 44-54.
Guerra A., Rocha F.,1994, The life history of Loligo vulgaris and Loligo forbesii (Cephalopoda: Loliginidae) in Galician waters (NW Spain), Fisheries Research, 21(1–2), 43-69.
Hastie L.C., Pierce G.J., Wang J., Bruno I., Moreno A., Piatkowski U., Robin J.P., 2009, Cephalopods in the north-eastern Atlantic: species, biogeography, ecology, exploitation and conservation, Oceanography and marine biology : an annual review, 47, 111–190.
Holme N.A., 1974, The biology of Loligo forbesii Steenstrup (Mollusca: Cephalopoda) in the Plymouth area, Journal of the Marine Biology Association of the United Kingdom, 54, 481-503.
Jatta G., 1896, I Cefalopodi, MONOGRAPHIE N°23, ATLANTE DI 31 TAVOLE, FAUNA AUND FLORA DES GOLFES VON NEAPEL UNN DER ANGRENZENDEN MEERES-ABSCHNITTE HERAUGEGEBEN VON DER ZOOLOGISCHEN STATION ZU NEAPEL, 246p.
Jereb P., Allcock A.L., Lefkaditou E., Piatkowski U., Hastie L.C., Pierce G.J. 2015, Cephalopod biology and fisheries in Europe II, species accounts, ICES International Council for the Exploration of the Sea Cooperative Research Report N° 325, 376p.
Mangold-Wirz K., 1963, Biologie des Céphalopodes benthiques et nectoniques de la Mer Catalane, Vie et Milieu, Supplément 13, 285 p.
Mangold Wirz K., Boletzky S. von, 1987, CEPHALOPODES in Fischer W., Bauchot M-L., Schneider M., 1987, FICHES FAO D’IDENTIFICATION DES ESPECES POUR LES BESOINS DE LA PECHE (REVISION 1). MEDITERRANEE ET MER NOIRE, ZONE DE PECHE 37. VOLUME 1. VEGETAUX ET INVERTEBRES, CEE, FAO, Rome, 760p.
Naef A., 1921-1925, Cephalopoda part I, (vol.1), fascicle 1, Fauna and flora of the bay of Naples, Smithsonian Institution and the National Science Foundation, Washington, D.C. 304 p.
Pfeffer G., 1901-1911, IV DIE CEPHALOPODEN 2 BD. III DOLIOLIDEN, SALPEN, APPENDICULARIEN, ASCIDIENLARVEN, IV PTEROPODEN, CEPHALOPODEN, V GASTROPODEN, ACEPHALEN in Brandt K. A. H. & Apstein C. NORDISCHES PLANKTON, ZOOLOGISCHER TEIL, Lipsius & Tischer (1-4, 5-10,11-21, 23-29, 31-47, 1-8), 9-116, (1-36, 37-55).
Pham C.K, Carreira G.P., Porteiro F.M., Gonçalves J.M., Cardigos F., Martins H.R., 2009, First description of spawning in a deep water loliginid squid, Loligo forbesii (Cephalopoda: Myopsida), Journal of the Marine Biological Association of the United Kingdom, 89(1), 171–177.
Pierce G. J., Boyle P. R., Hastie L. C., Key L., 1994, The life history of Loligo forbesii (Cephalopoda: Loliginidae) in Scottish waters, Fisheries Research, 21, 17–41.
Pierce G.J., Hastie L.C., Boyle P.R., Santos B., 1994, Diets of squid Loligo forbesii and Loligo vulgaris in the north-east Atlantic, Fisheries Research, 21, 149-163.
Pierce G.J., Allcock L., Bruno I., Bustamante P., Gonzalez A., Guerra A., Jereb P., Lefkaditou E., Malham S., Moreno A., Pereira J., Pitakowski U., Rasero M., Sanchez P., Begona Santos M., Santurtun M., Seixas S., Sobrino I., Villanueva R., 2010, Cephalopod biology and fisheries in Europe, ICES Report N° 303, 175 pp.
Porteiro F.M., Martins H.R., Hanlon R.T., 1990, Some observations on the behaviour of adult squid, Loligo forbesii in captivity, Journal of the Marine Biological Association of the United Kingdom, 70, 459–472.
Porteiro F.M., Martins H.R., 1992, First finding of natural laid eggs from Loligo forbesii Steenstrup, 1856 (Mollusca: Cephalopoda) in the Azores, Arquipélago. Life Earth Sciences, 10,119-120.
Sweeney M.J., Roper C.F.E., Mangold K.M., Clarke M.R., Boletzky S. von., 1992, « Larval » and juvenile Cephalopods : a manual for their identification, Smithsonian Institution Press, 282p.
Tinbergen L., Verwey J., 1945, Zur Biologie von Loligo vulgaris, Archives Néerlandaises de Zoologie, 7(1-2), 213-286.
Valls M., Cabanellas-Reboredo M., Uranga I., Quetglas A., 2015, Feeding ecology of two squid species from the western Mediterranean, Marine Ecology progress series, 531, 207-219.
La page de Loligo forbesii dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.