Coquillage de petite taille (moins de 1 cm)
Coquille spiralée, globuleuse, aplatie latéralement
Profil triangulaire ou piriforme
Ouverture oblongue
Opercule corné
Couleurs jaune, rouge, brun, crème, à bandes bicolores
Présent dans les ceintures à Fucus serratus et Ascophyllum nodosum
Overseen periwinkle (GB), Flache Strandschnecke (D), Vlakke alikruik (NL)
On trouve également dans la littérature ces deux noms : Flat periwinkle (GB), Stumpfe Strandsnecke (D) mais ils sont également utilisés pour Littorina obtusata.
Turbo fabalis W. Turton, 1825
Litorina arctica var. retusa Møller, 1842
Littorina beanii MacGillivray, 1843
Littorina obtusata var. picta Menke, 1845
Litorina limata Lovén, 1846
Litorina vittata R. A. Philippi, 1848
Littorina obtusata var. compacta Jeffreys, 1865
Littorina bizonalis Récluz, 1869
Littorina fabula Kobelt, 1907
Littorina obtusata littoralis var. inversicolorreticulata Dautzenberg & H. Fischer, 1915
Littorina obtusata littoralis var. minima Dautzenberg & H. Fischer, 1915
Littorina obtusata littoralis var. pachychila Dautzenberg & H. Fischer, 1915
Littorina obtusata littoralis var. reticulata Dautzenberg & H. Fischer, 1915
Littorina obtusata littoralis var. ziczac Dautzenberg & H. Fischer, 1915
Littorina mariae Sacchi & Rastelli, 1966
Littorina mariae beeensis S. M. Smith, 1980
Littorina vadorum Sacchi, 1984
Mer du Nord, Manche, Atlantique Nord-Est
Zones DORIS : ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]Cette espèce est présente en mer du Nord, en Manche et en Atlantique Nord-Est de la Norvège au nord jusque sur les côtes de l’Algarve au sud du Portugal. On peut la rencontrer également en Islande et tout autour de la Grande-Bretagne.
Littorina fabalis vit sur les côtes rocheuses à dynamiques variées. Elle est inféodée aux ceintures fucales de Fucus serratus, en moins grand nombre d’Ascophyllum nodosum et parfois, en faible représentation, en bas de la ceinture de Fucus vesiculosus. Elle est présente surtout dans la partie inférieure du médiolittoral* à savoir à partir et en-dessous de la mi-marée.
La forme générale de la coquille de ce gastéropode modeste est spiralée, globuleuse et aplatie latéralement avec les angles arrondis. Son profil est triangulaire ou piriforme*. Sa hauteur varie entre 3 et 7 mm mais peut atteindre 12 mm exceptionnellement. L’apex* est aplati. La coquille est épaisse, sa surface lisse et son aspect mat. La spire est le plus souvent lisse mais peut présenter parfois de très fines stries concentriques et parallèles. La lèvre extérieure ou labre* rejoint distinctement le haut du corps. Son ouverture est oblongue et plus grande que le dernier tour de la coquille ; elle est fermée par un opercule* corné.
On note la grande variabilité de ses couleurs : jaune (prédominant), rouge, brun, crème ; plus rarement bicolore jaune/brun ou rouge/noir en bandes alternées voire avec des motifs en damiers.
L’animal est de couleur jaunâtre généralement uniforme et semblable à celle de la coquille. Sa tête se termine par un mufle muni d’un tentacule* céphalique* de chaque côté, effilé et plat avec deux lignes longitudinales. Ce mufle est parfois de couleur plus foncée ou décorée d’un fin motif de lignes dentelées. Chaque tentacule porte un œil noir à sa base.Littorina fabalis ressemble assez fortement à Littorina obtusata. Ce n’est qu’en 1966 que l’on a vraiment fait la différence entre les deux espèces. Quatre critères efficaces permettent de distinguer ces deux espèces sur le terrain :
Littorina saxatilis : son apex est pointu, sa surface munie de côtes et sillons réguliers. En général elle est plus grande (10 à 14 mm) et sa couleur moins variable et plus terne que L. fabalis. Elle vit également plus haut sur l’estran à partir de la ceinture à pelvéties Pelvetia canaliculata.
Lacuna pallidula a une spire* basse semblable et une ponte très similaire, Elle est présente avec L. fabalis sur Fucus serratus. Elle a cependant une coquille beaucoup plus fine avec un ombilic* largement ouvert, contrastant avec la columelle* épaisse de L. fabalis. Elle possède également un périostracum* brun absent chez L. fabalis.
Comme toutes les littorines intercotidales*, Littorina fabalis est un gastéropode brouteur herbivore, qui se nourrit surtout d’algues vertes encore peu développées, en épiphytes* sur Fucus serratus et Ascophyllum nodosum. Elle consomme également des diatomées* et des fragments de fucus et d’ascophylle sur lesquels elle évolue et qu’elle arrache et broie à l’aide de sa radula* avant ingestion.
Littorina fabalis est une espèce gonochorique*. Les sexes sont séparés et le dimorphisme* sexuel entre les mâles (plus petits) et les femelles est tel que l’on pourrait séparer les deux sexes sans recourir à l’analyse statistique. Les mâles, aussi bien chez L. fabalis que chez L. obtusata, semblent préférer des femelles plus grandes. La fécondation est interne. Le mâle utilise un « pénis » pour féconder la femelle qui possède, dans sa poche incubatrice, plusieurs centaines d’œufs qu’elle dépose sous forme d’une capsule translucide sur un substrat favorable (thalles de Fucus serratus principalement).
Dans une publication en 2014, Hitchen Bergström a montré que Littorina obtusata ne pond pas du tout sur Ascophyllum nodosum mais seulement sur le stipe* et le crampon* de Fucus vesiculosus. Alors que Littorina fabalis pond sur les deux espèces d'algues. L’ensemble de la ponte n’est jamais rond dans son contour, plutôt ovale et souvent en forme de rein ou plus irrégulier. Ses œufs sont un peu plus petits (195-200 µm) que ceux de Littorina obtusata (210-255 µm).
Après la métamorphose*, au cours de laquelle se réalise la transformation de la forme larvaire* à la forme benthique*, les jeunes littorines éclosent en tous points identiques aux adultes. Il n’y a donc pas de phase larvaire planctonique* comme chez la plupart des mollusques.
La maturité sexuelle de Littorina fabalis est plus rapide (quelques semaines) par rapport à Littorina obtusata (un an environ). La durée de vie est également plus courte, environ un an chez L. fabalis au lieu de deux chez L. obtusata.
Cette adaptation reproductive est caractéristique d’assez nombreuses espèces inféodées à la zone de balancement des marées et permet, suppose-t-on, d’optimiser le succès reproducteur dans le milieu particulier (alternance de submersions et d’exondations) de la marée.Littorina fabalis est systématiquement observée sur les frondes d'algues, essentiellement des algues brunes comme Fucus serratus et Ascophyllum nodosum.
On a recensé jusqu’à 12 espèces d’épibiontes* sur Littorina fabalis et L. obtusata : hydrozoaires, bryozoaires, annélides polychètes (Janua heterostropha), crustacés cirripèdes (Austrominius modestus) ou ascidies (Botryllus schlosseri).
Comme d’autres littorines, L. fabalis peut être l’hôte intermédiaire de parasites Digènes, petits vers plats de l’embranchement des Plathelminthes.
L. fabalis est consommée par des oiseaux, des poissons (plus particulièrement des blennies), des crabes et d’autres gastéropodes telle Nucella lapillus.
Comme la plupart des Littorinidés qui sont sujets à subir de longues émersions, Littorina fabalis montre une importante vascularisation de sa cavité palléale.
Il n’est pas rare de rencontrer sur l’étage médiolittoral* des milliers d’individus morts de Littorina fabalis mêlés à ceux de L. obtusata (ex. archipel de Chausey).
Littorina fabalis et Littorina obtusata divergent d’un ancêtre commun pour former deux espèces sous l’influence de deux facteurs (mais il y en a peut-être d’autres !) que sont la prédation principalement et la résistance à l’exondation*. Ces deux facteurs sont majeurs dans la zone de balancement des marées. Cette divergence permettrait à Littorina fabalis et Littorina obtusata d’être mieux adaptées à deux prédateurs faisant pression dans des biotopes différents plus ou moins soumis à la marée (crabe vert en haut et blennie-mordocet en bas).
Des individus hybrides ont été observés car les habitats des deux espèces peuvent se recouvrir.
Les individus vivant dans des zones modérément exposées présentent une coquille plus grande avec une ouverture plus large que ceux des habitats abrités.
Littorine : en rapport avec le littoral, francisation du nom de genre Littorina.
fève : fait référence à sa forme ressemblant à une fève.
Littorina : du latin [litoralis] et [litus] = qui est en rapport avec le rivage ou le littoral.
fabalis : origine latine dont la racine [faba] désigne une fève (légume). La forme ovale et aplatie, à la peau épaisse de cette graine peut faire penser à notre littorine.
Numéro d'entrée WoRMS : 140261
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Mollusca | Mollusques | Organismes non segmentés à symétrie bilatérale possédant un pied musculeux, une radula, un manteau sécrétant des formations calcaires (spicules, plaques, coquille) et délimitant une cavité ouverte sur l’extérieur contenant les branchies. |
| Classe | Gastropoda | Gastéropodes | Mollusques à tête bien distincte, le plus souvent pourvus d’une coquille dorsale d’une seule pièce, torsadée. La tête porte une ou deux paires de tentacules dorsaux et deux yeux situés à la base, ou à l’extrémité des tentacules. |
| Sous-classe | Caenogastropoda | Caenogastropodes | |
| Ordre | Littorinimorpha | Littorinimorphes | |
| Famille | Littorinidae | Littorinidés | Coquille solide, épaisse, plus ou moins arrondie ou à spire haute, à surface lisse ou sculptée suivant les deux axes. ouverture ovale, entière. Opercule corné. Lindner 2011:70. |
| Sous-famille | Littorininae | Littorininés | |
| Genre | Littorina | ||
| Espèce | fabalis |
 Gastéropodes à coquille unique : escargots subaquatiques et assimilés (ex. Prosobranches et Hétérobranches/Pulmonés)
Gastéropodes à coquille unique : escargots subaquatiques et assimilés (ex. Prosobranches et Hétérobranches/Pulmonés)

Coquille globuleuse
La forme générale de la coquille de ce gastéropode modeste est spiralée, globuleuse et aplatie latéralement avec les angles arrondis.
Riche-Roche, Grande Ile, archipel de Chausey (50), estran
09/09/2024
 Gastéropodes à coquille unique : escargots subaquatiques et assimilés (ex. Prosobranches et Hétérobranches/Pulmonés)
Gastéropodes à coquille unique : escargots subaquatiques et assimilés (ex. Prosobranches et Hétérobranches/Pulmonés)

Couleur jaune
Bien que de couleurs très variables, la coquille de Littorina fabalis est le plus souvent jaune.
Riche Roche, Grande Ile, archipel de Chausey (50), estran
09/09/2024


Sur Fucus serratus
La littorine-fève est inféodée à la ceinture fucale de Fucus serratus.
Riche Roche, Grande Ile, archipel de Chausey (50), estran
09/09/2024


Opercule corné
L’ouverture, oblongue, est fermée par un opercule corné.
Perros-Guirec (22), estran
26/03/2024


Pénis
Le pénis, fin et digitiforme, est long chez Littorina fabalis.
Perros-Guirec (22), estran
26/03/2024
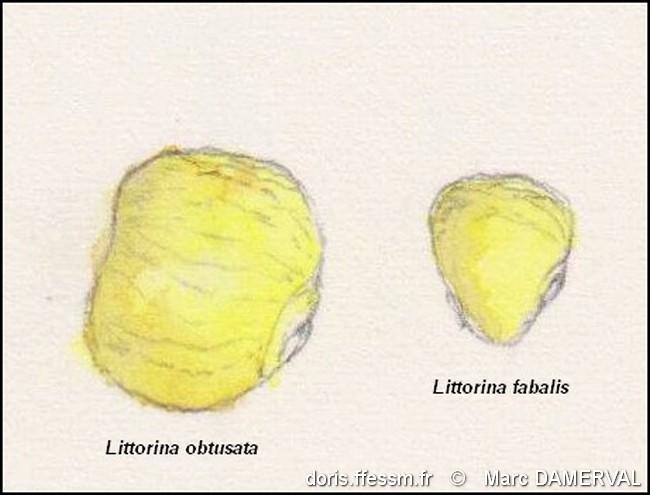

Comparaison de taille
Dessin naturaliste, d’après des échantillons, montrant la différence de taille et de forme entre les deux espèces.
Archipel de Chausey (50), estran
05/11/2024

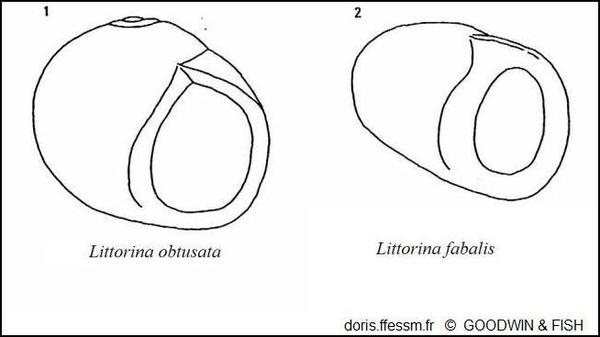
Comparaison côté ouverture
La forme de la coquille est plus aplatie chez Littorina fabalis que pour Littorina obtusata, plus uniformément globulaire.
Fig. 7 dans l'ouvrage " Inter- and intraspecific variation in Littorina obtusata and L. mariae (Gastropoda, Prosobranchia)" par B. J. Goodwin & J.D. Fish.
Reproduction de documents anciens
1977
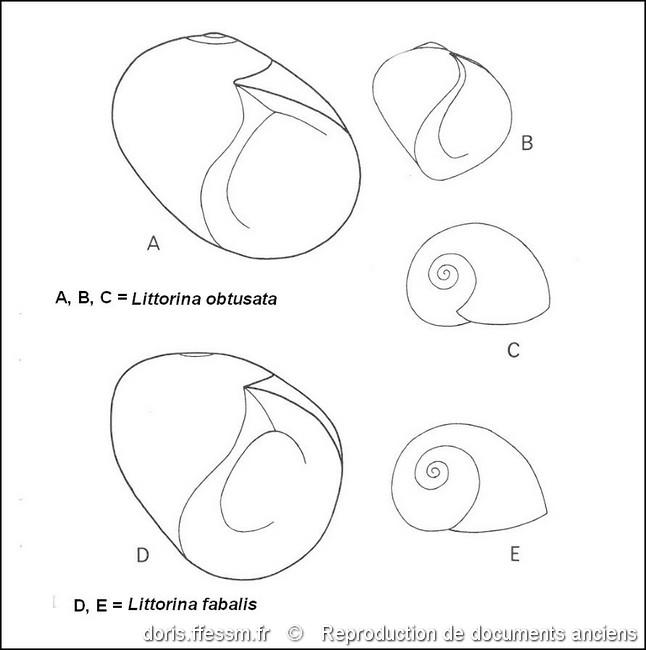
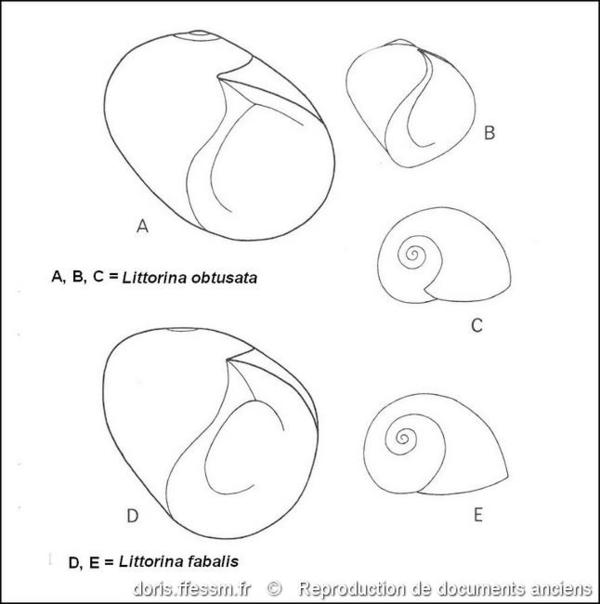
Comparaison des coquilles
A et D : ouverture de la coquille chez des individus adultes. B : ouverture de la coquille d’un juvénile. C et E : vue dorsale de coquilles juvéniles.
Fig. 203 dans « Marine Littorinacea part 5 in the prosobranch molluscs of Britain and Denmark, Part 5-Marine littoracea » de V. Fretter et A. Graham.
Reproduction de documents anciens
1980
Rédacteur principal : Marc DAMERVAL
Rédacteur : Philippe LE GRANCHÉ
Correcteur : Yves MÜLLER
Responsable régional : Philippe LE GRANCHÉ
Carvalho J., Sotelo G., Galindo J., Faria R. 2016, Genetic characterization of flat periwinkles (Littorinidae) from the Iberian Peninsula reveals interspecific hybridization and different degrees of differentiation, Biological Journal of the Linnean Society, 118, 503-519.
Costa D., Sotelo G., Kaliontzopoulou A., Carvalho J., Butlin R., Hollander J., Faria R.,2020, Hybridization patterns between two marine snails, Littorina fabalis and L. obtusata, Ecology and Evolution, Wiley and British Ecological Society, 10, 1158-1179.
Fretter V., Graham A., 1980, The prosobranch molluscs of Britain and Denmark, Part 5 - Marine Littorinacea, The Journal of Molluscan Studies, Malacological Society of London, 7, 243-284.
Galindo J., Carvalho J., Sotelo G., Duvetorp M., Costa D., Kemppainen P., Panova M., Kaliotzopoulou A., Johannesson K., Faria R., 2020, Genetic and morphological divergence between Littorina fabalis ecotypes in Northern Europe, Journal of Evolutionary Biology, UK, 34, 97-113.
Gefaell J., Galindo J., Malvido C., Nunez V., Estévez D., Blanco S., Gonzalez-Conde M., Martinez-Dominguez S., Novo I., Pérez-Fernandez G., Rus A., Mosconi I., Rolan-Alvarez E., 2021, Negative assortative mating and maintenance of shell colour polymorphism in Littorina (Neritrema) species, Marine Biology, 168, 151, 1-9.
Gefaell J., Vigo R., Galindo J., Rolan-Alvarez E.,2023, Experimental evidence of mate choice as the driving mechanism behind negative assortative mating for shell colour in a marine snail, Biological journal of the Linnean Society, 142, 4, 441-451.
Goodwin B.J, Fish J.D., 1977, Inter- and intraspecific variation in Littorina obtusata and L. mariae (Gastropoda, Prosobranchia), The Journal of Molluscan Studies, Malacological Society of London, 43, 241-254.
Hitchens-Bergström M., 2014, Egg laying preferences of two Littorina species on co-occuring Fucus and Ascophyllum thalli, Stockholms Universitet, 1-23.
Marques J.P., Sotelo G., Galindo J., Chaube P., Costa D., Afonso S., Panova M., Nowick K., Butlin R., Hollander J., Faria R., 2020, Transcriptomic resources for evolutionary studies in flat periwinkles and related species, Scientific Data, 7,73, 1-11.
Reid D. G., 1989, The comparative morphology, phylogeny and evolution of the gastropod family Littorinidae, Philosophical Transactions of the Royal Society B, London, 324, 1-110.
Reid D. G., 1996, The Systematics and Evolution of Littorina, ed. The Ray Society, GB, 164, 1-463.
Reimchen T.E., 1981, Shell size divergence in Littorina mariaeand L. obtusataand predation by crabs, Canada Journal of Zoology, 60, 687-695.
Sacchi C. F., 19701, Les épibiontes animaux de Littorina obtusata (L.) et de L. mariae Sacchi et Rast. (Gastropoda, Prosobranchia), Cahiers de Biologie Marine, 11, 43-56.
Sacchi C. F., Rastelli M., 1966, Littorina mariae nov. sp. les différences morphologiques et écologiques entre "nains" et "normaux" chez l'espèce L. obtusata (L.) (Gastr., Prosobr.) et leur signification adaptive et évolutive, Atti della Società Italiana de Scienze naturale e del Museo Civico di Storia naturale di Milano, 105, 351-369.
Sacchi C.F., Sconfetti R., 1992, Recherches sur l'écologie comparée de Littorina obtusata (L.) et de Littorina mariae Sacchi & Rast. dans la Ria de Arosa, Espagne nord-occidentale, IV. Dimorphisme sexuel et gradients de taille en Littorina mariae (Gastr. Prosobranchia), Atti della Societa Italiana di Scienze Naturali e del Museo Civico di Storia Naturale di Milano, 132, 9, 105-118.
Smith D.A.S., 1976, Disruptive selection and morph-ratio clines in the polymorphic snail Littorina obtusata (L.) (Gastropoda: Prosobranchia), Journal of Molluscan Studies, 42, 1, 114-135.
Smith I. F., 2017, Differentiating Littorina obtusata sensu stricto (Linnaeus, 1758) from Littorina fabalis (Turton, 1825), Mollusc World, 44, 3-17.
Sotelo G., Duvetorp M., Costa D., Panova M., Johannesson K., Faria R., 2023, Phylogeographic history of flat periwinkles, Littorina fabalis and L. obtusata, BMC Evolutionary Biology, 20, 23 1-18.
Watson D. C., Norton T. A., 1987, The habitat and feeding preferences of Littorina obtusata (L.) and L. mariae Sacchi & Rastelli, Journal of Experimental Marine Biology and Ecology, 112, 1, 61-72.
Williams G.A., 1990, The comparative ecology of the flat periwinkles, Littorina obtusata (L.) and L. mariae Sacchi et Rastelli, Field Studies Council, UK, 7, 469-482.
La page de Littorina fabalis sur le site de référence de DORIS pour les mollusques : MolluscaBase
La page de Littorina fabalis dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.