Petit crustacé (3 à 4 mm de longueur) à l’allure de cloporte
Première paire d’antennes courte et seconde paire de longueur normale, plus courtes que le corps
Yeux larges et disposés latéralement
Uropodes courts, dépassant à peine du pléotelson, et terminaux
Dans la zone de balancement des marées
A la loupe binoculaire ou au microscope : le pléotelson possède une encoche d’où semblent partir les uropodes
Jaera à front blanc
Witkoppissebed (NL)
Jaera marina (Fabricius, 1780)
Atlantique Nord-Est, Manche et mer du Nord (côtes françaises), Atlantique Nord-Ouest
Zones DORIS : ● Europe (côtes françaises), ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ● Atlantique Nord-OuestCe complexe d’espèces est présent dans l’Atlantique Nord-Est (depuis le Portugal jusqu’au Groenland) ainsi qu’en Manche et mer du Nord.et dans l’Atlantique Nord-Ouest (Golfe et estuaire St Laurent, Nouvelle-Écosse, Sud de Terre Neuve - Au Québec fjord du Saguenay).
Il est absent de Méditerranée.
Ce complexe d’espèces proches est exclusivement intertidal*. Il est principalement rencontré sous les blocs rocheux ou parmi les algues. Ces espèces peuvent supporter des variations de salinité importante et peuvent donc être rencontrées en milieu saumâtre, comme en milieu purement marin.
Ce petit isopode a une allure de cloporte, de couleur brune. Les segments sont bordés de nombreuses petites épines.
La première paire d'antennes* est courte, avec un flagelle* réduit. La seconde paire d'antennes est de longueur normale et est plus courte que le corps.
Les yeux sont larges et positionnés plus latéralement chez les mâles que chez les femelles.
Les uropodes* sont courts, terminaux et ne dépassent que légèrement du pléotelson*. Ce dernier possède une encoche d’où semblent partir les uropodes.
Les femelles en capacité de se reproduire possèdent 5 paires d’oostégites* qui forment la poche marsupiale* dans laquelle se développeront les œufs.
Chez les femelles, la première paire de pléopodes* est absente. La deuxième paire est modifiée en opercules semi-circulaires protégeant les autres pléopodes.
Chez les mâles, les appendices du premier segment abdominal (pléopodes 1)
fusionnent en une structure unique, large, plate et légèrement
convexe en forme de T, nommée préopercule*. Ce qui constitue le principal critère d’identification des représentants du groupe Jaera (Jaera) albifrons.
Les femelles peuvent atteindre 5 mm de longueur tandis que les mâles ne dépassent pas 3 mm. Le corps est plus ovoïde chez les femelles que chez les mâles, le corps étant, chez ces derniers, plus large à l’arrière qu’à l’avant. En été, période de reproduction, les femelles arborent généralement au centre du corps, une couleur verte qui correspond aux œufs vus par transparence.
Jaera (Jaera) albifrons regroupe en réalité cinq espèces appartenant au groupe « albifrons » :
Seuls les mâles de ces espèces peuvent être séparés visuellement, les femelles ne présentant aucun caractère distinctif. Des travaux récents (Vadim M. Khaitov & al., 2006) ont cependant démontré qu’il serait possible de déterminer les femelles jusqu’au niveau spécifique à partir de certains ratios morphologiques, ces ratios devant cependant être adaptés aux populations étudiées.
La séparation certaine entre Jaera (Jaera) albifrons et Jaera (Jaera) nordmanni ne sera possible que sur les mâles, mais les personnes ayant déjà vu les deux super-espèces peuvent arriver à les différencier à la forme globale, Jaera (Jaera) nordmanni étant plus large que Jaera (Jaera) albifrons, même chez les femelles. Les épines présentes sur le bord du corps sont par ailleurs plus nombreuses chez Jaera (Jaera) nordmanni. Enfin, les yeux de Jaera (Jaera) albifrons sont implantés plus près du bord du corps.
A noter enfin que le genre Jaera comporte, sur le territoire national, deux autres espèces :
Les Jéras sont des détritivores* et se nourrissent de débris végétaux et, très certainement, du biofilm produit à la surface des roches sous lesquels ils se cachent en journée. A ce titre, il est intéressant de noter que les mandibules* de Jaera (Jaera) praehirsuta, espèce que l’on trouve dans les Fucus comme indiqué plus haut, et non sous les roches, sont totalement similaires à celles des autres espèces du groupe albifrons. On en déduit donc que son mode de nutrition est le même, ce qui suggère que cette espèce se nourrit en réalité du biofilm se développant sur les Fucus, et non de l’algue elle-même. En captivité, en absence d’autre nourriture, ils peuvent ingérer d’autres Jéras morts ou des mues.
Rarement la reproduction d’une espèce aussi petite que Jaera (Jaera) albifrons n’aura suscité autant d’intérêt scientifique… Cet intérêt est lié à l’étroite proximité entre les espèces du complexe* albifrons. Si les individus préfèrent s’accoupler avec un individu de la même espèce, les fécondations entre espèces sont possibles et donnent naissance à des hybrides qui sont eux-mêmes féconds, bien que leurs performances de reproduction soient plus faibles que celles des descendants non hybrides (il existerait un facteur 4 dans le taux de fécondité des hybrides par rapport aux espèces non hybrides). Le taux de réussite de ces croisements interspécifiques dépend des espèces concernées et, chose plus complexe, des populations étudiées.
L’accouplement a lieu sur initiative du mâle, qui se positionne tête-bêche sur la femelle. Il la stimule alors en exerçant une certaine pression et un brossage sur des zones précises de la femelle. La nature de cette stimulation est étroitement liée à l’espèce concernée, notamment en raison des caractères sexuels secondaires spécifiques des mâles (pilosité des péréiopodes*), et elle contribue pour une très large part à la séparation des espèces. Les femelles qui ne sont pas réceptives le font rapidement savoir par des coups de pléotelson* ou par une évasion. Si les femelles préfèrent de façon générale et très majoritaire les mâles de leur espèce, des études ont montré que les mâles de Jaera (jaera) albifrons au sens strict étaient davantage acceptés par les femelles des autres espèces que les mâles des autres espèces. Inversement, les femelles de Jaera (Jaera) albifrons ne semblent accepter que les mâles de leur espèce. Les mâles ont une légère préférence pour les femelles de leur propre espèce (cette préférence s’observe en laboratoire par le fait que les femelles sont davantage courtisées par des mâles de leur espèce que par des mâles d’autres espèces). Cette préférence n’est pas assez marquée pour qu’elle puisse contribuer significativement à la spéciation*.
Contrairement à la phase pré-copulatoire, étroitement liée à l’espèce considérée comme indiqué précédemment, la phase copulatoire ne varie pas d’une espèce à l’autre. De manière assez surprenante, l’accouplement est dorsal, le mâle (toujours tête-bêche) introduisant ses organes copulateurs (fouet copulateur des pléopodes* 2, guidé par la « corne » du pléopode* 1) dans des structures présentes sur le dos de la femelle (organes cuticulaires*), menant à un réceptacle séminal. La femelle peut ainsi conserver pendant plusieurs mois le sperme de son partenaire et avoir ainsi plusieurs portées à partir d’un seul accouplement.
Les œufs sont incubés dans une poche marsupiale*. Les larves* issues de ces œufs restent dans la poche marsupiale. Elles sont libérées alors qu’elles font environ 0,5 mm de longueur et ressemblent déjà à la forme adulte. Il n’y a donc pas de larve planctonique* (la reproduction est directe). Les portées sont en moyenne d’une quinzaine d’individus, ce nombre augmentant avec la taille de la mère. La femelle peut avoir une portée tous les 20 jours lorsque les conditions sont favorables, le délai entre deux portées dépendant de la température. Les femelles peuvent libérer des jeunes tout au long de l’année, mais il existe un pic de reproduction au printemps et en été (sauf pour Jaera (Jaera) forsmani, qui ne semble avoir qu’un pic de reproduction au printemps).
Chez les individus non hybrides, le délai entre la libération des juvéniles et l’atteinte de la phase adulte (caractères sexuels secondaires bien visibles) est d’environ 4 semaines. Ce délai est environ deux fois plus long chez les individus hybrides.
Bien que le sex-ratio à la naissance soit équilibré, les populations rencontrées dans la nature présentent un sex-ratio très déséquilibré, en faveur des femelles. Chez Jaera (Jaera) albifrons, le sex-ratio observé varie entre 0,1 et 0,25 selon les études. Chez Jaera (Jaera) ischiosetosa, le sex-ratio à la naissance est déjà déséquilibré (de l’ordre de 0,3), et se dégrade encore dans les populations naturelles, où il est plutôt de 0,25. L’évolution de ces sex-ratios pourrait être liée au fait que les mâles semblent régulièrement mourir après la copulation. Plusieurs études ont cherché, sans succès, à mettre en évidence des causes bactériennes dans cette évolution et les causes exactes du déséquilibre des sex-ratios chez les populations naturelles restent donc à élucider. Le fort déséquilibre des sex-ratios mentionnés dans la littérature pourrait également trouver une partie de son origine dans la plus grande difficulté à repérer les individus mâles dans le milieu naturel compte tenu de leur taille plus petite et de leur couleur adaptée au milieu.
Les chromosomes sexuels des femelles sont trivalents (du type XY1Y2), tandis que les chromosomes sexuels des mâles se présentent sous la forme classique XX. L’analyse chromosomique de plusieurs populations montre que ces espèces connaissent de très nombreux réarrangements chromosomiques, sans que ceci nuise à leur reproduction.
Les espèces du complexe* Jaera (Jaera) albifrons sont eurythermes* et peuvent être rencontrées, sur certains rivages, dans des mares littorales.
Les facteurs de spéciation* identifiés sont à la fois d’ordre éthologique (comportement reproducteur évoqué plus haut) et écologique (chaque espèce a un préférendum spécifique sur l’estran*, les zones d’habitat préférentiel pouvant cependant largement se chevaucher sur certains littoraux, notamment lorsque les algues sont rares). On peut ainsi hiérarchiser les facteurs de spéciation : le premier est géographique (les espèces vivent, lorsque cela est possible, dans des zones séparées sur l’estran). Lorsque ce facteur est limité (lorsque plusieurs espèces fréquentent les mêmes zones), les comportements reproducteurs entrent alors en jeu et favorisent l’accouplement au sein d’une même espèce. Enfin, si ce deuxième facteur de spéciation a échoué, le taux de fécondité plus faible des hybrides, qui se maintiendra ensuite quelle que soit l’espèce avec laquelle l’hybride s’accouplera, conduira à un isolement de plus en plus marqué des différentes espèces.
Dans la nature, le taux d’hybrides rencontrés varie entre 0 % (populations pures) et 1 %. Il existe cependant des populations hybrides importantes (entre Jaera (Jaera) albifrons et Jaera (Jaera) praehirsuta) sur les côtes de Normandie et dans certains autres lieux particuliers (îles Scilly notamment). La connaissance de ces populations reste à affiner car, partout ailleurs, le taux de survie des hybrides en milieu naturel est corrélé au taux de partage des gènes des deux parents. Par ailleurs, compte tenu de la faible représentation des hybrides en milieu naturel, leur reproduction conduit de manière quasi-systématique à un croisement qui réduit le taux d’hybridation (croisement avec un individu génétiquement non hybride).
Des études en laboratoire ont montré que le fait que ces animaux soient trouvés sous les pierres en plein jour est lié à leur comportement lucifuge (qui fuit la lumière).
La durée de vie de ces espèces est généralement d’une année, les femelles semblant vivre plus longtemps que les mâles. Elles peuvent ainsi survivre en hiver et se reproduire une dernière fois au printemps (pour cette raison les femelles gravides* rencontrées au printemps sont plus grosses que les femelles gravides rencontrées en automne). On rencontre le maximum d’individus sous les pierres durant l’été.
Des études en laboratoire ont mis en évidence le fait que les capacités d’osmorégulation (régulation des concentrations en sels dissous dans les liquides de l'organisme) de Jaera (Jaera) albifrons sensu lato. dépendaient de la température. Ces capacités sont maximales vers 5 °C, ce qui confirme que ces espèces sont d’affinité septentrionale.
La chambre respiratoire est positionnée dans la cavité du pléotelson*, la circulation de l’eau étant assurée par le mouvement des pléopodes* respiratoires. Cette chambre est protégée par les pléopodes* 1 et 2 chez les mâles (ces pléopodes constituent les organes copulateurs ; hors reproduction, les pléopodes 1 et 2 restent associés) et par les pléopodes 2 chez les femelles.
Des études portant sur l’analyse génétique des populations de Jaera (Jaera) albifrons au sens large au Pays de Galles ont montré qu’il existait une grande variabilité génétique au sein d’une même espèce, ceci étant probablement dû à la faible dispersion des individus adultes combinée à un développement direct (l’agitation de l’eau, qui accroît cette mobilité, a ainsi tendance à homogénéiser le matériel génétique). Le même type d’étude conduite au Danemark a de son côté trouvé une plus grande homogénéité chez toutes les espèces, ceci pouvant être expliqué par la plus faible amplitude des marées sur les côtes danoises. Parmi les espèces du complexe albifrons, Jaera (Jaera) forsmani est celle qui présente la plus grande homogénéité génétique, probablement parce qu’elle vit plus bas sur l’estran*.
Jéra à front blanc : simple traduction du nom scientifique. Il a été utilisé en 1888 par le zoologiste français Paul Groult.
Un complexe d'espèces est un groupe d'espèces très proches, difficiles à distinguer les unes des autres.
Le zoologiste britannique William Elford Leach (1790-1836) a retenu le nom d’espèce albifrons du latin [alba] = blanc et du latin [frons] = front, en référence à la tête claire que peut présenter cette espèce (cette coloration étant loin d’être systématique…).
Leach n’a pas expliqué l’origine du nom du genre Jaera lors de sa description en 1814. Dans la Bible, Jaera descend de Saül ou de Achaz. En hébreu ce mot signifie rayon de miel ou forêt. Leach a créé un grand nombre de nom de genres. Il s'est inspiré de nombreuses mythologies et cultures sans explication.
Le nom de sous-genre est présenté entre parenthèses entre le nom de genre et le nom d'espèce.
Numéro d'entrée WoRMS : 264171
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Arthropoda | Arthropodes | Animaux invertébrés au corps segmenté, articulé, pourvu d’appendices articulés, et couvert d’une cuticule rigide constituant leur exosquelette. |
| Sous-embranchement | Crustacea | Crustacés | Arthropodes à exosquelette chitineux, souvent imprégné de carbonate de calcium, ayant deux paires d'antennes. |
| Super classe | Multicrustacea | ||
| Classe | Malacostraca | Malacostracés | 8 segments thoraciques, 6 segments abdominaux. Appendices présents sur le thorax et l’abdomen. |
| Sous-classe | Eumalacostraca | Eumalacostracés | Présence d’une carapace recouvrant la tête et tout ou partie du thorax. |
| Super ordre | Peracarida | Péracarides | Les femelles sont dotées d'une cavité d'incubation formée par des expansions lamelleuses des péréiopodes. |
| Ordre | Isopoda | Isopodes | Corps comprimé dorso-ventralement, première paire d’antennes beaucoup plus petite que la seconde, yeux non pédonculés. 7 paires de pattes de même apparence. |
| Sous-ordre | Asellota | Asellotes | |
| Famille | Janiridae | Janiridés | |
| Genre | Jaera (Jaera) | ||
| Espèce | albifrons |
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Jaera (Jaera) sp. groupe albifrons
Photo d'un individu capturé sur l'estran, sous un bloc rocheux.
Macrophotographie (rapport 1:1) d'un individu capturé sur l'estran, Pointe de la Rognouse, Binic (22)
04/09/2022
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Dans son biotope
Photo d'un individu dans son biotope, sous un bloc rocheux. Les épines qui bordent chaque segment sont ici bien visibles.
Macrophotographie (rapport 1:1), Pointe de la Rognouse, Binic (22)
01/08/2022
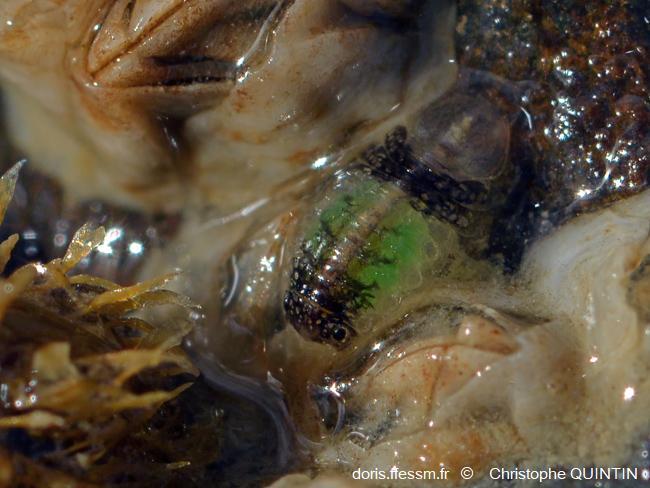
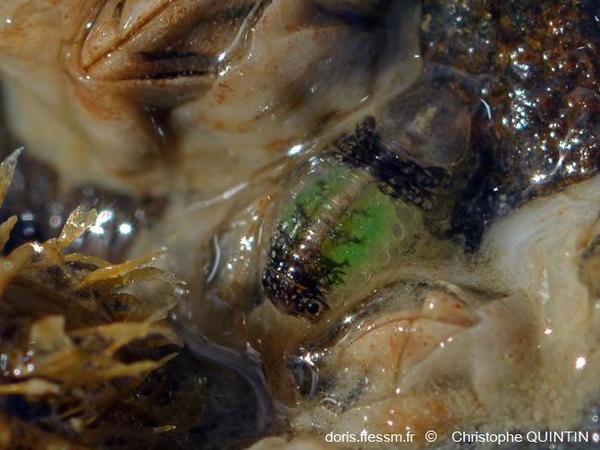
Œufs visibles par transparence
Les œufs de couleur verte sont ici bien visibles par transparence chez cette femelle. Celle-ci arbore une coloration très particulière, avec deux zones noires, mais qui n’est malheureusement pas propre à une espèce donnée et est donc inexploitable pour la détermination visuelle.
Sur l'estran, Macrophotographie (rapport 1:1), Pointe de la Rognouse, Binic (22)
01/10/2022


Vue de dessous
Chez les femelles, les pléopodes 2 sont transformés en une sorte de lame semi-circulaire recouvrant les autres pléopodes. La première paire de pléopodes est absente.
A noter que cette femelle ne semble pas présenter d’oostégites. Elle n’est donc pas apte à se reproduire dans sa phase présente (mais elle peut s’accoupler pour récupérer le sperme d’un partenaire qui sera ensuite utilisé lors de la mue suivante). Les oostégites pourront se développer lors de la prochaine mue. Cette alternance, d’une mue à l’autre, entre phase reproductive active et phase non reproductive est courante chez les femelles du groupe Jaera (Jaera) albifrons mais également chez d’autres isopodes.
Macrophotographie (rapport 1 :1) redimensionnée d’un individu capturé sur l’estran, Pointe de la Rognouse, Binic (22)
10/08/2022


Vue du pléotelson
Chez les Jaera (Jaera) albifrons, le pléotelson est légèrement entaillé pour laisser apparaître les uropodes, qui sont nettement terminaux.
Photographie au microscope (x40) d’un individu capturé sur l’estran, Pointe de la Rognouse, Binic (22)
04/09/2022


Vue des antennes
Les antennes de la première paire sont petites et celles de la seconde sont normalement développées, mais plus courtes que le corps.
Photographie au microscope (x40) d’un individu capturé sur l’estran, Pointe de la Rognouse, Binic (22)
04/09/2022
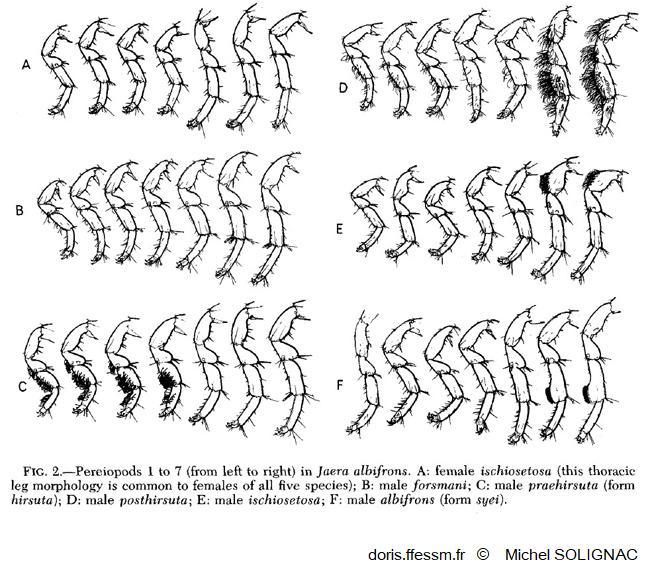
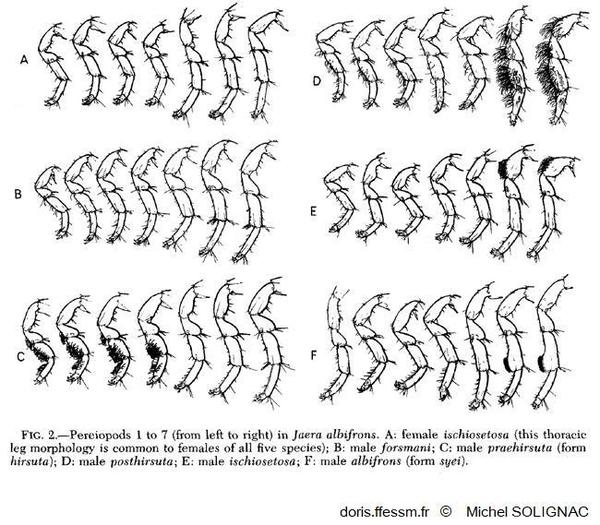
Comparaison des péréiopodes
Vue des spécificités morphologiques des péréiopodes des mâles des différentes espèces du groupe albifrons.
Illustration extraite de la publication de Michel Solignac (1981)
Reproduction de documents anciens
1981
Rédacteur principal : Christophe QUINTIN
Vérificateur : Pierre NOËL
Responsable régional : Yves MÜLLER
Bocquet C., 1971, Espèces nouvelles décrites de la région de Roscoff entre 1945 et 1970, Cahiers de Biologie Marine, 12, 381-404.
Carvalho G.R., Piertney S.B., 1997, Interspecific comparisons of genetic population structure in members of the Jaera albifrons species complex, Journal of the Marine Biological Association of U.K., 77, 77-93.
Forsman B., 1949, Weitere Studien über die Rassen von Jaera albifrons Leach, Zoologiska Bidrag fran Uppsala, 27, 449-463.
Groult P., 1888, ACARIENS, CRUSTACÉS, MYRIAPODES, in HISTOIRE NATURELLE DE LA FRANCE, Emile Deyrolle, 15e partie: i-viii, 1-249, pl. 1-18.
Gruner H.E., 1962, Jaera albifrons (Crustacea Isopoda) und ihre Unterarten an den deutschen Küsten, Abhandlungen und Verhandlungen des naturwissenschaftlichen Vereins in Hamburg, N.F. 6, 197-208.
Jones M.B., Naylor E., 1971, Breeding and bionomics of the British members of the Jaera albifrons group of species (Isopoda: Asellota), Journal of Zoology, 165, 183-199.
Jones M.B., 1972, Osmoregulation in the Jaera albifrons group of species [Isopoda, Aselotta], Journal of the Marine Biological Association of U.K., 52, 419-427.
Jones M.B., 1972, The mouthparts of the members of the Jaera albifrons group of species (Crustacea: Isopoda), Marine Biology, 14, 264-270.
Kesselyak A., 1938, Die Arten der Gattung Jaera Leach (Isopoda, Asellota), Zoologische Jahrbücher Abteilung für Systematik, Ökologie und Geographie der Tiere, 71, 219–251.
Khaitov V.M., Kuzmin A.A., Terovskaya E.V., 2007, Morphological differences between females of different Jaera species (Crustacea: Asellota: Isopoda) in the White Sea : a possible solution to an old problem, Marine Biology, 150, 1250-1214.
Leach W.E., 1815, Crustaceology, In: Brewster, D. (ed.), The Edinburgh Encyclopaedia. Balfour, Edinburgh, 7(1), 434.
Lécher P., Prunus G., 1971, Caryologie et taxinomie de Jaera (albifrons) albifrons (Crustacé, Isopode), populations des côtes bretonnes, Archives de Zoologie Expérimentale Génétique, 112, 715-730.
Lemercier A., 1960, La super-espèce Jaera nordmanni (Rathke) (Isopodes Aselottes, Janiridae), Crustaceana, 1(1), 9-27.
Naylor E., Slinn D.J., Spooner G.M., 1961, Observations on the British species of Jaera (Isopoda:Asellota), Journal of the Marine Biological Association of U.K., 41, 817-828.
Naylor E., Haahtela I., 1967, Quantitative ecological distribution of the Jaera albifrons group of species in the Baltic, Ophelia, 4, 19-27.
Piertney S.B., Carvalho G.R., 1995, Detection of high levels of genetic relatedness in rock-populations of an intertidal isopod using DNA fingerprinting, Journal of the Marine Biological Association of U.K., 75, 967-976.
Piertney S.B., Carvalho G.R., 1996, Sex ratio variation in the intertidal isopod Jaera albifrons, Journal of the Marine Biological Association of U.K., 76, 825-828.
Ribardière A., 2017, Isolement reproductif et architecture génomique de la différenciation chez deux espèces du complexe Jaera albifrons (isopodes marins), Thèse de doctorat de l’Université Pierre et Marie Curie, Ecole doctorale 227 UPMC-MNHN, 276p.
Ribardière A., Centanni J., Dano A., Coudret J., Daguin-Thiébaut C., Houbin C., Kerconduff E., Jambut S., Cordaux R., Broquet T., 2018, Female-biased sex ratios unrelated to Wolbachia infection in European species of the Jaera albifrons complex (marine isopods), Journal of Experimental Marine Biology and Ecology, 509, 91-98.
Ribardière A., Pabion E., Coudret J., Daguin-Thiébaut C., Houbin C., Loisel S., Henry S., Broquet T., 2019, Sexual isolation with and without ecological isolation in marine isopods Jaera albifrons and J. praehirsuta, Journal of Evolutionary Biology, 00, 1-16.
Siegismund H.R., 2002, Disparity in population differentiation of sex-linked and autosomal variation in sibling species of the Jaera albifrons (Isopoda) complex, The Journal of Heredity, 93(6), 432-439.
Sjöberg B., 1967, On the ecology of the Jaera albifrons group (Isopoda), Sarsia, 29, 321-348.
Sjöberg B., 1970, Population density, size, age, reproduction and microdistribution in the Jaera albifrons group (Isopoda), Oikos, 21, 241-247.
Solignac M., 1976, Demographic aspects of interspecific hybridization – A study of the Jaera albifrons species complex (Crustacea, Isopoda, Asellota), Oecologia, 26, 33-52.
Solignac M., 1981, Isolating mechanisms and modalities of speciation in the Jaera albifrons species complex (Crustacea, Isopoda), Systematic Zoology, 30(4), 387-405.
Veuille M., 1976, Biogeography of the Jaera albifrons superspecies (Isopoda. Asellota) on the Atlantic coast of Canada, Canadian Journal of Zoology, 54, 1235-1241.
Veuille M., 1978, Biologie de la reproduction chez Jaera (Isopode asellote) I – Structure et fonctionnement des pièces copulatrices mâles, Cahiers de biologie marine, XIX, 299-308.
Veuille M., 1978, Biologie de la reproduction chez Jaera (Isopode asellote) II – Evolution des organes reproducteurs femelles, Cahiers de biologie marine, XIX, 385-395.
Wenzel M.A., Douglas A., Piertney S.B., 2018, Microbiome composition within a sympatric species complex of intertidal isopods (Jaera albifrons), PLos ONE, 13(8), e0202212.
Film pédagogique illustrant le comportement sexuel différencié des 4 espèces composant le groupe Jaera albifrons : Canal U
La page de Jaera (Jaera) albifrons dans l'Inventaire National du Patrimoine Naturel : INPN
La page de Jaera (Jaera) forsmani dans l'Inventaire National du Patrimoine Naturel : INPN
La page de Jaera (Jaera) ischiosetosa dans l'Inventaire National du Patrimoine Naturel : INPN
La page de Jaera (Jaera) praehirsuta dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.