Taille de 1 à 3 cm, de couleur brune ou verte
Corps aplati latéralement et arqué ventralement
Tête avec 2 paires d'antennes de longueur similaire et 2 yeux réniformes
Antennes 1 comportant un flagelle accessoire, de longueur supérieure à l’article 1 de ces antennes
Dix paires d'appendices : 7 paires de péréiopodes thoraciques et 3 paires de pléopodes abdominaux
Touffes d'épines bien visibles sur la marge médiodorsale des segments de l'urosome
Les endopodes des uropodes 3 approximativement de même longueur que les exopodes
Gammare commun
Locust amphipod, common intertidal amphipod (GB), Gemeiner Flohkrebs, Flohkrebs (D), Zeeprinkhaan, sprinkhaanvlokreeft (NL), Almindelig tangkoppe (DK), Kielz morski (PL)
Cancer locusta Linnaeus, 1758
Atlantique Nord-Est, Manche/mer du Nord, Atlantique Nord-Ouest
Zones DORIS : ● Europe (côtes françaises), ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]L’espèce est présente sur les côtes de l’Atlantique Nord-Est, de la Manche et de la mer du Nord, depuis l’Espagne et les Açores jusqu’en Suède. Elle est absente en Méditerranée.
L’espèce a été introduite sur les côtes atlantiques de l’Amérique du Nord.
L’espèce se rencontre sur l’estran*, sous les pierres et dans les algues, entre la mi-marée et le niveau bas de l’estran, en milieu purement marin ou saumâtre.
Gammarus locusta est une espèce caractéristique de l’habitat EUNIS A5.5343 (Ruppia maritima dans du sable vaseux infralittoral* en milieu à salinité réduite).
Il existerait une forme de Gammarus locusta adaptée à l’eau douce, notamment rencontrée dans la Loire.
Ce petit crustacé est de couleur variable, verte à brune. Sa taille peut atteindre trois centimètres pour les mâles. Les femelles sont plus petites (2 cm au maximum). Le corps est comprimé latéralement et un peu arqué ventralement.
La tête porte deux paires d’antennes*, de longueur à peu près similaire, et une paire d'yeux non pédonculés réniformes. La paire d’antennes la plus haute (antennes 1) comporte un flagelle* accessoire, constitué de 8 à 15 articles. La longueur totale de ce flagelle accessoire dépasse la longueur de l’article 1 du pédoncule* de l’antenne 1 (critère important pour la détermination). Les articles du pédoncule des antennes 1 sont relativement peu pourvus de soies*, contrairement à ceux des antennes 2. Chez les mâles, les articles du flagelle des antennes 2 portent, à la base des soies et sur la partie proximale* du flagelle, des structures arrondies appelées calcéoles.
Le thorax porte sept paires de pattes (les péréiopodes*) :
- les deux premières paires sont préhensiles, ce sont les gnathopodes*,
- la troisième paire s'agite sans arrêt pour amener l'eau aux branchies situées sur la face ventrale du thorax,
- les trois dernières servent à la marche. La base de la 7e paire de péréiopodes est environ 1,5 fois plus longue que large.
Les 3 dernières paires sont de sens opposé aux 4 premières (d'où le nom d'Amphipodes).
L'abdomen porte 3 paires d'appendices (les pléopodes*) aplatis et garnis de soies. Ils servent à la nage et à la ventilation des œufs fécondés.
L’extrémité du corps, l’urosome*, est constituée de trois segments portant chacun une paire d’uropodes*, qui servent à sauter. L'urosome comporte des bosses dorsales prononcées et des petites épines bien visibles à la loupe binoculaire. Les uropodes sont biramés. Pour la dernière paire d’uropodes (uropodes 3), l’exopode (ou exopodite*) et l'endopode (ou endopodite*) ont approximativement la même longueur (autre critère important pour la détermination).
La dernière plaque épimérale (les plaques épimérales sont celles recouvrant l’abdomen) porte des petites soies sur son bord postérieur, assez difficiles à repérer mais utiles pour confirmer l’identification.
Tous les représentants de la famille des Gammaridés se ressemblent fortement au premier abord, et il est nécessaire d’être très attentif pour avancer dans la détermination, celle-ci n’étant généralement possible que sous loupe binoculaire.
Gammarus locusta appartient au groupe de Gammaridés dénommé « groupe locusta » qui comporte également les espèces suivantes : Gammarus inaequicauda (uniquement en zone scandinave), Gammarus insensibilis, Gammarus crinicornis, Gammarus subtypicus (cette dernière espèce est uniquement méditerranéenne).
Les espèces de ce groupe sont très proches morphologiquement de Gammarus locusta, en particulier Gammarus insensibilis avec lequel la confusion est très aisée. Pour cette dernière espèce, la distinction sera possible pour les mâles. Les antennes* 2 des mâles de Gammarus locusta possèdent des « calcéoles » (petites structures arrondies situées à la base des soies* sensorielles sur les antennes), ce qui n’est pas le cas chez les mâles de Gammarus insensibilis. Pour les femelles, un bon critère consistera à examiner la base du péréiopode* 7, plus court et plus arrondi chez Gammarus locusta. Les soies du bord postérieur de la plaque épimérale 3 sont propres à Gammarus locusta et constituent un bon critère de confirmation, à condition de pouvoir les voir (il faut varier l’angle d’éclairage).
Les Gammaridés sont des détritivores*, se nourrissant de débris animaux ou végétaux. La littérature propose plusieurs éléments divergents quant au régime alimentaire de cette espèce.
Ainsi, pour certains, Gammarus locusta aurait une préférence pour les débris d’algues vertes, comme Ulva spp. et Enteromorpha spp. Pour d’autres auteurs, Gammarus locusta se nourrirait d’algues épiphytes*.
Des cas de cannibalisme sur des jeunes individus par des adultes sont signalés, parfois de façon significative lorsque des adultes sont maintenus en aquarium avec des juvéniles.
Les sexes sont séparés et il existe un dimorphisme* sexuel, les mâles étant plus grands que les femelles (30 mm maximum contre 20 mm). Les gnathopodes* du mâle sont beaucoup plus imposants que ceux des femelles.
Chez le mâle, le propode (ou propodite*) du gnathopode 2 est plus gros que celui du gnathopode 1. De même, les deux paires d’antennes* sont plus longues et plus "poilues" chez les mâles que chez les femelles.
Les femelles matures disposent d’une poche marsupiale* constituée de quatre paires d’oostégites*, situées entre les paires de péréiopodes* 2 à 5. Ces oostégites sont dotées de longs poils (ou soies*) sur leurs bords, facilitant le maintien des œufs embryonnés et des larves* dans la poche marsupiale.
Le mâle repère la femelle prête à l’accouplement grâce aux phéromones* relâchées par cette dernière (il pourrait en fait s’agir d’une hormone impliquée dans la mue de la femelle, l’ecdysone). Il se positionne alors sur le dos de la femelle et reste dans cette position jusqu’à ce que la femelle mue*, en l’agrippant avec sa première paire de gnathopodes, l’un positionné au début du thorax et l’autre entre le cinquième et le sixième segment thoracique.
Peu après sa mue, la femelle pond ses œufs dans le marsupium. Le mâle change alors de position et vient se positionner ventralement pour déposer son sperme sur les œufs. La fécondation des œufs est donc externe. Le mâle libère ensuite la femelle.
Après l’éclosion, les larves* restent au sein du marsupium pendant quelques jours. Une femelle peut relâcher, selon sa taille, entre 30 et 130 juvéniles à chaque ponte.
La croissance des individus est relativement rapide puisque après avoir été relâchés, les individus immatures atteignent la taille de maturité sexuelle en 4 semaines. Deux générations peuvent ainsi se succéder en six semaines lorsque les conditions sont favorables, notamment en matière de température de l’eau. Douze mues sont nécessaires aux juvéniles pour atteindre la maturité sexuelle.
De nombreux parasites peuvent être présents dont le trématode Podocotyle atomon.
Un Plathelminthe trématode Microphallus papillorobustus parasite les ganglions cérébraux des gammares. Ces derniers, au lieu de vivre cachés, nagent en surface et se font consommer par les oiseaux comme les goélands. Le gammare est un hôte intermédiaire et l'oiseau un hôte définitif du parasite.
Cette espèce est également parasitée par le cestode Echinobothrium typus Van Beneden, 1849, les trématodes Levinseniella brachysoma (Creplin, 1837) Stiles & Hassall, 1902, Levinseniella propinqua Jägerskiöld, 1907, Maritrema subdolum Jägerskiöld, 1909, Microphallus claviformis (Brandes, 1889) Baer, 1944, Microphallus hoffmanni Rebecq, 1964, Microphallus primas (Jägerskiöld, 1908) Stunkard, 1951 et le nématode Streptocara crassicauda (Creplin, 1829) Skrjabin, 1916.
Des études récentes conduites en laboratoire ont montré que Gammarus locusta était particulièrement sensible au réchauffement de l’eau et à l’augmentation du dioxyde de carbone (CO2), en particulier en ce qui concerne sa reproduction. Cette espèce pourrait donc être potentiellement une victime spécifique du réchauffement climatique. De manière intéressante, ces études ont mis en évidence que la seule augmentation de la température avait un effet délétère plus important qu’une augmentation de la température couplée à une augmentation de la concentration en CO2 du milieu. L’augmentation de la concentration en CO2, par l’acidification du milieu qu’elle induit, conduirait à une baisse importante du rythme de croissance des individus (toutes les études ne sont pas concordantes sur ce point). Ce phénomène est couramment observé en laboratoire chez les crustacés.
Compte tenu de sa facilité d’élevage, Gammarus locusta est souvent utilisé pour réaliser des tests biologiques portant sur les effets de telle ou telle molécule, ou famille de molécules, dans l’eau de mer (voir, par exemple, Costa & al. 2005). Cette espèce présente par ailleurs l’avantage d’être sensible (la plus sensible des gammares européens) à la pollution et à la perturbation des paramètres abiotiques (impropres à la vie) du milieu. Elle est ainsi utilisée pour des tests de toxicité chronique (exposition de longue durée à de faibles concentrations) ou de toxicité aigüe (exposition à de fortes concentrations). De manière intéressante, certaines de ces études ont montré qu’une faible pollution en cuivre – pourtant connu pour sa toxicité – avait un effet positif sur la croissance et la reproduction des individus. A une concentration de 0,1 mg/L, les effets délétères du cuivre se manifestent cependant (la LC50 96h – Concentration Létale qui tue 50 % des individus après une exposition de 96 h – est de 0,3 mg/L pour Gammarus locusta). Plusieurs espèces d’amphipodes ont la capacité de « détoxifier » le cuivre en sécrétant des protéines spécifiques, puis de le stocker dans le corps (ici dans des granules intracellulaires). Il n’existe cependant pas encore de test normalisé de toxicité des sédiments utilisant Gammarus locusta, alors que les américains ont développé de leur côté leur propre norme utilisant une espèce locale (Leptocheirus plumulosus).
Une étude intéressante (Hartvig Christie & al., 2004) a analysé le fonctionnement d’un mésocosme (milieu artificiel, ici de 7 à 13 m3, reproduisant en laboratoire un milieu naturel) durant cinq années. Malgré l’abondance de nourriture potentielle (algues brunes et algues vertes), la population d’amphipodes présents dans le mésocosme est restée relativement stable, alors que ces espèces sont connues pour se développer très rapidement. Les deux principaux moteurs de la stabilité des populations de Gammarus locusta étaient le cannibalisme (régulant le taux effectif de reproduction) et l’exportation, les amphipodes étant sensibles à la densité de leur population.
Le fait que cette espèce ait été décrite par Linné n’est pas un hasard. Il s’agit d’un des gammares les plus communs sur nos côtes, localement très fréquent dans les algues ou sous les blocs rocheux. Elle jouerait, de ce fait, un rôle important dans les réseaux trophiques* dans les zones où elle se trouve.
Gammarus locusta pouvant avoir un intérêt en pisciculture (espèce facile à élever, riche en acides gras, et pouvant servir de nourriture aux poissons), des études ont été réalisées pour voir comment se développait l’amphipode à partir de nourriture alternative d’origine terrestre (feuilles de carotte et chair de noix de coco). Les résultats montrent que la population de contrôle, nourrie avec des morceaux de Fucus sp., se développe mieux que les populations alimentées par des végétaux terrestres, l’alimentation par la chair de noix de coco conduisant par ailleurs à un accroissement de la mortalité.
Crevettine : c'est le diminutif de crevette, sans doute lié à la ressemblance entre ces deux types de crustacés, les gammares étant plus petits.
Le nom de genre Gammarus provient du latin [gammarus] ou [cammarus] = nom d'un crustacé indéterminé, crevette, écrevisse. Ce genre a été créé en en 1775 par le naturaliste danois Johann Christian Fabricius (1745-1808).
Le nom d’espèce locusta a été attribué par Carl von Linné en 1758 dans son ouvrage Systema Naturae. Ce nom provient du latin [locusta] = sauterelle ou homard (utilisé par l'écrivain naturaliste romain Pline l'ancien -23-79-). Linné n’a donné aucune explication sur ce choix.
Numéro d'entrée WoRMS : 102281
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Arthropoda | Arthropodes | Animaux invertébrés au corps segmenté, articulé, pourvu d’appendices articulés, et couvert d’une cuticule rigide constituant leur exosquelette. |
| Sous-embranchement | Crustacea | Crustacés | Arthropodes à exosquelette chitineux, souvent imprégné de carbonate de calcium, ayant deux paires d'antennes. |
| Super classe | Multicrustacea | ||
| Classe | Malacostraca | Malacostracés | 8 segments thoraciques, 6 segments abdominaux. Appendices présents sur le thorax et l’abdomen. |
| Sous-classe | Eumalacostraca | Eumalacostracés | Présence d’une carapace recouvrant la tête et tout ou partie du thorax. |
| Super ordre | Peracarida | Péracarides | Les femelles sont dotées d'une cavité d'incubation formée par des expansions lamelleuses des péréiopodes. |
| Ordre | Amphipoda | Amphipodes | Péracarides comprimés latéralement, dépourvus de carapace, et possédant de nombreuses paires d'appendices souvent modifiés. Ils sont représentés par les gammares, les talitres, les caprelles... |
| Sous-ordre | Senticaudata | ||
| Famille | Gammaridae | Gammaridés | |
| Genre | Gammarus | ||
| Espèce | locusta |
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

Vue d'ensemble
Vue d’ensemble d’un individu capturé sur l’estran et ramené au laboratoire. Il s’agit d’un mâle, reconnaissable aux gnathopodes imposants. On voit que les péréiopodes 5 à 7 sont orientés dans une direction différente des péréiopodes 1 à 4. Les 3 paires de pléopodes abdominaux sont bien visibles, tout comme les 3 paires d’uropodes vers la « queue ». Le flagelle accessoire porté par les antennes 1 est ici bien visible, tout comme l’œil réniforme.
Macrophoto, rapport 1:1 d’un individu capturé sur l’estran, Pleubian, Plage de Port-Béni (22)
13/08/2022
 Crustacés Malacostracés (crabes, crevettes...)
Crustacés Malacostracés (crabes, crevettes...)

L'antenne 1
Vue au microscope de l’antenne 1 et de son flagelle accessoire, comportant ici 11 articles (sans la pointe).
Photographie prise au microscope
18/08/2022


Le flagelle de l'antenne 2
Vue du flagelle de l’antenne 2 d’un mâle, montrant les calcéoles à la base des soies sur sa partie proximale. Ces calcéoles n’existent pas chez les mâles de Gammarus insensibilis, espèce avec laquelle la confusion est la plus facile.
Macrophotographie au rapport 1:1 recadrée
18/08/2022
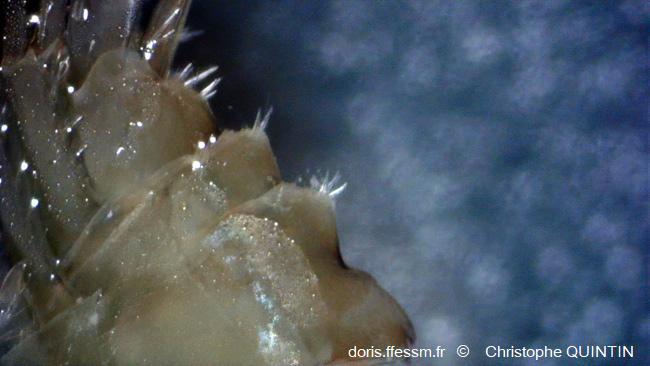
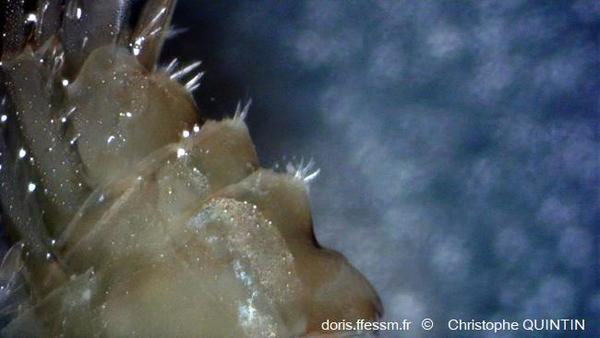
Les "bosses" de l'urosome
Vue de l’urosome, mettant en évidence les « bosses » dorsales ainsi que les rangées d’épines.
Photographie prise à la loupe binoculaire
18/08/2022


Vue d’un uropode
L’endopode et l’exopode ont approximativement la même longueur.
Photographie prise à la loupe binoculaire
18/08/2022
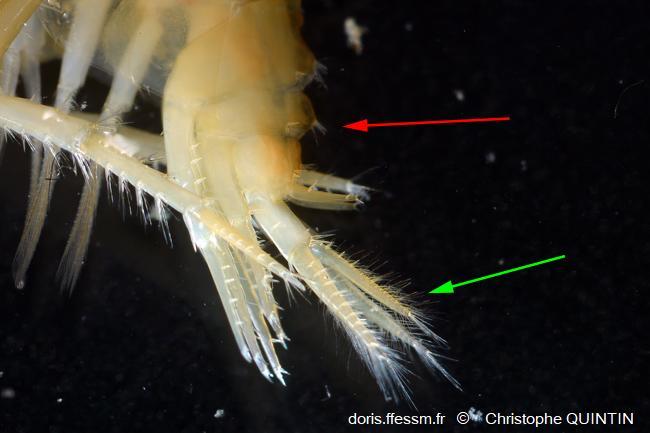
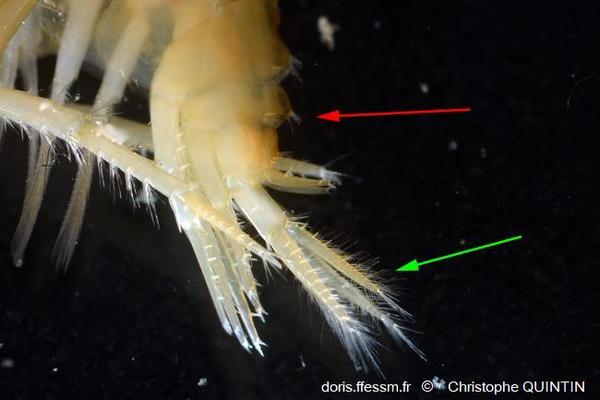
Vue latérale de la partie caudale d’un mâle
La flèche rouge montre les épines et les bosses sur l’urosome. La flèche verte montre les uropodes 3.
Macrophotographie rapport 1:1 recadrée d’un individu capturé sur l’estran à Pleubian, plage de Port-Béni (22)
18/08/2022


Vue de la plaque épimérale 3
La flèche verte montre la zone où se situent les soies caractéristiques de l’espèce.
Macrophotographie rapport 1:1 recadrée d’un individu capturé sur l’estran à Pleubian, plage de Port-Béni (22)
18/08/2022


Vue de la base du péréiopode 7
Sa longueur est d’environ 1,5 fois sa largeur. Sa forme est différente chez Gammarus insensibilis, qui aura une base plus longue et aux bords plus rectilignes.
Photographie prise au microscope
18/08/2022


Un gnathopode
Vue au microscope d’un gnathopode 2 de mâle. L'extrémité est à gauche.
Photographie prise au microscope.
18/08/2022
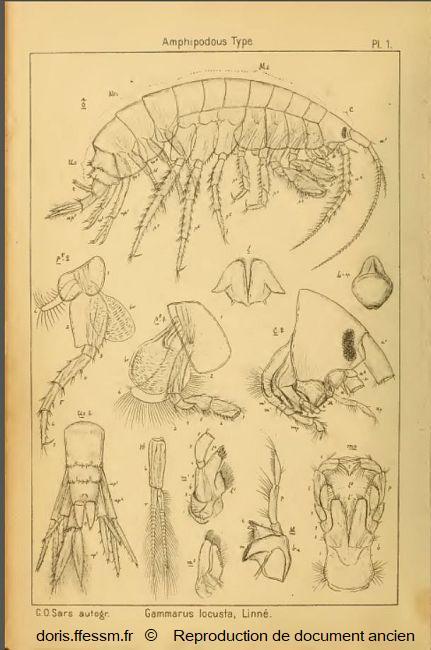
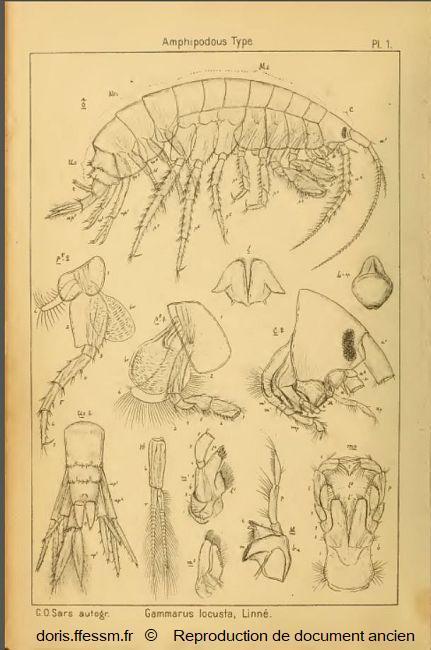
Gammarus locusta mâle
Cette planche montre les différentes parties anatomiques d'un gammare. Gammarus locusta est pris comme exemple.
Pour faciliter la lecture du document, seuls les appendices (antennes, gnathopodes, péréiopodes, pléopodes et uropodes) du côté droit ont été représentés.
Planche 1, Sars G.O., 1895, Volume 1, Amphipodes, planches
Reproduction de documents anciens
1895
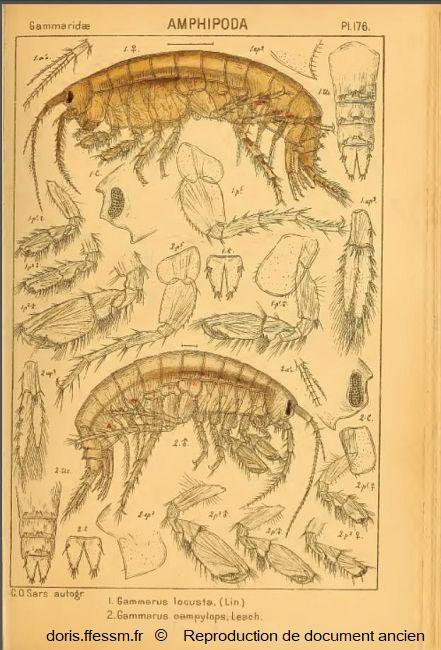
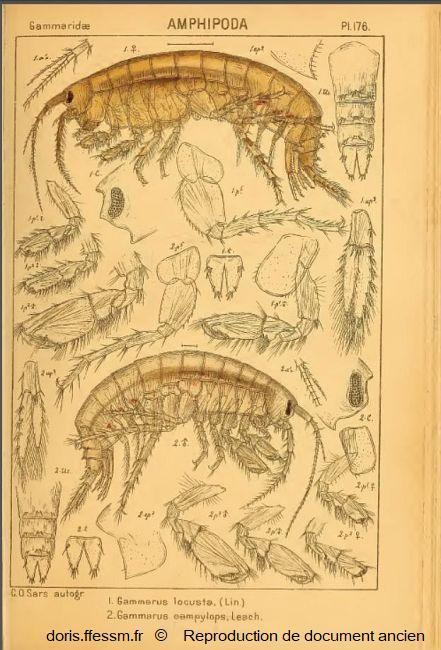
Gammarus locusta femelle (en haut)
Cette planche montre l'anatomie d'une femelle de Gammarus locusta et ses caractéristiques (légendes notées 1).
En dessous (fig. 2), il s'agit d'un mâle de Gammarus campylops, appelé actuellement Echinogammarus incertae sedis campylops Leach, 1814.
Pour faciliter la lecture du document, seuls les appendices (antennes, gnathopodes, péréiopodes, pléopodes et uropodes) du côté droit ont été représentés pour G. locusta et du côté gauche pour G. campylops.
Planche 176, fig. 1, Sars G.O., 1895 Vol 1, Amphipodes, Planches
Reproduction de documents anciens
1895
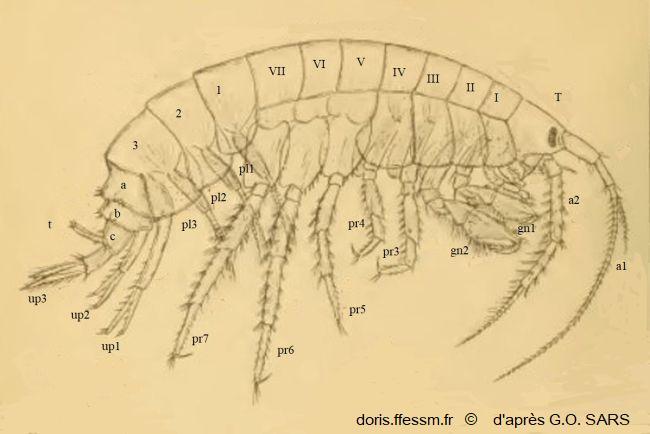
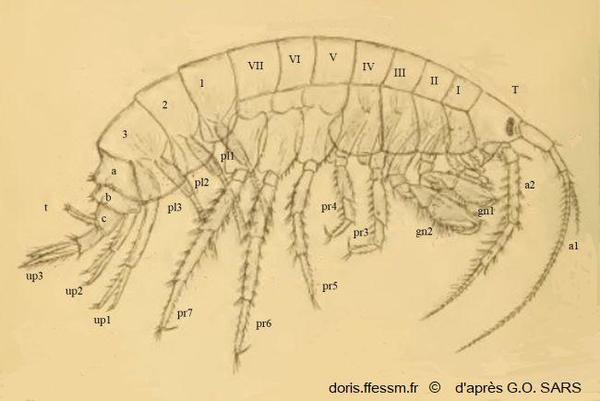
Schéma légendé de Gammarus locusta mâle
T = Tête ;
Antennes : a1 et a2 ;
Mésosome : I à VII avec Gnathopodes : gn1 et gn2 ; Péréiopodes avec pr3 à pr7 ;
Métasome 1, 2,3 avec Pléopodes : pl1, pl2 et pl3 ;
Urosome avec a, b, c, Uropodes up1, up2, up3
et t = telson
Pour faciliter la lecture du document, seuls les appendices (antennes, gnathopodes, péréiopodes, pléopodes et uropodes) du côté droit ont été représentés.
extrait légendé de la planche 1 de Planche 1, Sars G.O., 1895, Volume 1, Amphipodes, planches
Reproduction de documents anciens
1895
Rédacteur principal : Christophe QUINTIN
Vérificateur : Pierre NOËL
Responsable régional : Yves MÜLLER
Cardoso P.G., Loganimoce E.M., Neuparth T., Rocha M.J., Rocha E., Arenas F., 2018, Interactive effects of increased temperature, pCO2 and the synthetic progestin levonorgestrel on the fitness and breeding of the amphipod Gammarus locusta, Environmental Pollution, 236, 937-947.
Christie H., Kraufvelin P., 2004, Mechanisms regulating amphipod population density within macroalgal communities with low predator impact, Scientia Marina, 68, 189-198.
Correia A.D., Costa F.O., Neuparth T., Diniz M.E., Costa M.H., 2001, Sub-lethal effects of copper-spiked sediments on the marine amphipod Gammarus locusta : Evidence of Hormesis ?, Ecotoxicology and Environmental Restoration, 4(2), 32-38.
Costa F.O., Correia A.D., Costa M.H., 1998, Acute marine sediment toxicity : a potential new test with the amphipod Gammarus locusta, Ecotoxicology and environmental safety, 40, 81-87.
Costa F.O., Costa M.H., 2000, Review of the ecology of Gammarus locusta (L.), Polskie Archiwum Hydrobiologii, 47, 541-559.
Costa F. O., Neuparth T., Correia A. D., Costa M.H., 2005, Multi-level assessment of chronic toxicity of estuarine sediments with the amphipod Gammarus locusta : II. Organism and population-level endpoints, Marine Environmental Research, 60(1), 93–110.
Dellali M., Douggui A., Harrath A.H., Mansour L., Alwasel S., Beryem H., Gyedu-Ababio T., Rohal-Lupher M., Boufahja F., 2021, Acute toxicity and biomarker responses in Gammarus locusta amphipods exposed to copper, cadmium, and the organochlorine insecticide dieldrin, Environmental Science and Pollution Research.
Diaz-Morales D.M., Khosavi M., Grabner D.S., Nahar N., Bommarito C., Wahl M., Sures B., 2022, The trematode Podocotyle atomon modulates biochemical responses of Gammarus locusta to thermal stress but not its feeding rate or survival, Science of The Total Environment, 159946.
Hauton C., Tyrell T., Williams J., 2009, The subtle effects of sea water acidification on the amphipod Gammarus locusta, Biogeosciences, 6, 1479-1489.
Le Mao P., Godet L., Fournier J., Desroy N., Gentil F., Thiébaut E., 2019, Atlas de la faune marine invertébrée du golfe Normano-Breton, Volume 4 : Arthropodes, Ed. Station biologique de Roscoff, 237 pp.
Lundbye Petersen H., 2012, Biomarkers of exposure and effects in a pyrene exposed amphipod (Crustacea : Gammarus), Thèse de master, Faculté des Sciences, Université de Copenhague, 93p.
Neuparth T., Correia A. D., Costa F. O., Lima G., Costa M.H., 2005, Multi-level assessment of chronic toxicity of estuarine sediments with the amphipod Gammarus locusta : I. Biochemical endpoints, Marine Environmental Research, 60(1), 69–91.
Pacaud A., 1945, Les amphipodes de la faune nutritive des eaux douces françaises, Bulletin français de pisciculture, 136, 105-120.
Ribes-Navarro A., Aberts-Hubatsch H., Monroig O., Hontoria F., Navarro C., 2022, Effects of diet and temperature on the fatty acid composition of the gammarid Gammarus locusta fed alternative terrestrial feeds, Frontiers in Marine Science, 1-11.
Stock J.H., 1967, A revision of the European species of the Gammarus locusta-group (Crustacea, amphipoda), Zoologische Verhandelingen, 90, 3-56.
Vader W., Tandberg A.H.S., 2019, Gammarid ampiphods (Crustacea) of Norway, with a key to species, Fauna norvegica, 39,12-25.
La page de Gammarus locusta dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.