Petit crustacé planctonique (de 0,5 à 0,8 mm de long)
Corps transparent fusiforme en 3 parties
Antennules courtes
Front doté d’une excroissance triangulaire
Antennules du mâle élargies et géniculées
un œil unique rouge
Euterpe acutifrons (Dana, 1847)
Harpacticus acutifrons Dana, 1848
Tachidius acutifrons (Dana, 1847)
Euterpe gracilis Claus, 1863
Euterpina gracilis (Claus, 1863)
Euterpe armata Scott T., 1894
Euterpe gracilis armata Scott T., 1894
Euterpina armata (Scott T., 1894)
Tachidius elongatus (Labbé, 1926)
Rhyncoceras elongatus Labbé, 1927
Laophonte sagenarum Oliveira, 1945
Tachidius hydrobiologicus Oliveira, 1945
Cosmopolite
Zones DORIS : ● Europe (côtes françaises), ● Atlantique Nord-Ouest, ● Indo-Pacifique, ● Caraïbes, ○ [Méditerranée française]Cette espèce est cosmopolite et fréquente la plupart des eaux du globe, à l’exception des eaux les plus froides.
Elle fréquente les eaux comprises entre le 60e parallèle nord et le 40e parallèle sud.
L'espèce est potentiellement présente dans toutes les zones marines DORIS.
Euterpina acutifrons est une espèce pélagique*, ce qui est rare chez les copépodes* harpacticoïdes, présentant des affinités néritiques*. On la trouvera plutôt près des côtes, son observation en pleine mer étant occasionnelle.
L’espèce est euryhaline* puisqu’elle est rencontrée dans un intervalle de salinité allant de 8 ‰ à 39 ‰. On peut la rencontrer en milieu estuarien.
La détermination des copépodes* est en général une affaire de spécialistes, nécessitant une dissection pour observer correctement les détails anatomiques déterminants. Euterpina acutifrons est une exception marquante, car cette espèce possède une caractéristique unique liée à la forme du front, pointu, qui permet de l'identifier immédiatement.
Euterpina acutifrons présente, comme la majorité des copépodes, un corps de petite taille (le microscope est indispensable pour l’observation), fusiforme, enveloppé d’un tégument* chitineux*. Le corps est constitué de trois parties : un céphalothorax*, fusionnant la tête et le premier segment thoracique, le thorax (ou métasome) et l’abdomen (ou urosome*). Le corps est transparent comme la plupart des copépodes planctoniques.
Le céphalothorax et le thorax portent ventralement des appendices transformés en organes natatoires, préhensiles ou masticatoires (rostre*, labre*, paire de mandibules*, de maxillules*, de maxilles* et de maxillipèdes*). L'œil est rouge chez les individus vivants. En avant du labre sont insérées deux paires d’antennes : les antennules* (ou antennes1) et les antennes* sensu stricto (ou antennes 2, plus petites). Comme chez tous les copépodes harpacticoïdes, les antennes 1 sont relativement courtes (environ la moitié de la longueur du céphalothorax et du thorax). Elles sont préhensiles chez le mâle (dernier article en forme de pince). Les antennes 1 des femelles ont 7 articles. Les antennes 1 des mâles n’ont que 5 articles car les articles 4 et 5, ainsi que 6 et 7 sont fusionnés. Les articles résultants sont considérablement élargis par rapport à ceux des femelles, ce qui permet une identification rapide du sexe. Par ailleurs, les antennes 1 des mâles sont géniculées* (elles présentent un coude). Les antennes 2 ont 3 articles dans les deux sexes.
Le métasome, ou thorax, est constitué de 4 segments articulés (le premier segment, non comptabilisé ici, étant intégré au céphalothorax), tous porteurs ventralement d’appendices natatoires ou préhensiles. Le dernier segment thoracique semble, en vue dorsale, davantage appartenir à l’abdomen qu’au thorax (en anatomie des copépodes, il est classé dans le corps postérieur, alors que les autres segments thoraciques appartiennent au corps antérieur). L’urosome*, ou abdomen, est plus court que le thorax et mesure environ la moitié du corps antérieur. Il est constitué de 5 segments chez la femelle et de 6 segments chez le mâle. La largeur des segments abdominaux diminue fortement de l’avant vers l’arrière du corps, la largeur du dernier segment abdominal étant environ un quart de la largeur du premier segment abdominal.
Le telson* est inséré sur le dernier segment abdominal pour former la furca* (deux branches parallèles). Chaque branche furcale porte 6 soies* de longueurs inégales. Les soies les plus longues font près de la moitié de la longueur du corps.
La longueur du corps des femelles est comprise entre 0,5 et 0,75 mm. Celle des mâles est comprise entre 0,5 et 0,7 mm.
Si l’on ne porte pas d’attention à la forme très particulière du front de Euterpina acutifrons, cette espèce ressemble énormément aux autres espèces de copépodes* harpacticoïdes qui rappelons-le sont majoritairement benthiques et rampants.
Euterpina acutifrons est un filtreur se nourrissant principalement d’algues et de débris planctoniques*. Nassogne (1970) a conduit des expérimentations intéressantes en laboratoire, en alimentant le copépode avec plusieurs algues planctoniques. Ces expérimentations ont montré que les algues de taille inférieure à 6 ou 7 µm (comme Emiliana huxley) ne sont pas consommées par les copépodes. Symétriquement, les algues de taille supérieure à 16 µm (comme les dinoflagellés Prorocentrum micans et Gymnodinium sp.) ne sont pas consommées par les stades les plus jeunes, les adultes pouvant cependant s’en nourrir. Ces expérimentations ont par ailleurs montré que la production d’œufs était favorisée par une consommation d’algues variées (ceci probablement pour trouver les micronutriments nécessaires).
Sautour et Castel (1993) ont montré que l’efficacité de filtration augmente avec la taille des algues présentes. Ils ont par ailleurs invalidé partiellement les travaux de Nassogne puisque les copépodes ingèrent bien des particules artificielles inertes de 5 µm, mais il faut que leur concentration dans le milieu soit suffisante (supérieure à 500 à 1000 particules/ml.). En dessous de cette concentration, le copépode arrête de se nourrir. Ceci signifie concrètement que Euterpina acutifrons réagit à des stimuli mécaniques (les particules artificielles utilisées ne pouvant pas activer de récepteurs chimiques).
Quand la concentration en algues augmente dans le milieu, le rythme de filtration du copépode diminue, mais la production d’œufs augmente jusqu’à atteindre un plateau.
Les sexes sont séparés et il existe un dimorphisme* sexuel assez net, notamment observable au niveau des antennes* 2 (voir description). Les femelles sont souvent un peu plus grandes que les mâles. Il existe deux sortes de mâles, les uns étant plus petits que les autres.
On peut distinguer les deux sortes de mâles à leurs antennules* (les antennules des grands mâles comportent de nombreuses soies* sur l’article 3, contrairement aux petits mâles – les photographies de cette fiche ne présentent que des grands mâles). Ces deux sortes de mâles ont un comportement sexuel différent, les petits mâles étant plus actifs pour la reproduction, et recherchant davantage l’accouplement que les grands mâles. Ces petits mâles se développent par ailleurs plus rapidement que les grands mâles (atteinte de la phase adulte un jour plus tôt).
Pour l’accouplement, le mâle approche la femelle par l’arrière (côté furca*) et saisit les soies de la furca avec ses antennes 1 (antennules). Il nage un moment avec la femelle dans cette position, puis change sa prise en déplaçant l’une de ses antennules du même côté que l’autre. Son corps est alors perpendiculaire à celui de la femelle. Il positionne ensuite l’antennule qui n’avait pas lâché prise de l’autre côté de la furca et se retrouve alors tête-bêche avec la femelle. Le mâle engage alors un mouvement de rotation de manière à ce que les deux faces ventrales soient en vis-à vis. Il dépose ensuite un spermatophore* à proximité de l’orifice génital de la femelle puis revient en position dorsale. La copulation proprement dite ne dure que quelques secondes, tandis que l’accouplement peut durer jusqu’à une dizaine d’heures. Le spermatophore prend du volume et durcit au contact de l’eau de mer. Une seule copulation permet aux femelles d’assurer la fécondation de leurs œufs durant toute leur période de fertilité. Les mâles s’accouplent avec des femelles adultes peu après la mue terminale de la femelle (des femelles maintenues à l’écart après leur mue et réintroduites dans un bassin avec des mâles intéressent moins ces derniers).
Dans les expérimentations conduites par Haq (1972), il a été observé que les petits mâles s’accouplent très rapidement lorsqu’ils sont mis en contact avec une femelle vierge (entre 5 mn et une heure). Les grands mâles mettent un temps nettement plus long pour y parvenir (jusqu’à une journée). Ces petits mâles semblent avoir un comportement très lié à la reproduction, puisqu’il a été observé à plusieurs reprise des petits mâles s’engageant dans un accouplement (jusqu’au dépôt de spermatophore…) avec un grand mâle. De même, un petit mâle mis en contact avec plusieurs femelles s’accouplera jusqu’à 11 fois en 15 jours, alors qu’un grand mâle n'y parviendra que 4 fois sur la même période.
La femelle pond ses œufs par séries (4 rangées d’œufs en général à chaque série, qui gonflent rapidement après la ponte). Une nouvelle ponte n’intervient que lorsque la première ponte a éclos. Les femelles qui se sont accouplées avec des grands mâles ont des pontes plus grosses que les femelles qui se sont accouplées avec des petits mâles (ce qui induit une dépense énergétique supérieure).
La femelle porte ses œufs fécondés dans un seul sac ovigère* (ou ovisac) situé sous l’abdomen. Le nombre d’œufs par ovisac est en moyenne d’une trentaine, le maximum observé par Haq étant de 42. Le nombre et la taille des œufs varient en fonction de la nourriture disponible. Lorsque la nourriture est abondante, la femelle produit davantage d’œufs, de plus petite taille. Lorsque la nourriture se fait plus rare, le nombre d’œufs par sac diminue et la taille des œufs augmente.
Les expérimentations conduites par Zurlini & al. (1978) montrent qu'à 18 °C, la durée de vie adulte de la femelle est de 31 jours en moyenne et la femelle est fertile pendant 28 jours. Elle donnera naissance, en milieu contrôlé, toujours en moyenne, à 294 larves* (pour une production de 355 œufs). Les chiffres obtenus par Haq, sur une population différente (Zurlini a travaillé sur une population méditerranéenne tandis que Haq a travaillé sur une population de la Manche), était nettement plus faibles (98 œufs au maximum pour une femelle). Lorsque les conditins sont favorables (en eaux chaudes notamment), l'espèce peut se reproduire tout au long de l'année, sans diapause*.
Chaque œuf donne naissance à une larve appelée nauplius*; cette dernière passera par six mues*, très rapides puisqu’il faut une journée environ pour passer d’un stade larvaire au suivant, puis se transformera en copépodite* (le dernier stade nauplius est numéroté VI). La larve copépodite subira 5 mues avant de devenir un copépode adulte (qui correspond au stade copépodite VI). Au cours de ces différentes mues, le corps va s’allonger et les segments du corps adulte vont progressivement apparaître (le copépodite stade I n’a que 3 segments au métasome et 2 segments à l’urosome*). Les segments adultes des antennules* vont également apparaître progressivement lors des différentes mues.
Le cycle de développement complet comprend onze mues.
Dès l’éclosion, les larves nauplii se déplacent à la recherche de nourriture en actionnant les appendices dont le nombre est très limité au stade I (antennes*, antennules* et mandibules*).
La durée entre l’éclosion et la phase adulte est d’une dizaine de jours à 18 °C. Elle est légèrement plus longue (1 jour en moyenne) chez la femelle que chez le mâle, la différence se situant essentiellement au niveau du stade copépodite IV. La distinction entre mâles et femelles n’est pas possible avant le stade copépodite III.
Euterpina acutifrons est une espèce qui se reproduit sur une large plage de température (entre 8 °C et 30 °C), comme le laisse supposer son aire de distribution. La saison de la reproduction (dans les eaux tempérées) ne débute que lorsque l’eau atteint une température proche de son maximum (16 °C dans les études menées par Haq près d’Aurigny), puis elle se poursuit alors que la température de l’eau baisse et s’arrête aux portes de l’hiver. Dans les eaux tropicales, l’espèce se reproduit toute l’année. L’optimum de croissance et de fécondité de Euterpina acutifrons correspond à une température comprise entre 16 °C et 20 °C.
Les études semblent montrer qu’il existe plusieurs lignées écophysiologiques de cette espèce, ayant des propriétés physiologiques différentes (par exemple, comme évoqué plus haut, les populations de la Manche et les populations de Méditerranée).
Euterpina acutifrons peut servir de support, parfois de manière importante, pour la diatomée* Sceptronema orientale. Cette diatomée* épibionte*, décrite au Japon par Hideaki Takano en 1983, a été observée en Méditerranée orientale en 1992 et en rade de Brest et dans plusieurs endroits au large de la Manche en 2018. Compte tenu de la forte pression d’observation du plancton* marin en Manche, et de l’abondance du copépode Euterpina acutifrons, on peut donc supposer que cette diatomée, qui présente plutôt des affinités pour les eaux chaudes, est apparue récemment dans la Manche.
Cette association spécifique avec Sceptronema orientale pourrait constituer un marqueur biologique utile pour la détection de cette diatomée.
Compte tenu de sa présence significative dans le zooplancton*, Euterpina acutifrons est une ressource importante pour les poissons de petite taille, comme les sardines ou les sprats.
La durée de vie de Euterpina acutifrons est relativement courte : 23 jours en moyenne en élevage à 18 °C selon Zurlini & al., moins selon d’autres auteurs ; elle peut dépasser 45 jours dans certaines conditions de température et d’alimentation. Plus la température s’élève, plus la durée de vie se raccourcit.
Euterpina acutifrons peut être particulièrement abondante dans les masses d’eau côtières. Elle représente une part importante de la biomasse zooplanctonique*, aux côtés d’autres copépodes comme Acartia spp., Centropages hamatus et Temora longicornis sur la façade atlantique. En mer noire, Euterpina acutifrons peut être l’espèce dominante à certaines périodes de l’année (juillet).
Les expérimentations conduites par Marinho da Costa & al. (2002) ont montré que Euterpina acutifrons pouvait se nourrir sans dommage des dinoflagellés toxiques Alexandrium minutum et Gyrodinium corsicum.
L’observation du comportement alimentaire de ce copépode n’est donc d’aucune utilité pour déterminer la toxicité d’un dinoflagellé vis-à-vis des poissons.
Les copépodes* harpacticoïdes présentent l’intérêt de pouvoir être cultivés en forte densité, contrairement aux copépodes calanoïdes. De ce fait, Euterpina acutifrons, qui est l’un des copépodes harpacticoïdes pélagiques* les plus fréquents, a fait l’objet de très nombreuses études relatives à sa culture. Des cultures pérennes de cette espèce sont aujourd’hui parfaitement maîtrisées et elle peut donc être utilisée pour de nombreuses expérimentations en laboratoire.
Euterpina acutifrons est un modèle biologique utilisé en aquaculture (pour le nourrissage larvaire des poissons et des crustacés).
Cette espèce présente un intérêt comme indicateur de productivité côtière.
Le genre Euterpina ne comporte qu'une seule espèce, E. acutifrons
Euterpine à front pointu, c'est la simple francisation du nom scientifique.
Euterpina : le nom de genre Euterpina est un diminutif probable d'Euterpe, la muse de la musique. Ce nom de genre a été créé en 1903 par Alfred Merle Norman (1831-1918). Le nom de genre Euterpe, proposé par erreur par Carl Friedrich Wilhelm Claus (1835-1899) en 1863 pour l’espèce Euterpe gracilis (un synonyme actuel de Euterpina acutifrons), avait déjà été attribué à un lépidoptère par William Swainson (1789-1855) en 1831 et Norman a rectifié cette erreur en créant le genre Euterpina.
acutifrons : le nom d’espèce acutifrons provient du latin [acutus] = pointu et du latin [frons] = le front, à front pointu, en référence directe à la principale caractéristique morphologique de cette espèce. Ce nom d’espèce a été créé en 1848 par James Dwight Dana (1813-1895), un scientifique américain surtout connu pour ses travaux en géologie.
Numéro d'entrée WoRMS : 116162
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Arthropoda | Arthropodes | Animaux invertébrés au corps segmenté, articulé, pourvu d’appendices articulés, et couvert d’une cuticule rigide constituant leur exosquelette. |
| Sous-embranchement | Crustacea | Crustacés | Arthropodes à exosquelette chitineux, souvent imprégné de carbonate de calcium, ayant deux paires d'antennes. |
| Super classe | Multicrustacea | ||
| Classe | Copepoda | Copépodes | |
| Infra-classe | Neocopepoda | Néocopépodes | |
| Super ordre | Podoplea | Podopléens | Le corps est divisé en deux parties, la séparation passe en avant du dernier segment thoracique. Le corps postérieur est formé de l'abdomen et d'un segment thoracique et porte une paire d'appendices à la face ventrale.(Rose, 1933) |
| Ordre | Harpacticoida | Harapcticoides | Première paire d'antennes très courte, la deuxième est biramée. L'abdomen est large et souvent le corps est vermiforme. |
| Famille | Tachididae | Tachididés | |
| Genre | Euterpina | ||
| Espèce | acutifrons |
 Autres Crustacés (Copépodes, Ostracodes, Branchiopodes,...)
Autres Crustacés (Copépodes, Ostracodes, Branchiopodes,...)

Vue dorsale du copépode Euterpina acutifrons mâle.
Ce copépode* est immédiatement reconnaissable à la forme en triangle de l'apex* du céphalosome*. Chez les mâles, les articles 4 et 5 des antennes* 1, que l'on voit bien sur la photo, sont fusionnés et élargis.
Les Noirs, Saint-Quay-Portrieux (22), prélèvement en surface au filet à plancton maille 35 microns
Observation au laboratoire au microscope avec un objectif x10
06/08/2025
 Autres Crustacés (Copépodes, Ostracodes, Branchiopodes,...)
Autres Crustacés (Copépodes, Ostracodes, Branchiopodes,...)

Vue latérale d'une femelle.
Les femelles n'ont pas les articles antennaires élargis comme les mâles, ce qui permet de les reconnaître même lorsqu'elles ne sont pas ovigères*.
Les Noirs, Saint-Quay-Portrieux (22), prélèvement en surface au filet à plancton maille 35 microns
Observation au laboratoire au microscope avec un objectif x10
06/08/2025


Vue détaillée des antennes 1 d'une femelle.
Les antennes* 1 possèdent 7 articles.
Les Noirs, Saint-Quay-Portrieux (22), prélèvement en surface au filet à plancton maille 35 microns
Observation au laboratoire au microscope avec un objectif x40
06/08/2025
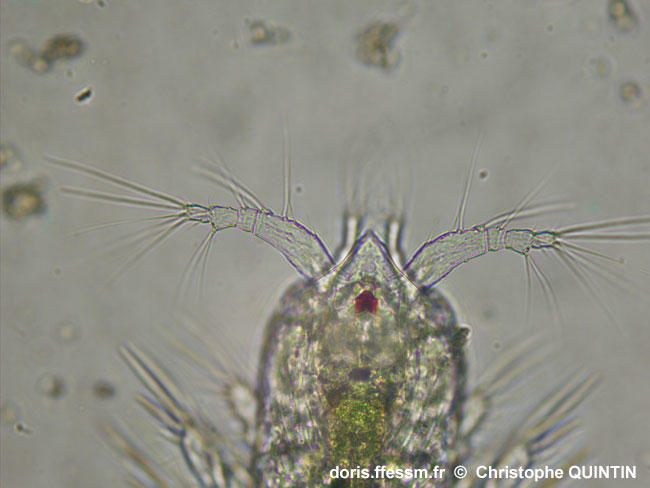
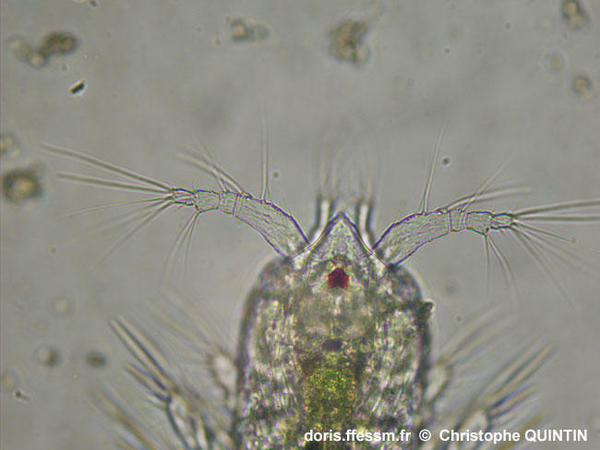
Vue ventrale des antennes 1 d'une copépodite stade I.
Si l’on confirme facilement le fait qu’il s’agit de Euterpina acutifrons à la forme très particulière du front, on constate que les antennules* (ou antenne 1) sont très différentes de celles d’un adulte (photographie précédente). On ne compte que 4 segments. Il s’agit d’un stade copépodite* I, le premier stade copépodite après la phase nauplius*. On voit ici nettement l'œil rouge impair du copépode (œil nauplien).
Prélèvement en surface au filet à plancton maille 35 microns, port de Binic (22).
Observation au laboratoire au microscope avec un objectif x40.
04/10/2025
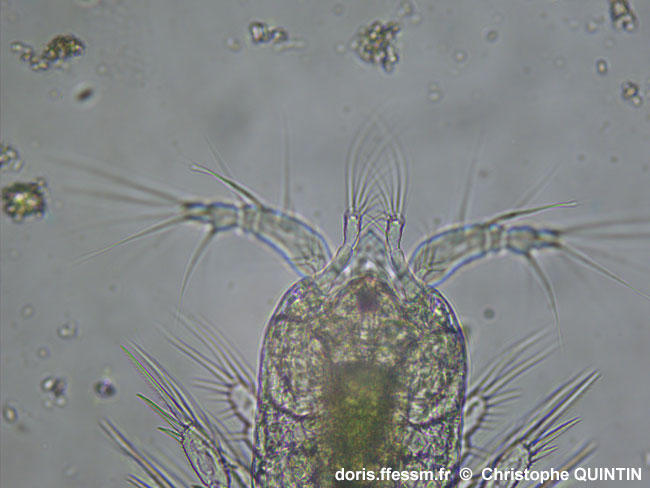
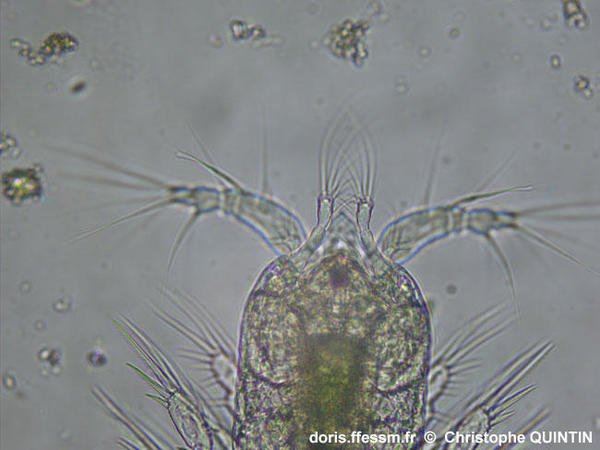
Vue ventrale des antennes 2 d'un copépodite stade I.
Le changement de mise au point par rapport à la photographie précédente permet d’observer les antennes 2 (ou antennes*), positionnées sous les antennes 1.
Prélèvement en surface au filet à plancton maille 35 microns, port de Binic (22),
Observation au laboratoire au microscope avec un objectif x40
04/10/2025


Vue dorsale d’un copépodite stade I.
Cette photographie permet de constater que les différences entre les différents stades de copépodite* sont subtiles et nécessitent un peu d’attention. Les clefs de détermination des copépodes* sont généralement fondées sur la phase adulte et la plus grande précaution doit donc être prise si on veut les utiliser sur des stades non adultes.
Prélèvement en surface au filet à plancton maille 35 microns, port de Binic (22),
Observation au laboratoire au microscope avec un objectif x10.
04/10/2025

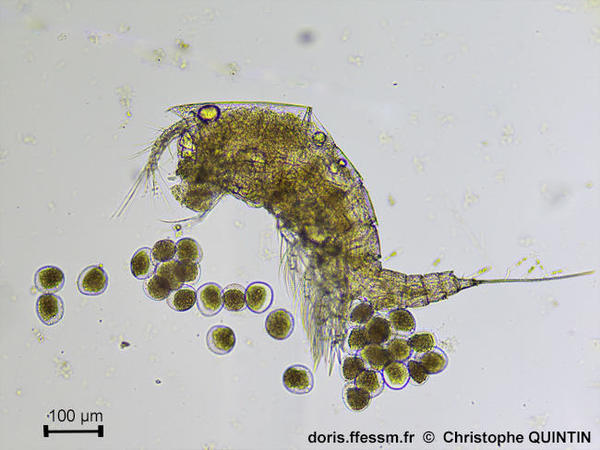
Vue latérale d’une femelle ovigère.
L’ovisac a été détérioré par les manipulations, mais une partie est restée en place, sous l’abdomen. Cette photographie permet de voir la taille des œufs. Le nombre d’œufs est peu important (une trentaine ici). A noter la présence de la diatomée* Sceptronema orientale sur les segment abdominaux et les soies* apicales*.
Prélèvement en surface au filet à plancton (maille 35 microns), les Noirs, Saint-Quay-Portrieux (22).
Observation au laboratoire au microscope avec un objectif x10
06/08/2025
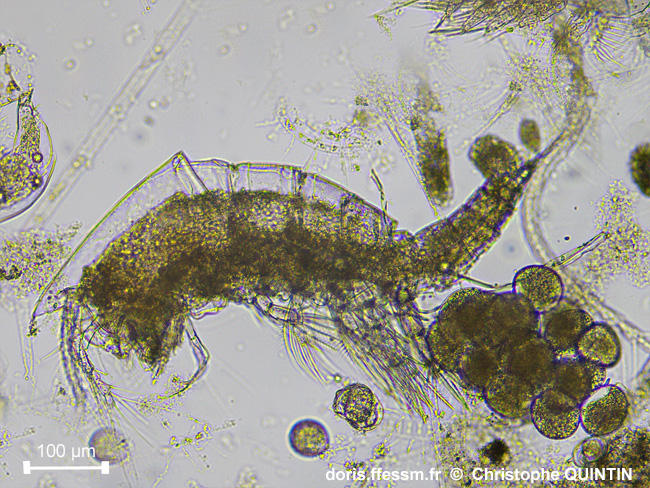
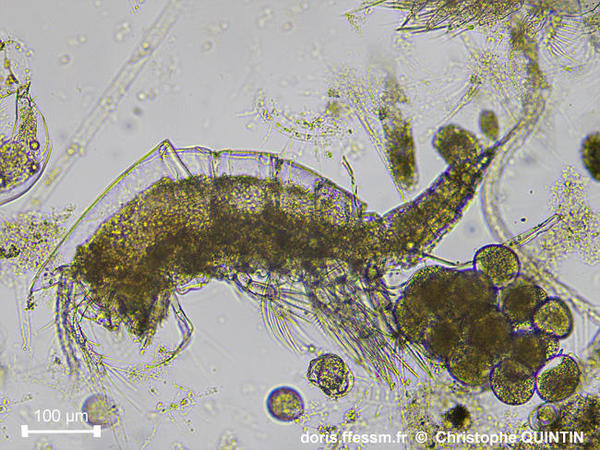
Vue latérale d’une femelle ovigère.
L’ovisac est ici quasi complet. Cette photographie permet de bien distinguer le céphalothorax, les 4 segments thoraciques libres qui suivent, un maxillipède postérieur, orienté vers l’avant, et la première patte thoracique.
Prélèvement en surface au filet à plancton (maille 35 microns), les Noirs, Saint-Quay-Portrieux. (22).
Observation au laboratoire au microscope avec un objectif x10.
06/08/2025
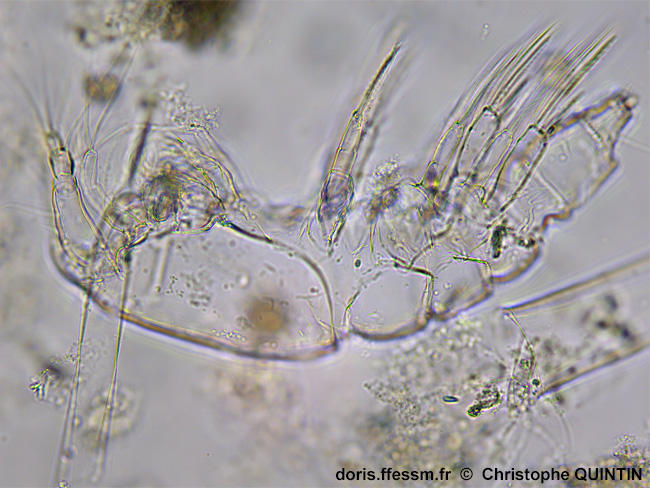
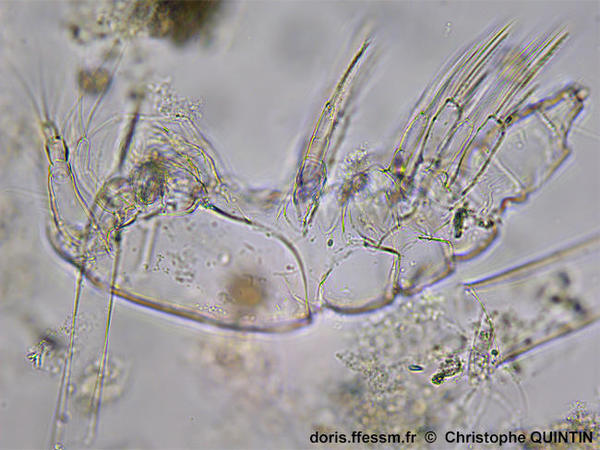
Vue latérale d’une cuticule après la mue.
On aperçoit ici les pattes thoraciques portées par chaque segment.
Prélèvement en surface au filet à plancton (maille 35 microns), les Noirs, Saint-Quay-Portrieux. (22).
Observation au laboratoire au microscope avec un objectif x10.
06/08/2025
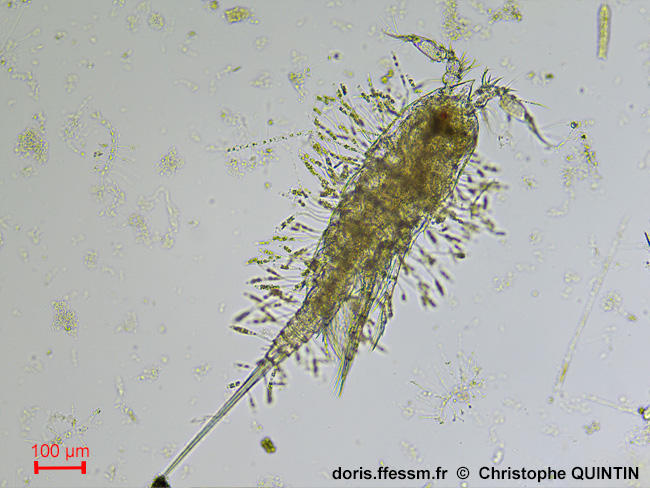
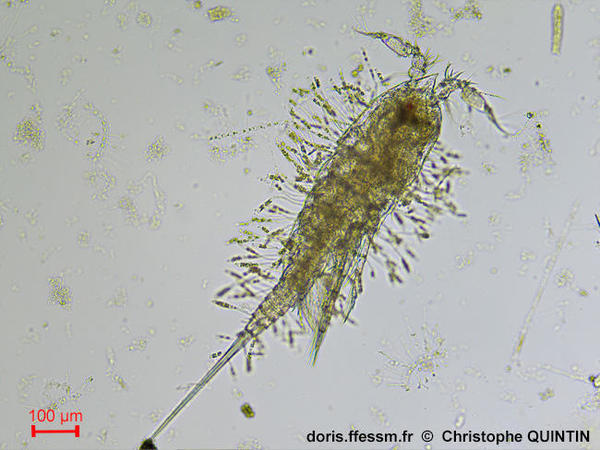
Vue dorsale du copépode Euterpina acutifrons, avec de nombreuses diatomées Sceptronema orientale en épibionte
Eupertina acutifrons présente une association unique avec la diatomée Sceptronema orientale. Cette diatomée* n'est pas connue en dehors de cette association.
Observation au laboratoire au microscope avec un objectif x10
Prélèvement en surface au filet à plancton maille 35 microns
Les Noirs, Saint-Quay-Portrieux (22),
06/08/2025
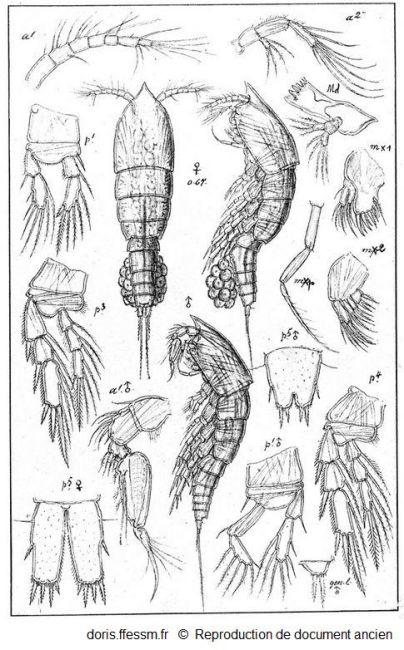
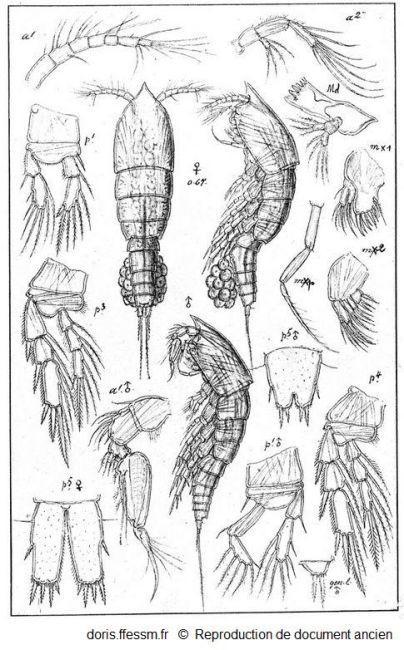
Euterpina acutifrons (Dana, 1847).
Représentation d'une femelle ovigère*, d'un mâle et de nombreux appendices.
Sars G.O., 1919. Planche LXVII.in Razouls
Reproduction de documents anciens
1919
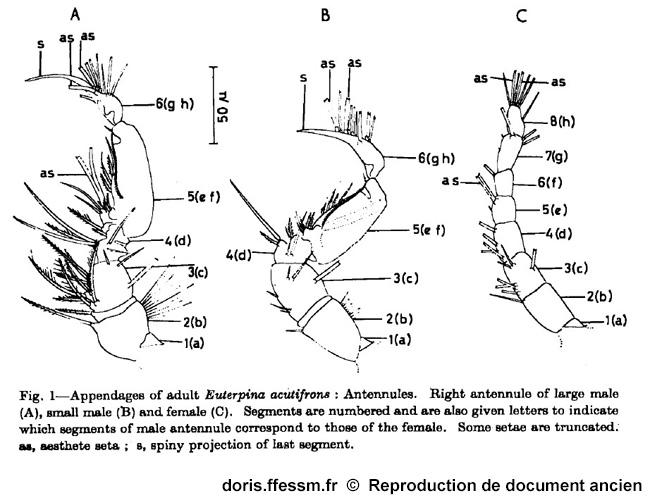
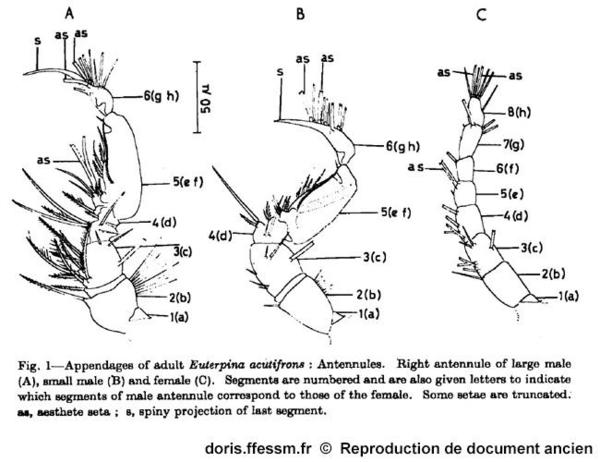
Illustration originale de S.M. Haq
Ce dessin permet de comparer les antennules* du grand mâle, du petit mâle et de la femelle.
S.M. Haq, 1965, p. 177
Reproduction de documents anciens
1965
Rédacteur principal : Christophe QUINTIN
Vérificateur : Pierre NOËL
Responsable régional : Yves MÜLLER
Benedetti F., Gasparini S., Ayata S.-D., 2015, Identifying copepod functional groups from species functional traits, Journal of Plankton Research, 38. 10.1093/plankt/fbv096.
Le Bourg B., Banaru D., Saraux C., Nowaczyk A., Le Luherne E., Jadaud A., Bigot J.-L., Richard P., 2015, Trophic niche overlap of sprat and commercial small pelagic teleosts in the Gulf of Lions (NW Mediterranean Sea), Journal of Sea Research, 103, 138-146.
Claus C., 1863, Die freilebenden Copepoden mit besonderer Berücksichtigung der Fauna Deutschlands, der Nordsee und des Mittelmeeres, Verlag von Wilhelm Engelmann, Leipzig ,109-110 + Pl. XIV.
Dana J.D., 1853-1855, Crustacea Part II, In : United States Exploring Expedition During the years 1838, 1839, 1840, 1841, 1842 Under the command of Charles Wilkes U. S. N., C. Sherman Printer, Philadelphia. 14, 691-1618 (page 11).
Deniz E., Gönülol A., 2014, Temporal changes of copepod abundance and species compositions in the coastal water of Samsun, the southern Black Sea (Turkey), Journal of the Black Sea/Mediterranean Environment, 20(3), 164˗183.
El-Maghraby A.M., 1964, The developmental stages and occurrence of the copepod Euterpina acutifrons Dana in the marine environment of Alexandria, UAR, Journal of Natural History, 7(76), 223-233.
Giesbrecht W., 1892, Systematik und Faunistik der Pelagischen Copepoden des Golfes von Neapel und der angrenzenden Meeres-Abschnitte, Fauna und Flora des Golfes von Neapel, 19, 555-559, Berlin, R. Friedlander & Sohn.
Guisande C., Sánchez J., Maneiro I., Miranda A., 1996, Trade-off between offspring number and offspring size in the marine copepod Euterpina acutifrons at different food concentrations, Marine Ecology Progress Series, 143, 37-44.
Haq S.M., 1965, Development of the copepod Euterpina acutifrons with special reference to dimorphism in the male, Proceedings of the Zoological Society of London, 144, 175-201.
Haq S.M., 1972, Breeding of Euterpina acutifrons, a harpacticid copepod, with special reference to dimorphic males, Marine Biology, 15, 221-235.
Marinho da Costa R., Fernandez F., 2002, Feeding and survival rates of the copepods Euterpina acutifrons Dana and Acartia grani Sars on the dinoflagellates Alexandrium minutum Balech and Gyrodinium corsicum Paulmier and the Chryptophyta Rhodomonas baltica Karsten, Journal of Experimental Marine Biology and Ecology, 273, 131-142.
Nassogne A., 1970, Influence of food organisms on the development and culture of pelagic copepods, Helgoländer wissenschatfliche Meeresuntersuchungen, 20, 333-345.
Neunes H., Pongolini G.F., 1965, Breeding A Pelagic Copepod, Euterpina acutifrons (Dana), in the Laboratory, Nature, 208, 571–573.
Pouchet G., De Guerne J., 1887, Sur la nourriture de la Sardine, Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences, Paris 104 (10), 712-715.
Razouls C., Desreumaux N., Kouwenberg J., de Bovée F., 2005-2025, Biodiversité des Copépodes planctoniques marins (morphologie, répartition géographique et données biologiques), Sorbonne Université, CNRS
Rose M., 1933, Copépodes pélagiques, Faune de France N°26, Office Central de faunistique, 290p.
Sars G.O., 1921, An Account of the Crustacea of Norway, Volume VII, Copepoda, Supplement with short descriptions and figures of all species, Published by the Bergen Museum, 97-99 + Pl. LXVII.
Sautour B., Castel J., 1993, Feeding behaviour of the coastal copepod Euterpina acutifrons on small particles, Cahiers de Biologie Marine, 34, 239-251.
Stancyk S., Moreir G., 1988, Inheritance of male dimorphism in Brazilian populations of Euterpina acutifrons (Dana) (Copepoda : Harpacticoida), Journal of Experimental Marine Biology, 120,125-144.
Zurlini G., Ferrari I., Nassogne A., 1978, Reproduction and Growth of Euterpina acutifrons (Copepoda:Harpacticoida) under Experimental Conditions, Marine Biology, 46, 59-64.
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.