Couleurs variables : turquoise ou vert à motifs roses, ou brun rouge marbré de gris ou de vert foncé, ou gris pâle
Motifs roses à violacés rayonnant autour de l’œil
Ecailles de grande taille très visibles
Nombreuses dents pointues séparées, le plus souvent visibles
Queue en croissant haut et peu profond, à liseré vertical blanchâtre
Poisson-perroquet vineux
Carolines parrotfish, bucktooth parrotfish, stareye parrotfish, starry-eye parrotfish, wine-stained parrotfish (GB), Loro de Carolinas (E), Pono kasiki (Kenya), Pono (Tanzanie), Papagaio das Carolinas (Mozambique), Christmas parrotfish, kersfees-papegaaivis (Afrique du Sud), Buyos, angol, asul, maming, mulmol, loro, luro, lutiin, aliyakyak, bungalog (Philippines), Limesifelang, tibulangir (Micronésie), Fuga-valea (Samoa), Ponuhuuhu, uhu (Hawaï), Perico de diente verde, pococho perico (Mexique)
Callyodon genistriatus Valenciennes, 1840
Callyodon sandwicensis Valenciennes, 1840
Callyodon carolinus Valenciennes, 1840
Calotomus irradians (Valenciennes, 1840)
Calotomus sandvicensis (Valenciennes, 1840)
Calotomus sandwicensis (Valenciennes, 1840)
Callyodon brachysoma Bleeker, 1861
Leptoscarus brachysoma (Bleeker, 1861)
Calotomus xenodon Gilbert, 1890
Calotomus snyderi Jenkins, 1903
Scarichthys rarotongae Seale, 1906
Cryptotomus albimarginatus Fourmanoir et Guézé, 1961
Indo-Pacifique
Zones DORIS : ● Indo-PacifiqueCalotomus carolinus est présent dans tout l’Indo-Pacifique, d’ouest en est, depuis l’Afrique du Sud, Madagascar et les Mascareignes jusqu'à Hawaï et les îles Pitcairn. Du nord au sud on le trouve des côtes sud du Japon jusqu'aux côtes australiennes, la Nouvelle-Calédonie et les îles Tonga.
Il n’est pas présent en mer Rouge, où il est remplacé par Calotomus viridescens.
Ce poisson-perroquet vit dans les lagons et sur les pentes externes, en zones sableuses, coralliennes mixtes ou détritiques* riches en algues ; il vit à proximité d’herbiers de phanérogames ce qui explique qu’on le trouve le plus souvent à faible profondeur. Il a cependant été signalé jusqu’à 71 mètres.
Le corps est allongé, peu comprimé latéralement, à dos assez élevé et arc ventral prononcé chez les grands individus. Sa hauteur peut entrer de 2,2 à 2,7 fois dans la longueur standard (longueur sans la queue). Il peut dépasser les 70 cm. Les couleurs varient en fonction de la croissance (juvénile, phase initiale, phase terminale), de la sexualité et de l’humeur des individus.
La livrée en phase terminale (mâles) : elle est turquoise ou verte avec une ligne rose au centre de chaque écaille, mais l’ensemble peut devenir en un instant brun rouge avec des écailles teintées de gris, de noirâtre ou de vert foncé, la partie ventrale étant rougeâtre à lie de vin. La couleur peut être aussi gris clair uniforme et ne conserver que les motifs roses pâlis autour de l’œil, ou encore gris clair à beige avec des écailles vert olive éparses. Elle peut encore devenir verdâtre marbré de gris foncé. Chacune de ces couleurs dominantes peut être claire à très foncée. Les taches roses sur les écailles sont généralement conservées dans ces livrées.
La livrée en phase initiale (femelles et mâles primaires) : elle est brun rouille marbrée de gris plus ou moins foncé avec quelques taches roses sur les joues et devant les yeux. Les motifs rayonnant autour de l’œil sont présents, et généralement discrets. La face ventrale est rouge-orange foncé, et le liseré de la nageoire caudale est presque blanc. Les mâles primaires ont les mêmes couleurs que les femelles.
Quel que soit le sexe, les écailles, de grande taille, sont très visibles et peuvent porter des motifs ramifiés clairs ou foncés, selon la teinte du moment. La ligne latérale est interrompue. La partie ventrale est parfois plus claire. On trouve une petite tache noire sur l’anus.
D'autres livrées peuvent encore être rencontrées : livrées de stress, de camouflage diurne, de nuit... (voir § Divers biologie infra).
La tête est haute et forte, la nuque étroite et la largeur au niveau des opercules* nettement plus importante. Il n’y a qu’une seule rangée de 4 ou 5 écailles sur les joues, en position suborbitale (au-dessous de l'orbite de l’œil).
On observe deux paires de narines ; la première est dotée d’un long pavillon orientable.
Le museau est pointu. La bouche est terminale, les deux mâchoires sont directement opposées. Les dents sont nombreuses, pointues et le plus souvent apparentes, elles ne sont pas soudées et se chevauchent sur plusieurs rangs. Des canines coudées vers l’extérieur sont visibles aux commissures des lèvres.
Les yeux sont protubérants, la pupille est entourée d’un anneau doré, l’iris est grisâtre à brun terne. Le globe de l’œil est surmonté d’une tache d’un jaune plus ou moins vif dans le quart supérieur arrière. L’œil lui-même est entouré d’un motif rayonnant de couleur rose à violacée : deux lignes relient sa partie antérieure basse aux commissures des lèvres sur la mâchoire supérieure, quatre lignes courtes, dont certaines peuvent s’achever en forme de Y, ornent sa partie postérieure, et deux autres partent de son sommet pour dessiner des motifs frontaux irréguliers et ramifiés.
Deux motifs transversaux, eux aussi irréguliers et ramifiés, se trouvent en outre entre la lèvre supérieure et les lignes reliant les deux yeux sur le front. Quelques taches éparses de formes différentes marquent le bas des joues, la gorge porte deux courtes bandes roses, et on peut trouver quelques points roses dispersés derrière les opercules. La forme des motifs peut légèrement changer d’un individu à l’autre.
La nageoire dorsale est longue et d’un seul tenant. Celle-ci est, comme la nageoire anale, de la couleur du corps, la dorsale étant ornée d’une tache noire sur les second et troisième rayons, et d’une ligne médiane horizontale de taches roses plus ou moins orangées et le plus souvent séparées. Sa crête est rose orangé à rouille parsemée de petites taches bleues. La nageoire anale peut présenter des lignes identiques plus régulières, mais elle peut aussi n’avoir à sa base que 5 gros motifs roses à orange approximativement triangulaires suivis d’un liseré à taches claires de même couleur, plus ou moins nettes selon les livrées. L’ensemble peut devenir indistinct dans la livrée gris clair.
Pectorales et pelviennes sont de la couleur du corps ornée de taches vertes et roses sur leurs deux premiers tiers, le dernier étant translucide.
La nageoire caudale est arrondie à tronquée chez les juvéniles, puis elle prend la forme d’un croissant haut et peu profond. Chez les grands individus le croissant se creuse et les lobes pointus s’allongent. Sa forme peut aussi devenir discrètement trilobée. Elle est de la couleur du corps avec des barres roses à orange plus ou moins verticales au dessin irrégulier qui peuvent se réduire à des taches, et porte un liseré blanchâtre plus ou moins large.
Les motifs roses qui rayonnent à partir de l’œil ainsi que la dentition, qui est le plus souvent visible, empêchent de confondre Calotomus carolinus avec un autre poisson-perroquet. Sauf pour ce qui concerne trois espèces du même genre Calotomus, qui présentent des caractéristiques proches :
Calotomus viridescens : la livrée en phase terminale présente une surface remplie de nombreuses petites taches brunes allant de l’arrière des joues à la fin du première moitié du corps. Il est endémique* de la mer Rouge, où il « remplace » Calotomus carolinus.
Calotomus spinidens : il est plus petit et plus terne. Le motif autour des yeux se réduit à deux petites barres orange reliant l’œil à la mâchoire inférieure. Il y a une tache noire à la base des pectorales et sa queue est arrondie (en phase terminale). Il peut être confondu avec la livrée en phase initiale de C. carolinus.
Calotomus japonicus : il y a des motifs orangé pâle en lignes plus ou moins parallèles partant d’au-dessus de l’œil et allant jusqu’à la mâchoire supérieure. La partie ventrale et la queue sont le plus souvent orange (phase terminale). Il est endémique du Japon et des côtes sud de la Corée du Sud.
Calotomus carolinus se nourrit de macroalgues benthiques* (notamment du genre Padina) et de plantes marines (notamment des espèces Syringodium isoetifolium et Cymodocea rotundata) ainsi que des organismes et bactéries associés. Il a une façon assez énergique de brouter : le plus souvent, il arrache une touffe d’algues ou d’herbes avec un geste violent de tout le corps qui le place en arc de cercle au-dessus du substrat, tête et queue vers le haut, à la fin de la manœuvre.
L’espèce est hermaphrodite* protogyne* avec mâles primaires (espèce diandrique*). Le pourcentage de mâles primaires est de 4 %, selon une étude réalisée à Hawaï. Les mâles sont sexuellement matures à 20 cm. Ils établissent un territoire destiné à l’accouplement.
La livrée nuptiale est particulière : tant que le mâle patrouille en cercles sur son territoire, son corps est d’un blanc pur sous une ligne qui part de la lèvre supérieure et monte en direction de l’œil, puis devient rectiligne jusqu’au milieu du pédoncule caudal en passant au-dessus des pectorales. Au-dessus de cette ligne on trouve une large bande horizontale noirâtre portant deux séries de points blancs très espacés, elle est coupée à intervalles réguliers par des barres gris clair jaunissant en moitié postérieure. La partie supérieure du dos est jaune verdâtre. Une longue tache gris clair part du museau et s’étend jusqu’à la fin des rayons durs de la dorsale.
Quand une femelle est disposée à pondre, la tête du mâle devient plus claire que son corps et prend une teinte jaune verdâtre, une zone claire s’étend de la nuque à la partie antérieure du dos, le reste du corps étant olivâtre à l’exception du pédoncule et de la caudale, qui blanchissent.
Lorsque deux mâles s’affrontent, les deux tiers supérieurs du corps deviennent gris clair, la partie inférieure restant blanche sous une oblique allant de la lèvre inférieure à l’anus, et le haut de la tête, celui des joues et une zone plus ou moins large autour des pectorales devient jaune. La caudale et le pédoncule blanchissent. Dans chacune des livrées suscitées par le comportement de reproduction, les motifs roses rayonnant autour des yeux s’estompent jusqu’à n’être parfois plus discernables.
La livrée nuptiale disparaît pendant les moments où le mâle va se nourrir. La femelle ne change pas de livrée.
Avant la ponte, le mâle plonge et remonte plusieurs fois et fait des cercles d’un diamètre d’une trentaine de mètres, ou des parcours en forme de 8. Puis il tourne rapidement autour d’une femelle et les deux poissons, au contact l’un de l’autre, montent en accélérant vers la surface pour y émettre leurs gamètes*.
Le couple se sépare immédiatement après la ponte, le mâle restant au même endroit et continuant ses cercles, dans l’attente d’une autre femelle.
La ponte a lieu tôt le matin et ne semble tenir compte ni des marées ni des lunaisons. Elle a lieu en saison chaude avec plusieurs pics. Les œufs sont pélagiques* et de forme sphérique.
Les larves font environ 12 mm quand elles s’installent*. Elles sont transparentes avec des taches claires et foncées réparties sans ordre. Il y a une tache blanche couvrant les deux premiers rayons de la dorsale. Puis le corps prend une teinte gris verdâtre à vert plus ou moins clair, le nombre de taches augmente, on voit apparaître deux rangées de taches claires sur les flancs, situées entre des bandes horizontales blanchâtres souvent peu distinctes, et une rangée souvent plus discrète en haut du dos. La tache blanche sur la dorsale est toujours là. Entre 4 et 7 cm le corps brunit, la tache sur la dorsale disparaît, les taches du corps se dissolvent peu à peu. La livrée de la phase initiale est réalisée autour d’une taille de 8 cm.
Les juvéniles forment des groupes comprenant plusieurs espèces, ces groupes étant le plus souvent cachés dans les herbiers. Tous les juvéniles du groupe, quelle que soit l’espèce, ont alors une couleur dominante verte à brun plus ou moins clair qui leur permet de se confondre avec la base des phanérogames et le substrat, dont ils ne s’éloignent jamais.
Comme la plupart des poissons de récif, il peut être victime d’ectoparasites isopodes de la famille des Gnathiidés.
Calotomus carolinus est considéré comme peu commun. Il est diurne et le plus souvent solitaire. Il est relativement peu farouche.
La livrée de camouflage diurne consiste en une nette augmentation du nombre d’écailles claires et foncées, pendant qu’il se plaque contre le pied d’une roche ou d’un corail et y reste immobile. Quand il est poursuivi, il peut prendre trois ou quatre livrées différentes en quelques secondes.
La livrée de stress : en situation de fuite, on peut le voir devenir gris très clair. Les marques roses des écailles s'estompent, la tête et une zone située derrière les pectorales deviennent jaune pâle. Les motifs rayonnant autour des yeux sont parfois réduits à quelques taches. On peut aussi le voir avec un museau noirâtre, une gorge blanche et une ligne claire sur la médiane des flancs, avec ou sans zonr jaunissante post-operculaire.
La livrée de nuit peut être turquoise ou gris verdâtre à violacé. Les deux couleurs sont marbrées de noir. Les motifs autour des yeux et sur les nageoires deviennent parme. Il dort posé sur le substrat, dans une anfractuosité ou appuyé contre un massif. Ce Scaridé ne semble pas faire de cocon protecteur pour dormir.
Les mâchoires sont armées de trois à huit rangs imbriqués de nombreuses dents incisiformes* non fusionnées. Leur partie supérieure est en forme de dôme. Elles sont réparties sans espacement et se chevauchent parfois, jusqu’à prendre un profil coudé sur l’extérieur. La mâchoire inférieure porte souvent plus de rangs que la mâchoire supérieure. Une à quatre paires de canines coudées vers l’extérieur sont situées sur la mâchoire supérieure et dépassent les lèvres au niveau de chaque commissure. Les dents cassées repoussent aussitôt. On trouve une série de petites dents coniques situées en arrière de la bouche de part et d’autre de chaque mâchoire, ces dents ne sont pas alignées avec les dents incisiformes. Des dents pharyngiennes assurent en outre le broyage des contenus saisis. Ce type de dentition est une spécificité du genre Calotomus.
La nageoire dorsale comporte 9 rayons durs et 10 rayons mous, ses rayons durs sont assez flexibles. L’anale comporte 3 rayons durs et 9 rayons mous. Les nageoires pectorales comportent 11 à 12 rayons mous.
Les pelviennes comportent 1 rayon dur et 5 rayons mous.
On le voit parfois cherchant à se déparasiter de jour en se frottant un flanc sur le substrat. Le geste est très rapide et assez brutal et se fait au cours de la nage.
Il fait partie des herbivores qui jouent un rôle important dans l’équilibre des écosystèmes coralliens : il limite l’établissement et la croissance des algues, ce qui favorise le recrutement* des coraux.
Comme tous les Scaridés, il n’a pas d’estomac, l’œsophage débouche sur l’intestin.
Il y a pour l'heure 5 espèces dans le genre : Calotomus carolinus (Valenciennes, 1840), C. japonicus (Valenciennes, 1840), C. spinidens (Quoy et Gaimard, 1842), C. viridescens (Rüppel, 1835) et C. zonarchus (Jenkins, 1903).
Ils sont mis en danger notamment par la pêche illégale de nuit avec des lampes dans la mesure où leur sommeil est si profond qu’ils peuvent ne pas se réveiller immédiatement quand ils sont pris : ce sont donc des proies faciles qui peuvent être décimées rapidement.
Des fossiles de Scaridés datent du Miocène moyen (environ -14 millions d’années). On trouve des fossiles du genre Calotomus en Europe et jusqu’en Bretagne.
Perroquet : le rapport de ce nom au poisson peut venir des couleurs très vives de certaines espèces, qui évoquent celles de nombreux oiseaux de la famille des Psittacidés (perroquets), et/ou des plaques dentales soudées de la plupart des Scaridés, qui évoquent leur bec.
Des Carolines : les îles Carolines constituent un archipel entre les Philippines et les îles Marshall ; il est constitué de deux Etats, la Micronésie (Etats Fédérés de Micronésie) et les Palaos. Nommées Ilhas Sequeiras par le premier explorateur portugais en 1527, elles sont ensuite appelées Nuevas Filippinas par les Espagnols, puis Islas Carolinas en l’honneur du roi Charles II d’Espagne en 1686 (Charles est la traduction française du latin Carolus).
Calotomus : le genre a été décrit par C. H. Gilbert (ichtyologiste américain, 1859-1928) en 1890, mais ce dernier n’a pas expliqué le choix du nom. Calotomus est composé à partir des mots grecs [kallos] qui signifie « beauté », et [tomê], qui signifie « action de couper, coupure ». Le genre est caractérisé notamment par de nombreuses dents incisiformes* non fusionnées et imbriquées sur des rangs contigus qui confèrent aux espèces concernées une dentition impressionnante. La composition du mot (littéralement « belle coupure ») fait probablement allusion à la capacité qu'a ce poisson-perroquet de sectionner, donc par dérivation à ses dents.
carolinus : mot composé à partir de la latinisation du nom des îles Carolines et signifiant « le Carolinien », donc « des Carolines ».
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Chordata | Chordés | Animaux à l’organisation complexe définie par 3 caractères originaux : tube nerveux dorsal, chorde dorsale, et tube digestif ventral. Il existe 3 grands groupes de Chordés : les Tuniciers, les Céphalocordés et les Vertébrés. |
| Sous-embranchement | Vertebrata | Vertébrés | Chordés possédant une colonne vertébrale et un crâne qui contient la partie antérieure du système nerveux. |
| Super classe | Osteichthyes | Ostéichthyens | Vertébrés à squelette osseux. |
| Classe | Actinopterygii | Actinoptérygiens | Ossification du crâne ou du squelette tout entier. Poissons épineux ou à nageoires rayonnées. |
| Sous-classe | Neopterygii Teleostei | Néoptérygiens Téléostéens | Poissons à arêtes osseuses, présence d’un opercule, écailles minces et imbriquées. |
| Super ordre | Acanthopterygii | Acanthoptérygiens | Rayons épineux aux nageoires, écailles cycloïdes ou cténoïdes, présence d'une vessie gazeuse et pelviennes thoraciques ou jugulaires, sans être systématiquement présents, sont des caractères que l'on ne rencontre que chez les Acanthoptérygiens. |
| Ordre | Perciformes | Perciformes | Nageoires pelviennes très rapprochées des nageoires pectorales. |
| Sous-ordre | Labroidei | Labroïdes | Une seule dorsale, dents molariformes formant un puissant appareil masticatoire. |
| Famille | Scaridae | Scaridés | Une seule nageoire dorsale, dents soudées formant un puissant "bec de perroquet". |
| Genre | Calotomus | ||
| Espèce | carolinus |
 Poissons osseux nageant près du fond
Poissons osseux nageant près du fond

Puissant et nerveux
Calotomus carolinus est un poisson-perroquet à la morphologie puissante et ses comportements sont très généralement empreints de la vigueur qu’il en hérite. On voit ici un mâle (phase terminale) en livrée bleue.
Lagon de l'Ermitage, La Réunion, 1,5 m
25/02/2012
 Poissons osseux nageant près du fond
Poissons osseux nageant près du fond

Portrait
Ce poisson-perroquet s’habitue assez vite à l’observateur qui le suit calmement. Il le laisse alors approcher et le regarde droit dans les yeux de temps en temps, plus intrigué qu’ennuyé, semble-t-il. On peut alors constater l’aspect triangulaire de sa tête vue de face, avec une nuque étroite et des joues épaisses.
Lagon de l'Ermitage, La Réunion, 1,5 m
25/02/2012


Livrée en phase initiale (femelles et mâles primaires)
La livrée en phase initiale est brun rouge avec une face ventrale plus claire qui peut prendre une tonalité orange. Cette livrée est aussi celle des mâles primaires. On voit bien ici les larges écailles caractéristiques du genre Calotomus.
Lagon de l'Ermitage, La Réunion, 1,5 m
08/06/2011


Livrée bronze
La livrée est ici verdâtre à bronze avec des écailles plus claires et plus foncées à la répartition irrégulière. Ces variations de couleurs de certaines écailles peuvent apparaître sur toutes les livrées.
Lagon de l'Ermitage, La Réunion, 1,5 m
11/06/2011


Livrée de stress 2
Ce jeune mâle présente un autre aspect de la livrée de stress, qui rappelle, comme c’est souvent le cas, des éléments de la livrée nuptiale : une gorge blanche, une ligne claire sur la médiane des flancs et deux séries de points blancs au-dessus de cette ligne. Cet individu avait la zone post-operculaire jaune quelques instants avant la photo
Lagon de l'Ermitage
03/04/2013


Livrée de stress 1
Quand il fuit un poursuivant ce poisson prend souvent une couleur très claire avec un jaunissement de la tête et de la zone post-operculaire, les motifs roses s’estompant. Cette variation lui permet d’être moins discernable dans le décor ambiant et donc de protéger sa fuite.
La Réunion, 1,5 m
28/01/2012


Livrée de camouflage
Quand il est poursuivi, Calotomus carolinus peut interrompre sa fuite en se cachant derrière une roche ou un massif de corail. Il se plaque alors contre son abri, posé sur le substrat, de grandes marbrures noirâtres s’ajoutant à sa livrée. Il ne quittera cette position qu’en voyant qu’il est à nouveau repéré par son poursuivant.
N'gouja, Mayotte, 1 m
17/09/2010


Livrées nocturnes
On peut trouver ce poisson-perroquet arborant la nuit ses diverses livrées diurnes, mais elles sont alors caractérisées par des marbrures noirâtres plus foncées que le jour, par une augmentation du nombre des écailles claires et par l’extrémité de la queue noire. Les motifs roses de la tête deviennent parme.
Lagon de l'Ermitage, La Réunion, 1,5 m
2011


Juvéniles
Les juvéniles des Scaridés sont en général très difficiles à identifier. Ce groupe, caché dans un herbier, contient des juvéniles de plusieurs espèces, dont au moins un Calotomus carolinus, bien visible (flèche) : sa livrée est gris vert avec des bandes et des taches blanches disposées horizontalement et une marque blanche sur les deux premiers rayons de la nageoire dorsale.
Lagon de l'Ermitage, La Réunion, 1,5 m
08/06/2011


Juvénile
La couleur de ce juvénile, un peu plus vieux que le précédent (environ 5 cm) et dont la livrée a déjà changé, est parfaitement adaptée à celle de l’herbier dans lequel il se camoufle. On peut observer que la tache marquant l’avant de la dorsale n’a pas encore complètement disparu.
Le petit poisson vert vif au premier plan est un juvénile de Sthetojulis albovittata, sa livrée est celle que les jeunes de l’espèce arborent dans les herbiers.
Lagon de l'Ermitage, La Réunion, 1,5 m
25/07/2012


Dans les phanérogames
Malgré le sens du nom latin du genre (voir Origine du nom scientifique), Calotomus carolinus ne cherche pas à couper les algues ou herbes marines dont il se nourrit. Il les arrache d’un geste brutal de la tête de façon à les avoir entières.
On le voit ici dans un herbier monospécifique de Syringodium isoetifolium, en train de se saisir de deux feuilles sans se servir de ses incisives, de façon à pouvoir les arracher.
Lagon de l'Ermitage, La Réunion, 1,5 m
25/02/2012


Algues filamenteuses
Les incisives se saisissent ici sans la couper d’une touffe d’algues filamenteuses qui sera elle aussi arrachée entièrement et mangée un peu plus loin en nageant.
Lagon de l'Ermitage, La Réunion, 1,5 m
25/02/2012


Dentition
Cet individu, mort depuis peu quand il a été trouvé, a permis ce gros plan de la dentition impressionnante de Calotomus carolinus. On peut observer les rangs d’incisives qui se chevauchent et les canines coudées sur la mâchoire supérieure. On voit aussi les petites dents plantées sur l’intérieur de l’os maxillaire, qui servent notamment à l’arrachage des herbes marines.
Lagon de l'Ermitage, La Réunion, 1,5 m
10/03/2012
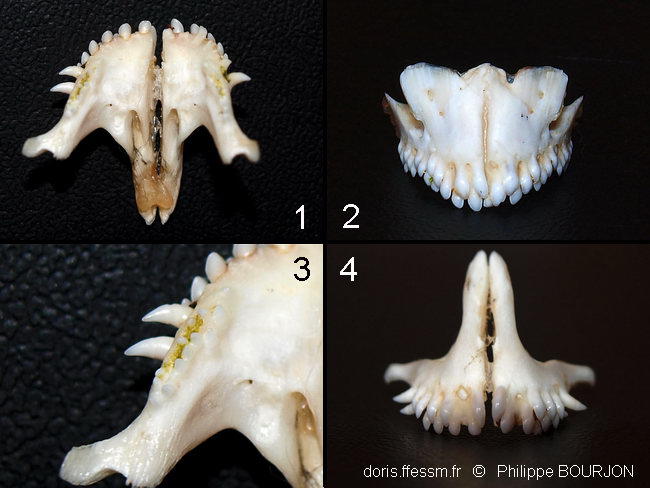
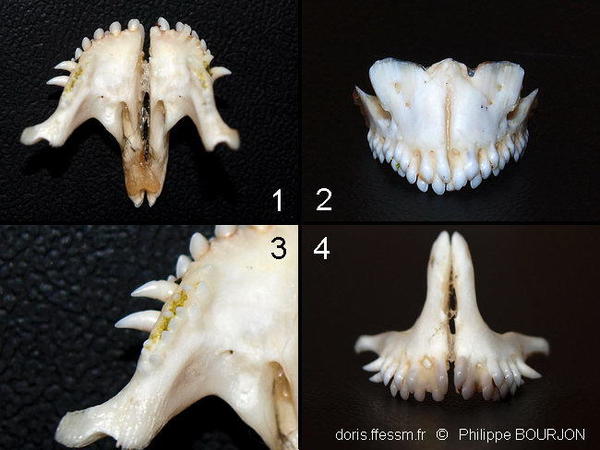
Mandibules
1) Vue interne de la mâchoire supérieure : on voit le premier rang d’incisives et les canines coudées vers l’extérieur. Il manque une canine à droite, mais les dents repoussent continuellement.
2) Vue externe de la mandibule inférieure : on voit les rangs superposés des incisives, le dernier poussant par-dessus les précédents.
3) Cette vue rapprochée de l’intérieur de la mâchoire supérieure permet de distinguer les petites dents situées sur l’os au niveau des dernières incisives et des canines. Les espaces entre ces dents portent encore des traces des phanérogames qu’elles ont arrachées, puis broyées.
4) Vue externe de la mâchoire supérieure : on peut voir des dents repousser dans les alvéoles de celles qui ont été cassées.
photo-montage ex-situ, La Réunion
03/2012


Energique en toutes choses
Calotomus carolinus est énergique en toutes choses, y compris quand il défèque !
Lagon de l'Ermitage, La Réunion, 1,5 m
25/02/2012
Rédacteur principal : Philippe BOURJON
Vérificateur : Alain-Pierre SITTLER
Responsable régional : Alain-Pierre SITTLER
Bellwood D. R., 1994, A phylogenetic study of parrotfishes Family Scaridae (pisces : Labroidei), with a revision of genera, Records of the Australian Museum, 20, 1-86
Bellwood D. R., Choat J.H., 1989, A description of the juvenile phase colour patterns of 24 parrotfish species (family Scaridae) from the Great Barrier Reef, Australia, Records of the Australian Museum,41(1), 1-41.
Bellwood D. R., Schultz O., 1991, A Review of the Fossil Record of the Parrotfishes (Labroidei: Scaridae) with a Description of a New Calotomus Species from the Middle Miocene (Badenian) of Austria, Annalen des Naturhistorischen Museums in Vien, 92-A, 55-71.
Byrne J. E., 1970, Mucous Envelope Formation in Two Species of Hawaiian Parrotfishes (Genus Scarus), Pacific Science, 24, 490-492.
Cerny-Chipman E., 2007, Distribution of ultraviolet-absorbing sunscreen compounds across the body surface of two species of Scaridae, ISP Collection. Paper 147.
Curan M. C., 1992, The Behavioral Physiology of Labroid Fishes, Doctoral dissertation, The Massachusetts Institute of Technology, 13-21.
Green A. L., Bellwood D. R., 2009, Monitoring functional groups of herbivorous reef fishes as indicators of coral reef resilience - A practical guide for coral reef managers in the Asia Pacific region, IUCN working group on Climate Change and Coral Reefs IUCN, Switzerland, 70.
Grutter A. S., Rumney J. G., Sinclair-Taylor T., Waldie P., Franklin C. E., 2010, Fish mucous cocoons: the 'mosquito nets' of the sea, Biology letters, The Royal Society, 1-3.
Kuwamura T., Sagawa T., Suzuki S., 2008, Interspecific variation in spawning time and male mating tactics of the parrotfishes of a fringing coral reef at Iriomote Island, Okinawa, The Ichthyological society of Japan, Ichthyological Research, 56(4), 354-362.
Mariani S., Alcoverro T., 1999, A multiple-choice feeding-preference experiment utilising seagrasses with a natural population of herbivorous fishes, Marine Ecology Progress Series, 189, 295-299.
Robertson D. R., Reinboth R., Bruce R. W., 1982, Gonochorism, protogynous sex-change ans spawning in three sparosomatinine parrotfishes from the western Indian ocean, Bulletin of Marine Science, 32(4), 868-879.
Shantz A. A., Stier A.C., Idjadi J. A., 2010, Coral density and predation affect growth of a reef-building coral, Coral Reefs, Springer, 30(2) 363-365.
Streelman J. T., Alfaro M., Westneat M. W., Bellwood D. R., Karl S. A, 2002, Evolutionary history of the parrotfishes : biogeography, ecomorphology and comparative diversity, Evolution, 56(5), 961-971.
Videler H., Geertjes G. J., Videler J. J., 1999, Biochemical characteristics and antibiotic properties of the mucous envelope of the queen parrotfish, Journal of fish biology, 54, 1124-1127.
La page de Calotomus carolinus sur le site de référence de DORIS pour les poissons : FishBase
La page de Calotomus carolinus dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.