Zone de couleur jaunâtre à brunâtre à la surface des sédiments sur tout type de substrat
Faible épaisseur
La détermination des diatomées est une affaire de spécialistes, elle repose généralement sur l’observation du frustule (forme et décoration)
Les biofilms de diatomées* peuvent être observés dans le monde entier, à la fois en eau douce et en eau salée.
Tout substrat* en milieu marin, en zone intertidale* ou subtidale*.
Les biofilms de diatomées* se présentent sous la forme d’une zone de couleur jaunâtre à brunâtre très caractéristique à la surface des sédiments, sur les organismes benthiques* ou sur tout support rigide. Les zones concernées ont généralement une surface limitée (quelques décimètres carrés, notamment sur les substrats* sableux), mais peuvent parfois atteindre des surfaces conséquentes (mais de faible épaisseur) sur les zones vaseuses.
Les diatomées (Bacillariophycés, Chromophytes) sont des algues brunes unicellulaires microscopiques, qui présentent la particularité de posséder un squelette « externe » siliceux (il est en fait inclus dans une matrice organique). Ce squelette, le frustule*, est constitué de deux parties emboîtées, à l’image d’une boîte à camembert. La partie la plus grande s’appelle l’épithèque (le couvercle de la boîte) et la partie la plus petite, qui vient s’emboîter dans l’épithèque, s’appelle l’hypothèque (le bas de la boîte). Le frustule est finement orné (dents, stries, ponctuations, excroissances diverses, pores, etc.), chaque espèce ayant sa propre ornementation.
Les diatomées peuvent être solitaires ou former des colonies.
Il existe deux types de géométries chez les diatomées : certaines possèdent une symétrie radiale (elles sont rondes ou ovales vues de dessus, on parle alors de vue valvaire) ; ce sont des diatomées centriques. Les autres ont une forme plus allongée avec une symétrie bilatérale, ce sont des diatomées pennées. Les diatomées centriques sont très majoritairement des diatomées planctoniques*, tandis que les diatomées pennées peuvent être benthiques ou planctoniques. Certaines diatomées pennées présentent une fente longitudinale ouverte sur le milieu extérieur, le raphé*, que l’on peut entrevoir en microscopie optique sur des individus frais (on le voit nettement mieux sur des individus préparés pour la détermination). Le raphé sert notamment à exsuder du mucilage*. Le mucilage est notamment utilisé pour l’adhésion au substrat, particulièrement efficace, mais également pour le déplacement des individus, assez spectaculaire au microscope. Chez les diatomées pennées benthiques, l’hypothèque est en contact avec le substrat.
S’il est en général assez facile de rattacher une algue observée au microscope au groupe des diatomées, la détermination des diatomées reste une affaire de spécialiste. Cette détermination repose généralement sur l’observation du frustule (forme et décoration). Pour mener à bien cette observation, il est nécessaire de débarrasser le frustule de sa matière organique, ce qui est réalisé en ajoutant de l’eau oxygénée au prélèvement, puis supprimer d’éventuelles traces de carbonates (ajout d’acide chlorhydrique). On peut également réaliser un nettoyage plus sommaire à l’aide d’eau de javel relativement concentrée.
Il est en général nécessaire de centrifuger les échantillons pour maintenir les frustules dans un petit volume et procéder à leur rinçage (sinon on perd une grosse partie des échantillons à chaque rinçage).
Les espèces les plus courantes dans les biofilms maritimes appartiennent aux genres Navicula, Amphora, Nitzschia, Pleurosigma et Thalassionema.
Les diatomées* sont des algues autotrophes*, se nourrissant grâce à la photosynthèse*. Il existe cependant des diatomées hétérotrophes*, qui peuvent vivre en zone aphotique* (on rencontre ainsi des diatomées dans les grands fonds marins). Plusieurs espèces constituant des biofilms sur des sédiments vaseux sont capables de s’associer avec des bactéries lorsqu’elles sont enfouies dans la vase à marée haute. Ces diatomées sont autotrophes lorsqu’elles sont exposées à la lumière (à marée basse), et hétérotrophes lorsqu’elles sont enfouies dans le sédiment.
La multiplication végétative des diatomées* est principalement assurée par division cellulaire, selon un mode très original : après une mitose*, les deux valves de l’algue se séparent. Chaque cellule fille conserve une valve de la cellule mère et en sécrète une seconde (hypothèque), automatiquement plus petite que la première. Chaque cycle de reproduction donne donc naissance à deux individus, l’un de taille similaire à l’individu parent, l’autre plus petit.
Il existe une taille minimale au-delà de laquelle s’engage une reproduction sexuée. Cette taille minimale varie selon les espèces.
Pour la reproduction sexuée, les gamètes* mâles et femelles (généralement produits par deux individus différents) sont générés par méïose. Le mode de reproduction varie ensuite entre les diatomées centriques et les diatomées pennées. Chez les diatomées centriques, les gamètes mâles sont munis d’un flagelle* qui leur permet de rejoindre la diatomée femelle, dans laquelle ils pénètrent grâce à une ouverture produite dans le frustule entre les deux valves. Chez les diatomées pennées, les gamètes mâles ne sont pas munis de flagelle. La fécondation débute donc par un rapprochement des deux diatomées candidates à la reproduction, qui s’englobent dans du mucilage*. Les gamètes mâles et les gamètes femelles se rencontrent selon des mécanismes complexes et variables selon les familles. La fusion des gamètes mâles et femelles donne naissance à un œuf, appelé auxospore*. L’auxospore s’entoure d’un abondant mucilage puis grossit jusqu’à atteindre la taille d’une diatomée normale, avant de sécréter son frustule* siliceux.
Les auxospores peuvent également être utilisées par les diatomées pour engager une phase dormante, lorsque les conditions ambiantes deviennent défavorables.
Lorsque les conditions (lumière et nutriments) sont satisfaisantes, les diatomées se reproduisent environ toutes les 24 heures.
Les diatomées* peuvent parfois former une association étroite avec les bactéries qui vivent dans le mucilage* et les accompagnent. Les relations ainsi construites sont complexes, certaines diatomées ayant tendance à voir leur croissance réduite en présence de bactéries alors que la croissance d’autres diatomées est nettement accélérée dans ce contexte.
Cet assemblage complexe entre diatomées et bactéries est à l’origine de la très forte productivité des vases estuariennes qui pourraient pourtant sembler désertes à première vue.
Les diatomées* pennées sont capables de se déplacer, selon une trajectoire variable (parfois en faisant des demi-tours, les diatomées n’ayant ni avant ni arrière dans leurs déplacements). Ce déplacement est parfaitement visible lors d’une observation au microscope (et assez impressionnant quand on pense qu’il s’agit d’une algue unicellulaire…). Bien que le mécanisme ne soit pas parfaitement élucidé aujourd’hui, on sait que le déplacement est induit par une production du mucilage* à travers le raphé* (les espèces sans raphé sont donc immobiles).
D’une manière générale, les diatomées benthiques* constituant un biofilm s’enfouissent dans le sédiment à marée haute. Elles remontent à la surface du sédiment lorsque le substrat est émergé.
Les diatomées* benthiques* sont très largement utilisées pour évaluer la qualité des eaux douces en raison de leur sensibilité aux pollutions organiques, azotées et phosphorées et de la rapidité de leur développement. Une méthodologie spécifique, l’indice biologique diatomique (IBD), a été développée en France continentale dans les années 90 et fait l’objet d’une norme Afnor (NF-T 90-354). Des indices diatomiques spécifiques ont été développés, pour les besoins de la mise en œuvre de la directive cadre sur l’eau, pour les départements et territoires d’outre-mer : indice diatomique antillais (IDA), indice diatomique Réunion (IDR), indice diatomique Mayotte espèces (IMSp).
Il n’existe pas à ce jour d’outil équivalent pour le milieu marin ou les milieux saumâtres.
Les diatomées produiraient entre 20 et 50 % de l’oxygène terrestre chaque année. Elles constituent environ la moitié de la matière organique contenue dans les océans.
Les diatomées centriques appartiennent à l'ordre des Biddulphiales et les diatomées pennées à l'ordre des Bacillariales.
Le mot diatomée* provient du grec ancien [diatomos], qui signifie littéralement « coupé en deux ». Il s’agit d’une allusion directe à la morphologie de ces algues, dont le frustule comporte deux valves reliées entre elles.
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Ochrophyta | Ochrophytes | ou Hétérokontes, ou Straménopiles: présence d'un stade unicellulaire à 2 flagelles, un lisse et un à poils tubulaires. |
| Classe | Bacillariophyceae | Bacillariophycées | |
| Genre | Biofilms de diatomées | ||
| Espèce |
 Diatomées et autre phytoplancton
Diatomées et autre phytoplancton

Vue d'ensemble d'un biofilm de diatomées
La couleur brune est bien visible
Estran, photographie in-situ, Pointe de la Rognouse, Binic-Etables-sur-mer (22)
05/02/2022
 Diatomées et autre phytoplancton
Diatomées et autre phytoplancton

Vue d’un biofilm de diatomées sur une slikke estuarienne
Le biofilm se développe ici
préférentiellement à proximité du schorre*.
Estran, photographie in-situ, Toul-an-Herry-Estuaire du Douron, Plestin-les-grèves (22)
25/02/2022


Au microscope
Le biofilm de la première photographie était composé majoritairement d’une espèce de diatomée pennée à l’allure très particulière, Climaconeis inflexa, qui n’est pas l’espèce la plus courante dans les biofilms. Ceci est peut-être lié au fait que ce biofilm était positionné sur une paroi verticale, sous une colonie sauvage de Magallana gigas.
Photographie ex-situ au microscope (x400), Binic-Etables-sur-mer (22)
05/02/2022
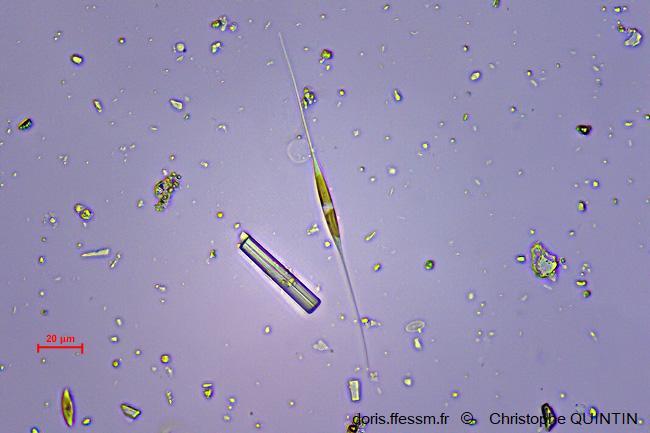
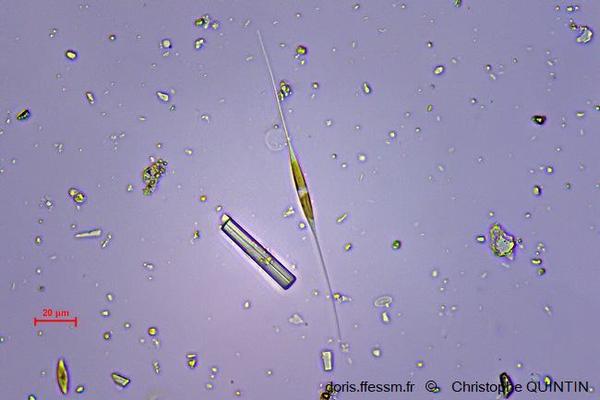
Au microscope, Nitzschia longissima
L'observation permet de repérer rapidement différentes diatomées benthiques dans le biofilm. Il s’agit ici de Nitzschia longissima, à l’allure très particulière.
Photographie ex-situ au microscope (x400), Binic-Etables-sur-mer (22)
05/02/2022
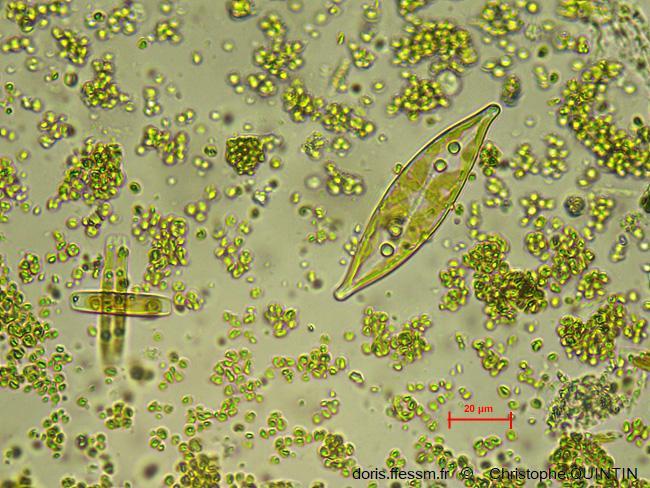
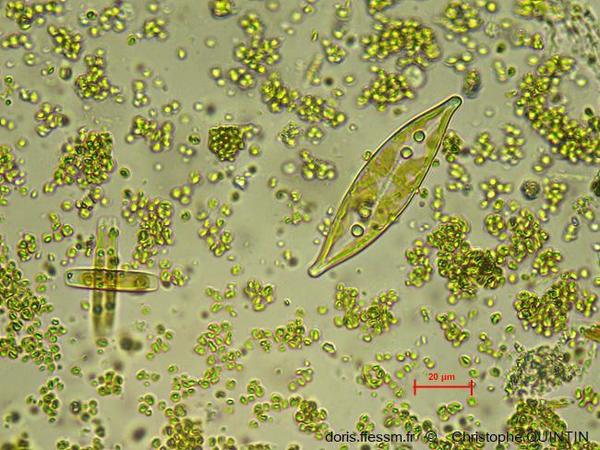
Au microscope, Pleurosigma.sp.
La plus grande cellule visible ici appartient au genre Pleurosigma. Elle n'a pas été trouvée sur le biofilm mais en épiphyte d’une algue Codium tomentosum. On distingue très bien le raphé*, sous forme d’une ligne claire.
Photographie ex-situ au microscope (x400), Binic-Etables-sur-mer (22)
05/02/2022
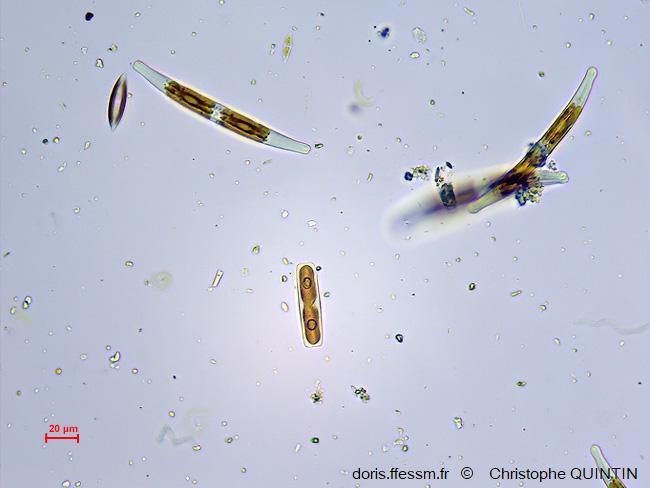
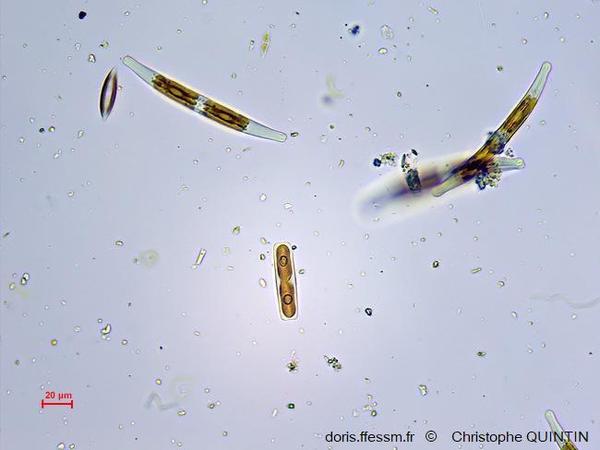
Au microscope
On aperçoit ici deux autres espèces de diatomées. L’individu au centre de la photo est en cours de division.
Photographie ex-situ au microscope (x400), Binic-Etables-sur-mer (22)
05/02/2022
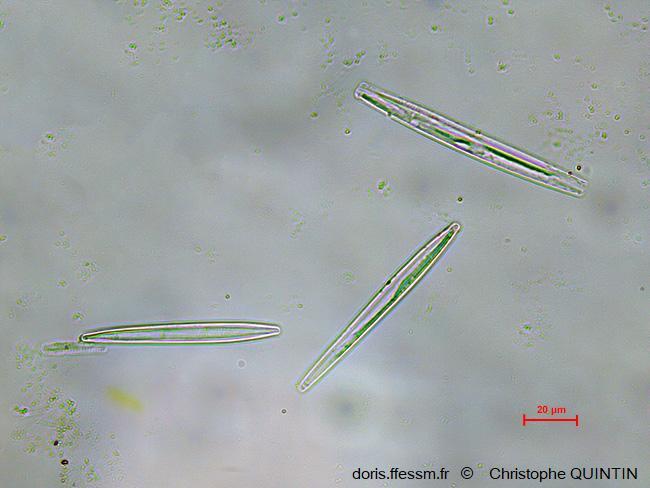
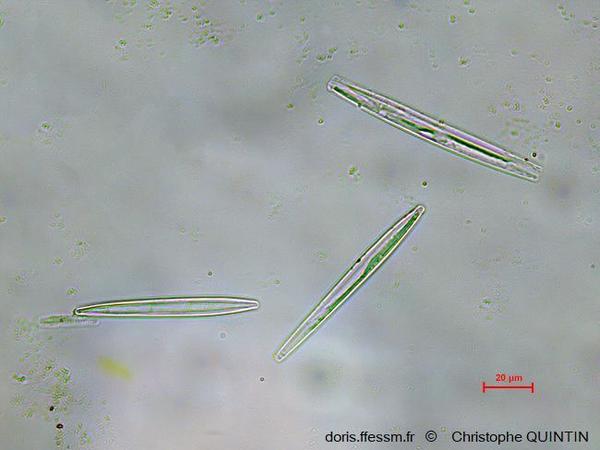
Au microscope, après nettoyage
On aperçoit ici trois frustules appartenant peut-être au genre Synedra, collectées dans un biofilm. Les frustules ont fait l’objet d’un traitement à l’eau de javel pour les nettoyer en détruisant la matière organique.
Photographie ex-situ au microscope (x400), Binic-Etables-sur-mer (22)
19/02/2022


Au microscope, Nitzschia
Il s’agit ici d’un individu appartenant au genre Nitzschia, l’un des plus courants dans les biofilms de diatomées. Le raphé* est bien visible, sous forme d’une ligne claire longitudinale, mais pas l’ornementation, constituée de très fines stries transversales.
Photographie ex-situ au microscope (x400), Cale de mise à l’eau de l’avant-port - Binic-Etables-sur-mer (22)
29/02/2022
Rédacteur principal : Christophe QUINTIN
Correcteur : Marc VERLAQUE
Responsable régional : Yves MÜLLER
Admiraal Wim, et al., 1984, The Seasonal Succession Patterns of Diatom Species on an Intertidal Mudflat: An Experimental Analysis, Oikos, 42(1), 30–40.
Amin S. A., Parker M. S., Armbrust E. V., 2012, Interactions between diatoms and bacteria. Microbiology and Molecular Biology Reviews, 76, 667–684.
Callame B., Debyser J., 1954, Observations sur les mouvements des diatomées à la surface des sediments marins de la zone intercotidale, Vie et Milieu, Observatoire Océanologique - Laboratoire Arago, 5(2), 43-249.
Herlory O., 2005, Etude du biofilm microalgal des vasières intertidales: dynamique spatio-temporelle à micro-échelle et performances photosynthétiques, Université de La Rochelle. Thèse de 3ème cycle.
1991, Diatomées d’une vasière intertidale du nord Finistère (Dourduff): genres Cocconeis, Campyloneis, Delphineis, Mastogloia et Rhaponeis, Diatom Research, 6(1), 125-135.
Cirri E., Vyverman W., Pohnert G., 2018, Biofilm interactions—bacteria modulate sexual reproduction success of the diatom Seminavis robusta, FEMS Microbiology & Ecology 94.
Koedooder C., Stock W., Willems A., Mangelinckx S., De Troch M., Vyverman W., Sabbe K., 2019, Diatom-Bacteria Interactions Modulate the Composition and Productivity of Benthic Diatom Biofilms. Frontiers in Microbiology, 10(1255), 1-11.
MacIntyre H. L., Geider R. J., Miller, D. C., 1996, Microphytobenthos: the ecological role of the “secret garden” of unvegetated, shallow-water marine habitats. I. Distribution, abundance and primary production, Estuaries, 19, 186.
Patil J.S., Anil A.C., 2005, Biofilm diatom community structure: influence of temporal and substratum variability, Biofouling, 21(3-4), 189-206.
Prygiel J., Coste M., 1993, Utilisation des indices diatomiques pour la mesure de la qualité des eaux du bassin Artois-Picardie: bilan et perspectives, Annalesde Limnologie, 29 (3-4), 255-267.
Tagliarolo M., 2012, Adaptations métaboliques des organismes dans la zone de balancement des
marées. Implications sur la biodiversité locale dans un contexte de changement climatique, Biodiversité et Ecologie, Université de Bretagne occidentale, 170p.
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.