4 gonades en fer à cheval
Diamètre compris entre 5 et 40 cm
Grand nombre de fins tentacules marginaux
4 bras buccaux
Méduse lune, méduse commune, méduse bleue, le trèfle
Moon jelly, common jellyfish (GB), Medusa
quadrifoglio, pota marina (I), Medusa aurelia, aurelia, medusa sombrilla, medusa
platillo, medusa luna, medusa comùn (E), Ohrenqualle (pour toutes les aurélies)
(D), Oorkwal, geoorde zeekwal (NL), Medusa aurelia, medusa-da-lua (P),
Glassmanet (Norvège)
Très nombreux noms d'espèces.
Aurellia : ancien nom de genre donné par Péron et Lesueur en 1810.
Cosmopolite
Zones DORIS : ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ● Atlantique Nord-Ouest, ● Europe (côtes françaises), ○ [Méditerranée française], ● Indo-PacifiqueLes aurélies sont cosmopolites.
Elles sont présentes dans l’océan Atlantique Nord-Ouest, Nord-Est, en mer du Nord (en Zélande dans le Grevelingen et dans la Verse Meer) et en Baltique. Elles sont présentes en Méditerranée et en mer Noire. Elles sont également présentes dans le golfe du Mexique et sur la côte pacifique des Etats-Unis d’Amérique, ainsi qu’à l’ouest de l’océan Pacifique, Vladivostok (Russie), Japon, Taïwan, Corée, ouest de l’Australie.
La méduse adulte est pélagique*, on la rencontre à de faibles profondeurs (inférieures à 20 m).
La phase polype* se rencontre le plus souvent en milieu saumâtre : estuaire, lagune ou zone portuaire, principalement sous de petits surplombs ou sur des coquilles de moules et d'huîtres.
Il existe plusieurs espèces que l'on ne peut pas différencier avec des critères morphologiques. La génétique du genre est très complexe.
Cette méduse présente une allure générale de soucoupe laissant voir par transparence quatre gonades* en forme de fer à cheval (ou en forme de feuilles de trèfles) (parfois plus : voir la rubrique « divers biologie »).
L'ombrelle*, qui peut mesurer jusqu'à 40 cm de diamètre, est très convexe. Elle porte 8 larges lobes* marginaux simples et elle est bordée d'un grand nombre de fins tentacules* marginaux (jusqu'à 1200 !) plus ou moins longs, blancs, filamenteux et urticants.
La bouche ventrale quadrangulaire à l’extrémité du manubrium* est entourée par quatre bras buccaux (ou oraux) plus ou moins développés et visibles. Ces bras sont très festonnés* et leur face interne est creusée d'une gouttière alimentaire. On remarque des canaux radiaires, certains sont rectilignes, d'autres sont divisés. Un canal marginal circulaire parcourt la périphérie de l'ombrelle.
Les gonades* sont le plus souvent de teinte blanche ou jaune chez les mâles et de teinte rose ou violacée chez les femelles, permettant la reconnaissance des sexes.
La couleur des jeunes méduses, nommées éphyrules (ou éphyres), varie du blanc translucide au rose translucide en passant par le brun rougeâtre. Elles mesurent quelques millimètres de diamètre et ont, normalement, 8 lobes échancrés en leur milieu, au fond de chaque échancrure il y a une rhopalie*.
Les polypes* ou scyphistomes*, de quelques mm de haut, sont souvent blancs, coniques et attachés au substrat* par leur base. Ils portent à l’autre extrémité un anneau de 15 à 22 tentacules entourant leur bouche unique.
Le genre Aurelia est caractérisé par une grande plasticité écologique et, par conséquent, par un statut taxonomique incertain. Ce genre a été révisé à plusieurs reprises au cours du siècle dernier, divisant en 12 espèces le genre Aurelia (voire plus encore) ou seulement deux espèces.
Les différences morphologiques entre les différentes espèces d’aurélies sont difficiles à observer.
Selon Russell (1970), les différences permettant de reconnaître les espèces ou les variétés sont les suivantes :
La distribution géographique peut aider pour reconnaître les espèces observées en Méditerranée.
Aurelia aurita (Linnaeus, 1758) : il s’agit de la première espèce d’aurélie décrite. Cette espèce semblait être endémique* de l’Atlantique Nord-Est. Toutefois c’est ce nom d’espèce qui est en général attribué faute de précisions (moléculaires). Sa morphologie est très proche de A. coerulea. Ces bras buccaux seraient moins larges.
Aurelia coerulea von Lendenfeld, 1884 : en Méditerranée, les aurélies rencontrées dans les ports et les lagunes côtières d’Espagne, de France (étang de Thau, Fos sur mer, étang de Berre) et également en Italie (en mer Tyrrhénienne et en mer Adriatique) sont des Aurelia coerulea. L’ombrelle de A. coerulea est très plate et environ cinq fois plus large que haute. Elle peut mesurer 11 cm (jusqu’à 21 cm) de diamètre pour 2 à 3 cm d’épaisseur. Les bras buccaux repliés sont très larges (plus larges que ceux d’A. aurita), un peu plus longs que le bord de l’ombrelle et faiblement crénelés. Ils sont arrondis à leur extrémité. Les petits tentacules* blanchâtres sont disposés légèrement au-dessus du bord de l’ombrelle.
La couleur de cette méduse transparente est bleue. Seules les gonades* réfléchissent la lumière.
Les exigences spécifiques en température et salinité sont incomplètement connues pour cette espèce. En raison de sa présence limitée dans les lagunes côtières méditerranéennes, cette espèce serait euryhaline* et eurytherme*.
En dehors de la Méditerranée, cette espèce a pu être observée dans d’autres secteurs géographiques, très éloignés. Sur les côtes européennes, en Manche et mer du Nord, elle a été observée à Saint-Malo (22), à Zeebruge (Belgique) et dans la Verse Meer (Zélande, Pays-Bas). Elle a été également trouvée à Taïwan, en Corée, au Japon, à Vladivostok (Russie), dans l’ouest de l’Australie, sur la côte pacifique des Etats-Unis d'Amérique et dans le golfe du Mexique.
Au sein du genre Aurelia, A. coerulea est l’espèce dont la répartition mondiale est la plus large.
Aurelia solida Browne, 1905 : l’ombrelle en forme de disque est ronde, épaisse et mesure jusqu’à 24 cm de diamètre. La marge de l’ombrelle est de couleur saumon-violet clair. De nombreux petits tentacules sont disposés légèrement au-dessus du bord de l’ombrelle. Elle provient de l’océan Indien par le canal de Suez (espèce lessepsienne*) par l’intermédiaire du commerce maritime. Elle a été observée en mer Ionienne, en Tunisie (baie de Bizerte), dans le nord de l’Adriatique et en Méditerranée occidentale (entre autres à Cannes).
Aurelia relicta Scorrano, Aglieri, Boero, Dawson & Piraino, 2016 : cette espèce est présente uniquement dans le lac marin de Veliko Jezero (île Mljet, Croatie, mer Adriatique). Cette espèce présente la plus petite distribution connue pour ce genre.
Et il existe d’autres
espèces : A. colpota, A. labiata, A. limbata, A. dubia, A. clausa, A. hyalina,
A. japonica, et des espèces non décrites comme sp.1,sp.2, sp.3, sp.4, sp.5.
Comme chez les autres cnidaires, la bouche, unique orifice digestif, sert aussi d'anus.
Une jeune Aurelia aurita de 5 cm de diamètre avale près de 10 larves de poissons en une heure.
Ensuite quand la taille devient plus importante, la méduse change de régime alimentaire (Goy, 1997).
Les aurélies adultes sont microphages* suspensivores*. Elles piègent le zooplancton* dans le mucus présent sur et sous l’ombrelle ou avec leurs fins tentacules*, couverts de nématocystes*, qui immobilisent de petits organismes du plancton* comme des copépodes*, des larves* d’invertébrés, des protozoaires* ciliés*. Les proies, enveloppées de mucus sont conduites, par des mouvements ciliaires centrifuges, vers le bord de l’ombrelle puis vers les lobes oraux et la bouche.
On remarque, partant de l'estomac, des canaux radiaires. Certains sont rectilignes, ils transportent de manière centrifuge les produits de la digestion. D'autres sont divisés, dans ceux-là les produits d'excrétion sont transportés de manière centripète, c'est-à-dire vers la bouche, pour être évacués.
Le polype* se nourrit de zooplancton* grâce à ses tentacules portant également des nématocystes et également par des mouvements ciliaires sur tout le corps. L’alimentation cesse pendant la strobilation* (cf la rubrique “reproduction”).
L’éphyrule, la petite méduse qui est produite par le scyphopolype* se nourrit de la même façon que ce dernier.
Les sexes sont séparés chez ces méduses. Les méduses mâles libèrent dans le milieu ambiant leurs spermatozoïdes*. La rencontre des spermatozoïdes et des ovules* s’effectue dans les gonades* de la femelle et les œufs rejoignent des poches incubatrices situées sur les bras buccaux. Le moment de cette rencontre peut varier d’une zone géographique à une autre, en fonction des conditions environnementales.
L’incubation, de quelques jours, conduit à la libération de larves* planulas* planctoniques* lécithotrophes* ciliées* qui se déplaceront en pleine eau pendant peu de temps avant de se fixer sur un support rigide, souvent vertical ou en surplomb à faible profondeur (moins de 20 m). La planula se métamorphose* en un polype* blanc (ou scyphistome*), conique, attaché au substrat* par sa base et portant à l’autre extrémité un anneau de longs tentacules* entourant la bouche.
Chaque petit polype passera l'hiver sous cette forme. Ces polypes peuvent produire d’autres individus en bourgeonnant (multiplication asexuée) ou en produisant par leur base des podocystes (kystes = formes de résistance qui produiront de nouveaux scyphistomes au retour des conditions favorables).
Au printemps, certains polypes ou scyphopolypes* (ou scyphistomes*, ou strobiles) vont subir une série d’étranglements perpendiculairement à leur axe longitudinal (comme une pile d’assiettes), pour former une dizaine (jusqu’à 21) de minuscules éphyrules* plates. C’est la strobilisation* (ou strobilation). Chacune de ces éphyrules se détache du scyphistome et nage en pleine eau.
La face inférieure de ces jeunes méduses porte une colonne formée par les bras buccaux soudés. Elles se transformeront progressivement ensuite en scyphoméduses adultes.
Ce cycle de reproduction a été décrit entre 1835 et 1839 par le zoologiste allemand Carl Theodor von Siebold (1804-1885) et conjointement entre 1829 et 1841 par le zoologiste norvégien Michael Sars (1805-1869).
Selon Fuchs & al. (2014), la transition entre le polype sessile* et la méduse libre est contrôlée par diverses substances chimiques (acide rétinoïque, protéines) qui induisent la production d’hormones*. Ces protéines sont sensibles aux changements de température saisonniers.
La transformation de la partie interne des bras en poches incubatrices est également sous le contrôle d’une hormone.
Le crustacé amphipode Hyperia galba peut être observé dans les cavités sous-ombrellaires des aurélies.
Une aurélie endémique* (Aurelia relicta) d’un lac marin en Croatie (mer Adriatique) porterait dans une cavité gastrique une larve* d’une anémone de mer parasite* du genre Edwardsiella (Chiaverano & al. 2015).
Les aurélies (stade méduse et éphyrule*) sont consommées par des poissons (comme par exemple Sparus aurata, Sarpa salpa) et des tortues marines. Les scyphopolypes* peuvent être consommés par des poissons, des nudibranches (comme Coryphella verrucosa) et des crustacés par exemple.
Le corps de la méduse, comme de nombreux organismes planctoniques*, est composé à 96 % d'eau.
Elle nage en contractant régulièrement la périphérie de son ombrelle.
Les scyphoméduses ont des organes des sens, les rhopalies* sur le bord de l’ombrelle (typiquement 8) ce sont des complexes de récepteurs sensoriels dont des statocystes*, des photorécepteurs et des chémorécepteurs*
Rarement, en aquarium ou en milieu naturel, des aurélies avec trois, cinq, six gonades* ou plus sont observées. Des expériences d’élevage en laboratoire ont montré qu’un même polype* pouvait générer par clonage des méduses de symétries différentes. La symétrie finale d’une méduse s’établit pendant son développement, et n’est donc pas forcément constante au sein d’un même clone*. Un polype donné peut ainsi générer des méduses tétraradiaires, pentaradiaires et hexaradiaires.... L’identité génétique de ces clones n’implique par leur identité morphologique. Plus les polypes se divisent et produisent des méduses par bourgeonnement, plus l’expression de la symétrie devient instable et plus le pourcentage de méduses de symétrie atypique augmente.
Des individus à l'ombrelle « retournée » comme un parapluie qui aurait subi une rafale de vent ont déjà été observés. Cette anomalie est probablement dûe a un stress en début de dégénérescence. L’animal a peu de chance de survie.
La formation de
podocystes recouverts de chitine* assure la survie pendant des périodes à court terme de faible disponibilité de nourriture et de conditions environnementales défavorables et protègent contre la prédation des nudibranches.
Autrefois on considérait qu’Aurelia aurita (décrite par Linné en 1758), présente des eaux polaires à l’équateur ne constituait qu’une seule espèce (et de nombreuses sous-espèces ont été décrites).
Des études moléculaires ont montré qu’Aurelia aurita est un complexe d’espèces cryptiques*. Il y aurait au moins 13 espèces.
Depuis que le cycle de reproduction de l'espèce est maîtrisé, cette espèce est fréquemment rencontrée dans les aquariums publics. En aquariologie une
des méthodes utilisées pour produire des éphyrules* puis des méduses à la
demande est de provoquer des changements brusques de température.
Dans certains milieux particuliers : milieux portuaires, mer Baltique ou encore des secteurs qui voient leur température modifiée par les rejets d'eaux chaudes des centrales nucléaires par exemple ; il peut y avoir modification du calendrier de reproduction.
Les proliférations (ou blooms*) d’aurélies au printemps et en automne peuvent être à l’origine de problèmes :
Les piqûres d'Aurelia aurita sont très diversement ressenties selon les individus. Certaines personnes ne ressentent absolument rien, alors que d'autres ressentiront une petite inflammation superficielle qui ne dure pas beaucoup plus de deux heures.
Au 19e siècle, aux Pays-Bas, des personnes souffrant de rhumatisme se baignaient dans des baignoires remplies d'aurélies pour soigner leurs douleurs.
Du fait des habitats
préférentiels des polypes* (substrats* durs, faible profondeur), c'est dans des
milieux bien particuliers : dans des estuaires (comme l’Escaut…), des zones
portuaires (Boulogne-sur-mer, le Havre, Dunkerque, ….), des lagunes côtières
(étangs de la côte méditerranéenne) que les probabilités d'observation de
scyphistomes* par les plongeurs sont les plus importantes.
Des extraits des bras buccaux d'A. coerulea ont montré une activité antioxydante significative et la présence de substance de type lysozyme. Ces résultats suggèrent qu’A. coerulea pourrait être utilisée dans la recherche de nouveaux produits cytolytiques (qui détruisent les cellules) et cytotoxiques (qui tuent les cellules) contre les bactéries marines.
Aurélie : francisation du nom latin de genre : Aurelia.
Aurelia : c’est un nom de femme en latin (comme la mère de César). Ce nom vient du latin [aurum] = or, doré. Selon The Bulletin of zoological nomenclature, 1957-1985, 13(1), 1-12, le mot aurelia est la forme féminine d'un vieux mot italien, aurelio, qui désignait à l'origine ce qui est aujourd'hui une chrysalide (stade de développement intermédiaire entre la chenille et le papillon adulte). Des noms classiques (par exemple Marcus Aurelius) se cachent derrière ce mot, mais il ne s'agit pas d'un mot latin classique. En tout état de cause, il s'agit d'un mot de genre féminin.
Ce sont les naturalistes français (normands) François Péron, zoologiste et médecin (1775-1810) et Charles Alexandre Lesueur, peintre d’histoire naturelle (1778-1846) de l’expédition Baudin (1800-1804) qui ont créé, en 1809, le genre Aurellia, Aurellie. Cependant ce nom de genre, en 1816, a été repris par le naturaliste français Jean-Baptiste Monet de Lamarck (1744-1829) avec l’orthographe Aurelia, Aurélie, dans son Histoire Naturelle des animaux sans vertèbres, tome second page 512. Le même Bulletin of zoological nomenclature signale que Aurellia n’a plus été utilisé après 1816 et donc c’est Aurelia qui doit être employé.
aurita : du latin [auris] = oreille, évoque la forme des gonades en forme d'oreilles.
coerulea : du latin [coerulea ou caerulea] = bleu, bleu sombre. La première description, en 1884, a été faite à Port Jackson (Nouvelle-Galles du Sud en Australie) par le zoologiste autrichien Robert Ignaz von Lendenfeld (1858-1913).
solida : du latin [solide] = dense, solide, massif. Ce nom d’espèce donné en 1905 par le naturaliste britannique Edward Thomas Browne (1866-1937) spécialiste des méduses et des hydraires.
relicta : du latin [relicta] = laissé en arrière, délaissé, négligé, abandonné. Ce nom spécifique fait référence à l'isolement géographique "relictuel" de cette espèce. Il a été donné par les scientifiques Scorrano, Aglieri, Boero, Dawson et Piraino en 2016.
Ephyrule : diminutif de Ephyra, une Nymphe, fille de l’Océan et de Téthys (de la mythologie grecque). Ce nom est actuellement donné à un stade de développement des Scyphoméduses, celui que produit par bourgeonnement asexué (par strobilation*) le polype fixé ou scyphistome*.
Numéro d'entrée WoRMS : 135306
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Cnidaria | Cnidaires | Organismes aquatiques (marins pour la plupart) libres ou fixés, carnivores, principalement à symétrie radiaire, caractérisés par des cellules urticantes : les cnidocytes. Deux morphologies principales : le polype et la méduse. La larve est une planula. |
| Sous-embranchement | Medusozoa | Médusozoaires | Cnidaires présentant une phase méduse acraspède (le plus souvent libre et pélagique) dans leur cycle de reproduction. Scyphoméduses, cuboméduses et stauroméduses. |
| Classe | Scyphozoa | Scyphozoaires | Méduses vraies (ou acraspèdes). Phase polype réduite à absente. Le plus souvent strobilisation du polype (de petite taille) pour produire des méduses pouvant atteindre une grande taille. Cavité gastrale cloisonnée en quatre. |
| Sous-classe | Discomedusae | Discoméduses | Scyphoméduses à ombrelle discoïde, non sillonée. |
| Ordre | Semaeostomeae | Séméostomes | Grandes méduses au manubrium allongé et divisé en quatre bras oraux. L'ombrelle porte des tentacules marginaux et huit rhopalies. |
| Famille | Ulmaridae | Ulmaridés | |
| Genre | Aurelia | ||
| Espèce | spp. |
 Méduses vraies (Scyphozoaires) et lucernaires (Staurozoaires)
Méduses vraies (Scyphozoaires) et lucernaires (Staurozoaires)

Aurelia aurita
Bel individu dont l’ombrelle est en contraction pour la nage.
Le Havre (76), 1 m
15/05/2005
 Méduses vraies (Scyphozoaires) et lucernaires (Staurozoaires)
Méduses vraies (Scyphozoaires) et lucernaires (Staurozoaires)

En Zélande
Aurélie au repos entre deux contractions
Den Osse (Zélande, Pays-Bas), 3 m
09/05/2016
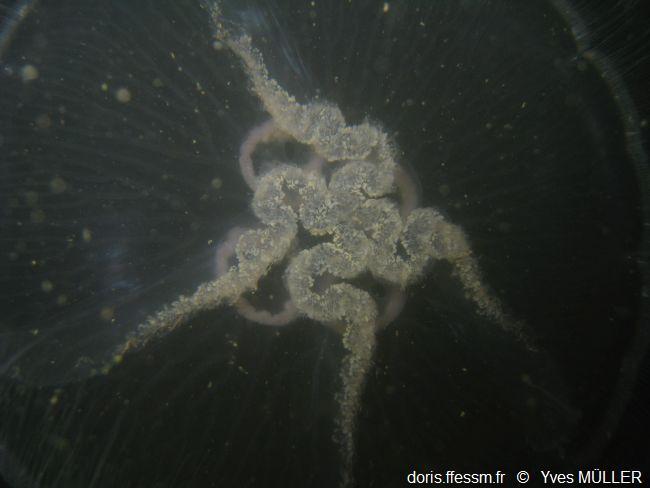
Vue de dessous
Les quatre bras
buccaux festonnés encadrant la bouche sont bien visibles
Forme 4, Port de
Dunkerque (59), 3 m.
29/05/2010

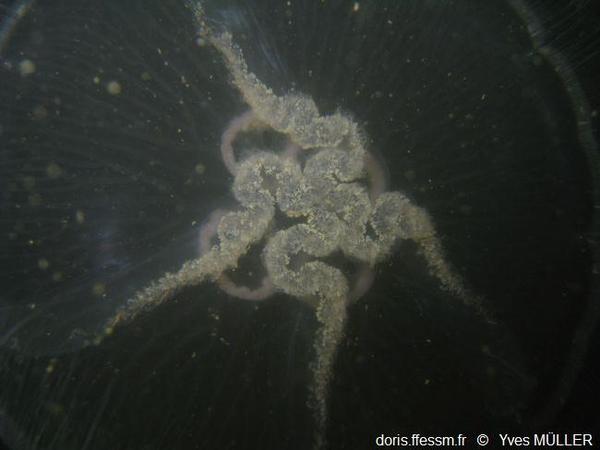
Jeune aurélie
Les rhopalies et
le début de développement des canaux radiaires sont visibles.
Forme 4, Port de
Dunkerque (59), 6 m.
10/04/2010
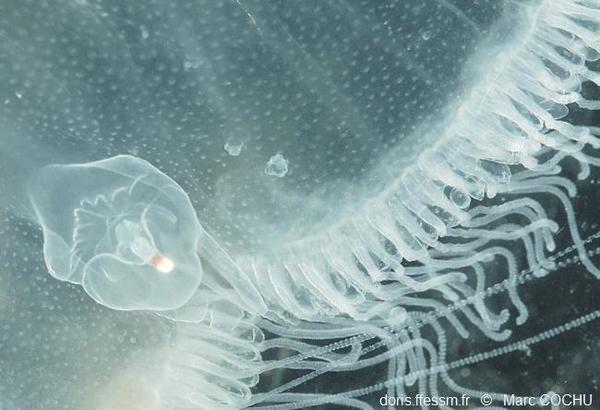
Rhopalie
La rhopalie est un
petit organe situé en bordure d’ombrelle, avec des fonctions stato-*, photo-*
et chémoréceptrices*. La tache blanche est probablement un ocelle.
Estran, Plouër-sur-Rance (22)
06/09/2021


Tentacules
Tentacules marginaux en bordure de l’ombrelle, on distingue des points blancs qui sont autant de batteries de cnidocytes.
Le Havre (76), 1 m
15/05/2005
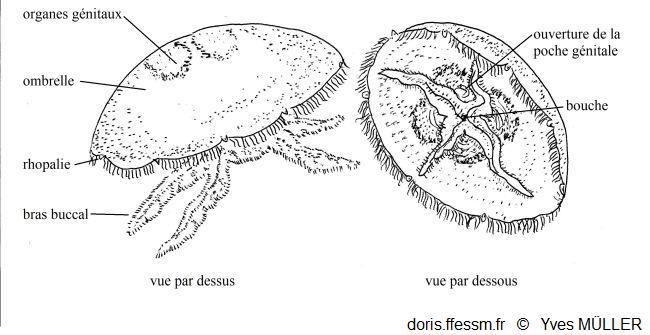
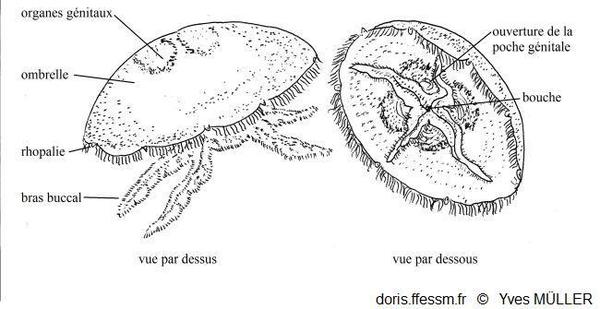
Schémas d’Aurelia aurita
À gauche vue de
dessus, à droite vue de dessous
D’après la figure 154 page 172 du Précis de zoologie 1970
26/03/2024


Scyphistomes
Ces polypes blanchâtres sont les scyphistomes ; grâce à eux, la phase asexuée du cycle de reproduction va débuter...
Dieppe (76), 1,5 m
05/1997


Strobilisation
Ca y est... Un scyphistome (au centre) subit une série d'étranglements : c'est la strobilisation (ou strobilation). Bientôt, de jeunes méduses seront libérées : les éphyrules...
Le Havre (76), 2,5 m
03/1998


Bourgeonnement
Dans certains cas, on peut voir un bourgeonnement apparaître directement sur un scyphistome. Ceci est visible au milieu de ce cliché.
Grevelingenmeer, Zélande, Pays-Bas, 10 m
08/06/2008
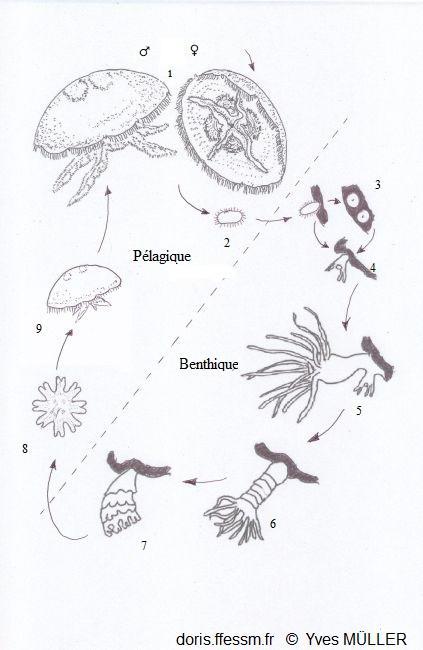
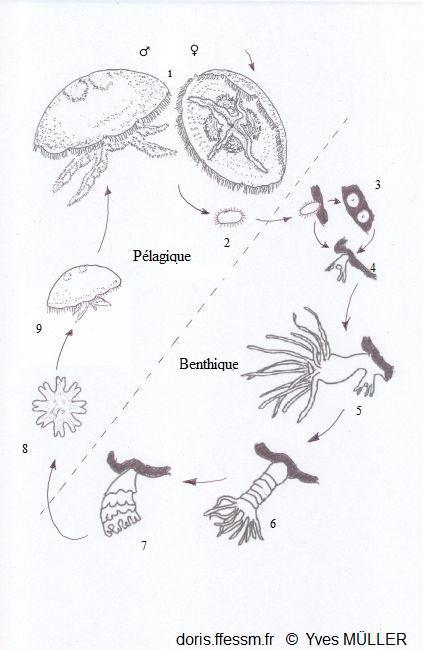
Cycle de reproduction des aurélies
1- Méduses adultes
2- Planula
3- Podocystes
4- Jeune polype
5- Polype en bourgeonnement
6- Strobilation du scyphopolype
7- Libération des éphyrules
8- Ephyrule
9- Jeune méduse
Phase pélagique = reproduction sexuée
phase benthique = reproduction asexuée
D’après les
schémas de Marquès 2019 (fig. 1 p19) et Gröndahl 1988 (fig. 6 p.91).
09/012/2024
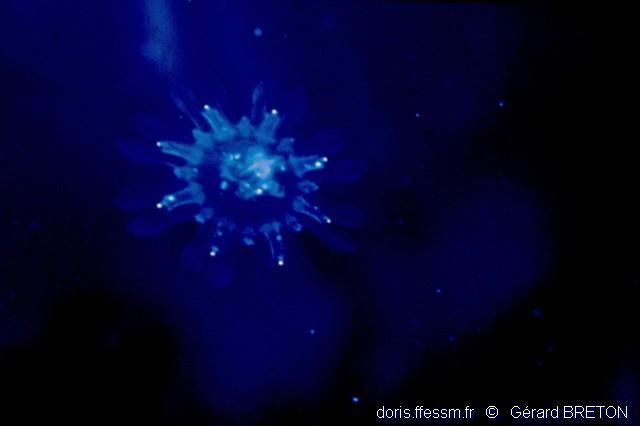
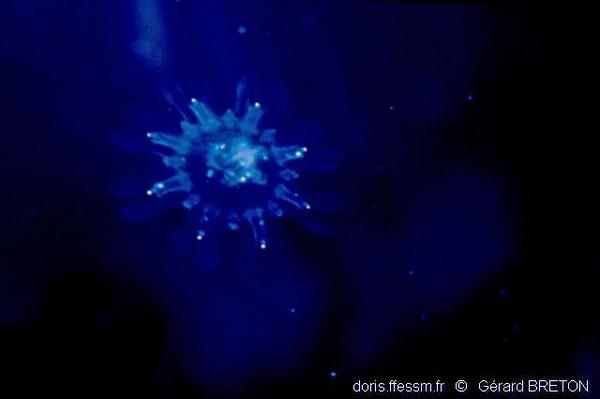
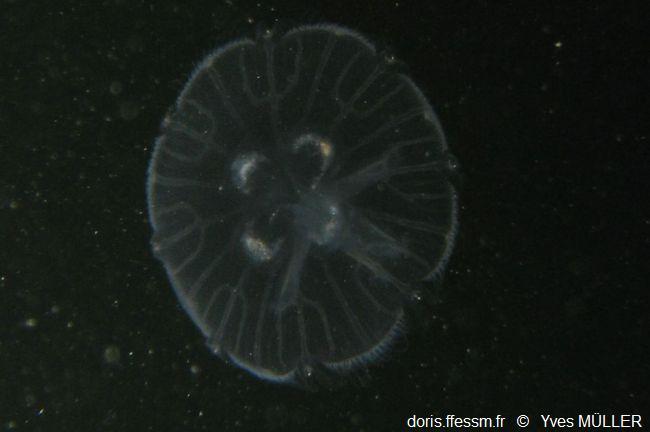
Ephyrule
Une petite méduse en forme d'assiette, l'éphyrule, s'est détachée du scyphistome. Une jeune aurélie est née.
Le Havre (76), 3 m
03/1996
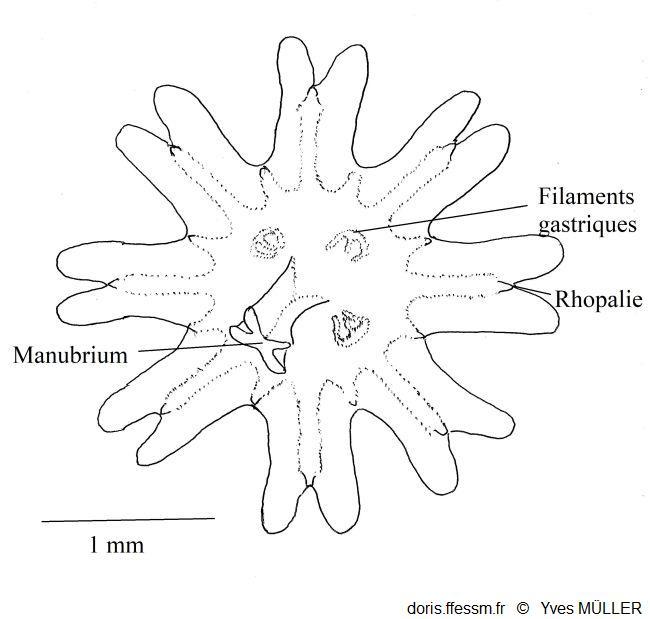
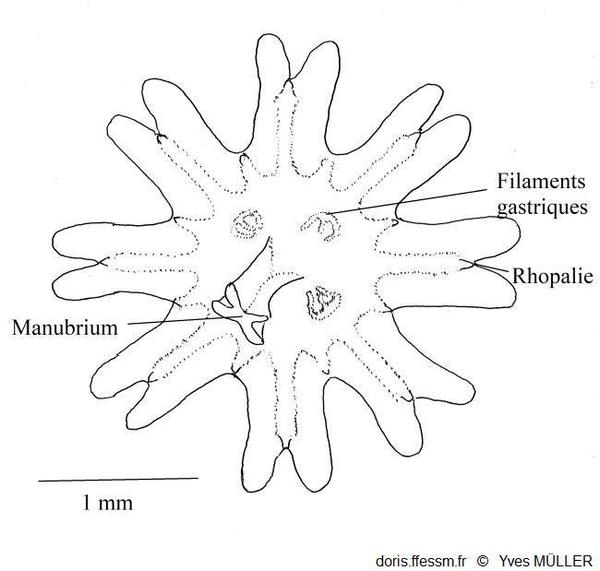
Schéma d’une éphyrule
Les huit lobes
échancrés portent au fond de chaque échancrure une rhopalie
D’après Southward
1955 (fig. 6 A p.209).
26/04/2024


Jeune individu
Petite aurélie, de diamètre environ 2 cm, montrant des bras buccaux encore soudés, ce qui est caractéristique d'un stade jeune.
Le Havre (76), 1 m
15/05/2005


6 gonades et poches incubatrices
Certaines aurélies peuvent présenter, suite à un incident de développement, 6 gonades. On voit bien chez cet individu, par transparence, les poches incubatrices réparties sur les bras buccaux. Elles apparaissent comme de gros grains blanchâtres.
Le Havre (76), 1 m
15/05/2005


Spécimen avec six organes génitaux
Vus de dessus les
six organes génitaux sont bien visibles
Forme 4, Port de
Dunkerque (59), 6 m.
19/09/2020


Un autre specimen
Les six gonades blanches sont bien visibles.
Den Osse (Zélande, Pays-Bas) 3 m.
17/05/19


Vue de dessous d’un spécimen avec six organes génitaux
C’est l’ensemble
du corps de la méduse qui présente une symétrie hexaradiaire. Chez cet individu,
les bras buccaux sont aussi au nombre de six.
Den Osse, Zélande, Pays-Bas, 3 m
16/05/2009


Un spécimen avec trois organes génitaux
Curieusement cet individu ne possède que trois organes génitaux.
Scharendijke
(Zélande, Pays-Bas) 2m.
17/05/2009


Aurélie retournée
On observe parfois des aurélies retournées comme un doigt de gant, pour quelle raison ?
Le Havre (76), 1 m
15/05/2005


Pullulation d’aurélies en mer du Nord
Certaines conditions (température, disponibilité de la nourriture) peuvent amener des pullulations d’aurélies.
En surface, bassin du commerce, Dunkerque (59).
15/05/2004


En regardant vers la surface
Les aurélies peuvent être très nombreuses.
Forme 4, port de Dunkerque (59), 4 m
24/09/2023


En Zélande, sur le platier
Ballet d'aurélies.
Dreischor het gemal (Zélande, Pays-Bas), 3 m.
09/05/2014





Une aurélie de Saint Pierre et Miquelon
Cette jeune méduse est une femelle (les gonades sont roses).
Saint-Pierre, Saint-Pierre et Miquelon, 3 m
07/2009


Aurélie consommée
On peut observer des méduses consommées par des anémones de mer (ici, Sagartiogeton undatus), ou par des crabes …
Dunkerque (59), 7 m
11/06/2005
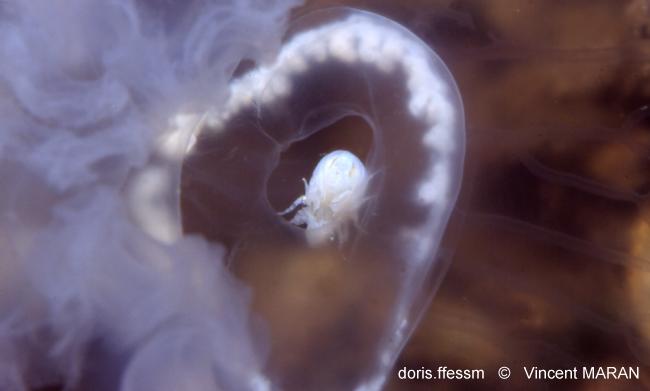
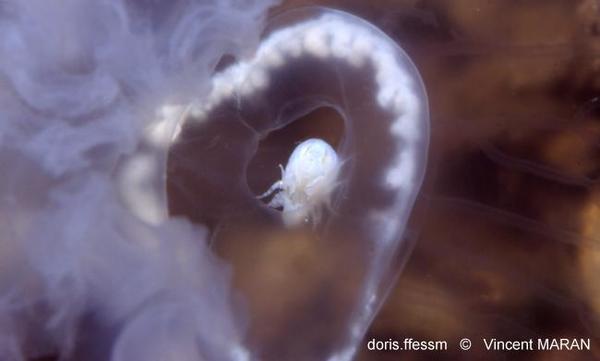
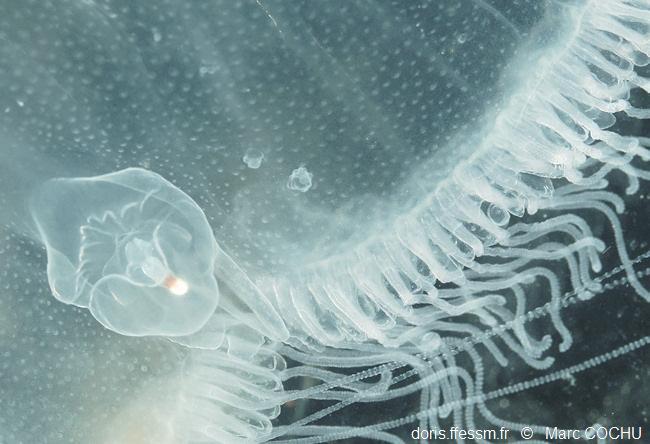
Hyperia galba
Le Crustacé Amphipode Hyperia galba est observé ici dans la cavité sous-ombrellaire d'une aurélie.
Zélande (Pays-Bas), 1 m
24/05/1997
Rédacteur principal : Yves MÜLLER
Rédacteur : Vincent MARAN
Vérificateur : Delphine BONNET
Responsable historique : Alain-Pierre SITTLER
Responsable régional : Yves MÜLLER
Arai M.N., 2009, The potential importance of podocysts to the formation of scyphozoan blooms: a review, Hydrobiologia, 616,241–246.
Buteux A., 2000, Etude du cycle d'Aurelia aurita (Linné) en milieu ouvert dans les bassins du port du Havre, Mémoire de Maîtrise d’Ecologie marine, Université Pierre et Marie Curie-Paris VI-, 27p.
Chapman D. M.,1968, Structure, histochemistry and formation of the podocyst and cuticle of Aurelia aurita, Journal of the Marine Biological Association of the United Kingdom, 48, 187–208.
Chiaverano L.M., Graham W.M., Costello J.H., 2015, Parasites alter behavior, reproductive output, and growth patterns of Aurelia medusae in marine lake, Marine Ecology Progress Series, 540, 87-98.
Dawson M.N., Jacobs D.K., 2001, Molecular evidence for cryptic species of Aurelia aurita (Cnidaria, Scyphozoa), Biological Bulletin, 200, 92–96.
Dawson M.N., 2003, Macro-morphological variation among cryptic species of the moon jellyfish, Aurelia (Cnidaria: Scyphozoa), Marine Biology, 143, 369–379.
Dawson M.N., Martin L.E., 2001, Geographic variation and ecological adaptation in Aurelia (Scyphozoa, Semaeostomeae): some implications from molecular phylogenetics, Hydrobiologia, 451, 259–273.
Fernandez-Alias A., Marcos C., Pérez-Ruzafa A., 2023, Reconstructing the Biogeographic History of the Genus Aurelia Lamarck, 1816 (Cnidaria, Scyphozoa), and Reassessing the Nonindigenous Status of A. solida and A. coerulea in the Mediterranean Sea, Diversity, 15, 1181,1-20.
Fuchs B., Wang W., Graspeuntner S., Li Y., Insua S., Herbst E-M., Dirksen P., Böhm A-M., Hemmrich G., Sommer F., Domazet-Loso T., Klostermeier U.C., Anton-Erxleben F., Rosenstiel P., Bosch T.C.G., Khalturin K., 2014, Regulation of Polyp-to-Jellyfish Transition in Aurelia aurita, Current Biology, 24, 1-11.
Gambil M., Jarms G., 2014, Can Aurelia (Cnidaria, Scyphozoa) species be differentiated by comparing their scyphistomae and ephyrae? European Journal of taxonomy, 107, 1-23.
Gröndahl F.,1988, Interactions between polyps of Aurelia aurita and planktonic larvae of scyphozoans: an experimental study, Marine Ecology – Progress Series, 45, 87-93.
Holst S., Jarms G., 2007, Substrate choice and settlement preferences of planula larvae of five Scyphozoa (Cnidaria) from German Bight, North Sea, Marine Biology, 151, 863–871.
Holst S., 2012, Morphology and development of benthic and pelagic life stages of North Sea jellyfish (Scyphozoa, Cnidaria) with special emphasis on the identification of ephyra stages, Marine Biology, 159, 2707–2722.
Hubot N., Lucas C.H., Piraino S., 2017, Environmental control of asexual reproduction and somatic growth of Aurelia spp. (Cnidaria, Scyphozoa) polyps from the Adriatic Sea, PLoS ONE, 12(6), e0178482.
Jacquet S., 2015, Aurelia : une méduse à découvrir, Subaqua, 263, 54-55.
Kramp P.L., 1961, Synopsis of the medusae of the world, Journal of the Marine Biological Association of the United Kingdom, 40, 469p.
Lawley J. W., Gamero-Mora E., Maronna M. M., Chiaverano L. M., Stampar S. N., Hopcroft R. R., Collins A. G., Morandini A. C., 2021, The importance of molecular characters when morphological variability hinders diagnosability: systematics of the moon jellyfish genus Aurelia (Cnidaria: Scyphozoa), PeerJ. 9, e11954, 1-54.
Lendenfeld R. von, 1884, The scyphomedusae of the southern hemisphere. Part III, Proceedings of the Linnean Society of New South Wales, 9, 259-306.
Lucas C.H., 2016, Reproduction and life history strategies of the common jellyfish Aurelia aurita, in relation to its ambient environment, Hydrobiologia, 451, 229-246.
Lucas C.H., Graham W.M., Widmer C., 2012, Jellyfish life histories: role of polyps in forming and maintaining scyphomedusa populations, Advances in Marine Biology, 63, 133–196.
Marques R., 2019, Drivers and fates of jellyfish blooms, the case study of Aurelia caerulea in the Thau lagoon (North Western Mediterranean), Thèse Université de Montpellier, 198p,
Marques R., Cantou M., Molinero J-C., Soriano S., Bonnet D., 2015, Mapping distribution and habitats of Aurelia sp. polyps in Thau lagoon, north-western Mediterranean Sea (France), Marine Biology, 162, 1441-1449.
Marques R., Boyer S., Delpy F., Carré C., Le Floc’h E., Roques C., Molinero J-C, Bonnet B., 2015, Pelagic population dynamics of Aurelia sp. in French Mediterranean lagoons, Journal of Plankton Research, 1-17.
Marques R., Bouvier C., Darnaude A.M., Molinero J.C., Przybyla C., Soriano S,, Tomasini J.A., Bonnet D., 2016, Jellyfish as an alternative source of food for opportunistic fishes, Journal of Experimental Marine Biology and Ecology, 485, 1-7.
Marques R., Darnaude A.M., Crochemore S., Bouvier C., Bonnet D., 2019, Molecular approach indicate consumption of jellyfish by commercially important fish species in a coastal Mediterranean lagoon, Marine Environmental Research, 15, 104787 (7p.).
Sars M., 1841, Développement des Acalèphes, Mémoire sur le développement de la Medusa aurita et de la Cyanea capillata, Annales des Sciences Naturelles, seconde série, 16, 321-348.
Scorrano S., Aglieri G., Boero F., Dawson M. N., Piraino S., 2016, Unmasking Aurelia species in the Mediterranean Sea: an integrative morphometric and molecular approach, Zoological Journal of the Linnean Society, 1-17.
Schroth W, Jarms G, Streit B, Schierwater B., 2002, Speciation and phylogeography in the cosmopolitan marine moon jelly, Aurelia sp., BMC Evol Biol 2, 1–10.
Stabili L., Rizzo L., Caprioli R., Leone A., Piraino S., 2021, Jellyfish bioprospecting in the Mediterranean Sea: antioxidant and lysozyme-like activities from Aurelia coerulea (Cnidaria, Scyphozoa) Extracts, Marine Drugs, 19, 619, 1-18.
Southward A.J., 1955, Observations on the ciliary currents of the jelly-fish Aurelia aurita L., Journal of Marine Biology Association of the United Kingdom, 34, 201-216.
Takao M., Okawachi H., Uye S., 2014, Natural predators of polyps of Aurelia aurita s.l. (Cnidaria: Scyphozoa: Semaeostomeae) and their predation rates, Plankton Benthos Research, 9, 105–113.
Turk V., Lucic D., Flander-Putrle V., Malej A., 2008, Feeding of Aurelia sp. (Scyphozoa) and links to the microbial food web, Marine Ecology, 29, 495-505.
La page d'Aurelia aurita dans l'Inventaire National du Patrimoine Naturel : INPN