Grande algue 3 parties identifiables : fronde, stipe, crampons
Fronde foliacée fine, lobée, avec une nervure médiane bien visible
Couleur brun-jaunâtre, translucide
Structures de reproduction (sporophylles) ondulées et plissées à la base du stipe
Ouessane, fougère de mer (ce nom est aussi donné à l'algue brune Dictyopteris polypodioides)
Wakame (GB), Abeto marino (E), Japanse kelp, Wakame (D), Wakame (Japon), Miyok (Corée), Qun dai cai (Chine)
Alaria pinnatifida Harvey, 1860
Alaria amplexicaulis Martens, 1866
Ulopteryx pinnatifida (Harvey) Kjellman, 1885
Océan Pacifique tempéré, océan Indien Sud-Est tempéré, Méditerranée (sauf sud et est), Atlantique Nord et Sud tempéré
Zones DORIS : ● Europe (côtes françaises), ○ [Méditerranée française], ○ [Atlantique Nord-Est, Manche et mer du Nord françaises]Undaria pinnatifida est originaire du nord-ouest de l’océan Pacifique (Japon, Corée, N-E Chine, S-E Russie). Cette algue a été introduite accidentellement, avec des naissains* d’huîtres japonaises, Magallana gigas, dans le bassin de Thau au début des années 1970. Depuis, outre la lagune de Thau, des populations se sont développées en mer ouverte face à Sète et Port-la-Nouvelle.
En 1983, elle a été introduite de manière volontaire pour des tests de culture en Bretagne : baie de Lampaul (Ouessant), île de Groix, île de Sein et dans l’estuaire de la Rance (St Malo). Des populations spontanées ont ensuite été signalées en Manche, d’Ouessant jusqu’aux Pays-Bas, et sur les côtes anglaises. Des populations se sont également installées sur la façade Atlantique, en France, du Guilvinec à la Rochelle et en Espagne en Asturies et en Galice.
U. pinnatifida a également été introduite accidentellement dans l’hémisphère Sud, d’abord en Nouvelle Zélande puis en Tasmanie et en Australie. Des individus épiphytes* sur les coques des bateaux commerciaux seraient responsables de son introduction.
Elle a également colonisé le continent américain sur sa façade Atlantique, en Argentine en 1992, et plus récemment dans le sud de la Patagonie. Des populations se sont installées sur la façade Pacifique, en Californie depuis 2001 ainsi qu’au Mexique depuis 2003.
Undaria pinnatifida se fixe sur des substrats durs variés qu’ils soient naturels (rochers, galets, bois, concrétions, métal, plastique, verre, caoutchouc, organismes vivants variés, etc.) ou artificiels (structures portuaires, poteaux, chaînes d’ancrage, cordages, tables conchylicoles, coques de bateaux, bouées, etc.)
Cette algue se développe en eau tempérée froide, dans un biotope photophile*, en mode abrité, parfois avec du courant. Elle est abondante dans la partie supérieure de l’infralittoral*, près du zéro des cartes marines, mais sa distribution peut aller du bas de l’estran* jusqu’à une profondeur maximale inférieure à 18 m selon la turbidité* de l’eau. Par exemple, dans les eaux claires d’Ouessant, on peut la trouver jusqu’à 18 m alors que dans les eaux turbides de St Malo, elle ne dépasse pas 13 m de profondeur. En Méditerranée, elle se développe généralement à moins de 1,5 m de profondeur de l’automne à la fin du printemps.
Elle cohabite avec Saccorhiza polyschides, Sargassum muticum et Cystoseira sp. et se rencontre en faible abondance dans les champs de laminaires. Cette espèce préfère néanmoins les zones abritées à moyennement exposées comme les ports.
Elle présente une grande tolérance aux pollutions organiques et aux variations de salinité. Les sporophytes présentent un optimum de croissance entre 10 et 15 °C et dégénèrent lorsque la température excède 25 °C.
Undaria pinnatifida est une grande algue brune qui peut mesurer jusqu'à 2 à 3 m (sa longueur moyenne en Méditerranée est comprise entre 0,5 et 1,2 m). Son thalle* est composé de 3 parties : la fronde*, le stipe* et les crampons ou haptères* qui permettent à l’algue de se fixer solidement au substrat*.
La fronde est une lame foliacée*, plus étroite vers son extrémité, avec une nervure médiane bien nette, brun-verdâtre et translucide. Ses bords sont profondément découpés et lobés surtout vers sa base. Au stade juvénile, cette fronde est entière et droite de forme lancéolée sans échancrures. A maturité, elle devient triangulaire et lobée transversalement.
Le stipe, long de 10 à 20 cm, large de 0,5 à 1 cm, est épais et plat avec des bords denticulés. A maturité, se forment, vers sa base, des ailes ondulées et plissées, les sporophylles*, qui contiennent les structures fertiles.
La forme de l’algue évolue dans le temps : le jeune thalle est lancéolé, puis allongé en ruban ; à l’approche de la maturité il devient plus large et lobé. A la fin du cycle, les sporophylles se développent et la partie supérieure de la fronde se dégrade. La forme à l’état adulte peut varier avec une fronde plus ou moins découpée, un stipe long ou trapu, des sporophylles plus ou moins larges.
Alaria esculenta : cette algue présente aussi une nervure médiane mais la fronde est moins large avec des bords non lobés. Ses organes reproducteurs (sporophylles) portés par le stipe sont des lames foliacées étroites et non des « falbalas ». Notons que cette espèce est trouvée dans des zones battues, contrairement à Undaria pinnatifida.
C’est un végétal autotrophe* qui élabore sa matière organique par photosynthèse* à partir du gaz carbonique, de l’eau et des sels minéraux, grâce à sa chlorophylle* et à ses autres pigments qui captent la lumière solaire.
Le cycle de vie d’Undaria pinnatifida comporte 2 générations successives très différentes d’aspects :
- une génération bien visible, le sporophyte*, qui est l’algue décrite ci-dessus,
- une génération microscopique le gamétophyte*.
Ce cycle de vie est dit digénétique* avec des générations hétéromorphes*.
A la fin du printemps ou en début d’été, les sporophytes portent des sporophylles qui, à maturité, vont produire et libérer des spores dans l’eau. Ces spores se fixent et en germant donnent, soit des gamétophytes mâles, soit des gamétophytes femelles. Les gamétophytes mâles libèrent des gamètes mâles biflagellés qui nagent jusqu’à un gamétophyte femelle portant des gamètes femelles (oogones*) qu’ils fécondent. Le sporophyte issu de cette fécondation se développe donc sur un gamétophyte femelle. Ce cycle s’étend sur une année. Le sporophyte se développe sur 5 à 6 mois, depuis l’automne jusqu’au début de l’été en Méditerranée et plus tardivement dans l’Atlantique. En Bretagne, on observe deux pics de recrutements : un majeur en mars-avril et l’autre mineur en septembre-octobre.
Une multiplication asexuée (parthénogénèse*) en laboratoire a été décrite, elle est utilisée pour la culture de l’algue.
Le wakamé peut servir d’abri à différents animaux et de support à des algues, hydraires, bryozoaires, tuniciers, larves et œufs de mollusques. Ses sporophytes et ses gamétophytes sont consommés par des poissons, des oursins (Paracentrotus lividus, Echinus esculentus et Psammechinus miliaris), des gastéropodes (ormeaux), crustacés (copépodes...).
L’algue est annuelle. Sa croissance est dite intercalaire, car la zone de croissance se situe entre le stipe et la fronde.
Cytologie : vers l’extérieur le cortex* est formé de cellules polyédriques avec des cryptes pilifères* et des cellules sécrétrices de mucilage* formant à sa surface des ponctuations blanches et noires. L’intérieur du thalle est occupé par un ensemble de filaments. Les températures optimales pour la formation et la croissance des sporophytes sont comprises entre 3 et 20 °C, alors que le gamétophyte se développe bien lorsque l’eau est plus chaude (10 à 24 °C).
Trois morphotypes* sont décrits chez cette espèce, en fonction de la forme du sporophylle, du thalle et de la longueur du stipe. Ces morphotypes n’ont pas de bases génétiques particulières et ne correspondent pas à des sous-espèces ou à des variétés. Ils correspondent à des variations phénotypiques notamment saisonnières.
Cette espèce est invasive et cultivée.
En Asie, le wakamé est l’une des algues à forte valeur commerciale. Le marché est approvisionné par les récoltes d’algues sauvages et surtout d’aquaculture. Environ deux millions de tonnes sont produites dans le monde, les principaux producteurs étant la Chine, La Corée et le Japon. Des cultures en Bretagne alimentent essentiellement une consommation française.
Elle entre en effet dans la composition de nombreuses soupes et salades. Sa forte teneur en oligoéléments, en protéines et l’absence de graisses assimilables par l’organisme en fait un aliment particulièrement apprécié. Elle est utilisée également pour nourrir les ormeaux en élevage. Cette algue présente également de nombreuses qualités pharmaceutiques (prévention contre le cancer, des maladies cardio-vasculaires, herpès, etc.). Ce sont ces qualités alimentaires et pharmaceutiques qui font d’U. pinnatifida l’une des premières algues cultivées dans le monde. La production asiatique est connue depuis plus de 60 ans et près de 300 000 tonnes sont produites chaque année par la Corée.
Wakamé correspond au nom commercial donné à cette espèce dans son pays d’origine, le Japon.
Undaria du latin [unda] = vague, onde,
pinnatifida du latin [pinna] = plume et [fida] = exprimant le partage ; découpé en forme de plume. Pinnatifida correspond au terme botanique Pennatifide s’appliquant à une feuille pennée, à lobes atteignant à peu près le milieu de chaque demi-limbe.
Numéro d'entrée WoRMS : 145721
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Ochrophyta | Ochrophytes | ou Hétérokontes, ou Straménopiles: présence d'un stade unicellulaire à 2 flagelles, un lisse et un à poils tubulaires. |
| Classe | Phaeophyceae | Phéophycées | Algues brunes. |
| Ordre | Laminariales | Laminariales | Fronde stipe haptère parfois thalle en forme de lame |
| Famille | Alariaceae | Alariacées | |
| Genre | Undaria | ||
| Espèce | pinnatifida |
 Algues brunes (Phéophycées)
Algues brunes (Phéophycées)

L’algue jeune avant l’apparition des parties fertiles
Cette grande algue ici de couleur brun-verdâtre, est reconnaissable à sa fronde foliacée lobée transversalement présentant une nervure médiane qui prolonge un stipe solidement fixé par des haptères*.
Tourelle chenal tribord Breac'h Verr, Aber Wrac'h (29), 3 m
10/02/2006
 Algues brunes (Phéophycées)
Algues brunes (Phéophycées)

Caractéristiques à maturité
Trois parties identifiables : fronde*, stipe*, haptères*.
- fronde foliacée, lobée, avec une nervure médiane bien visible,
- couleur brun jaunâtre,
- structures de reproduction ondulées et plissées, les sporophylles*, à la base du stipe.
Bassin de Thau (34), Le Ponton (Balaruc), 1 m
19/04/2010


A maturité en juillet en Bretagne
Sur cette algue, retrouvé en épave en juillet à la sortie du Vieux port de Roscoff, le stipe présente des ailes ondulées et plissées : les sporophylles*.
Vieux port de Roscoff (29)
09/07/2010


Dans un biotope photophile
En Méditerranée, elle se développe généralement à moins de 1 m de profondeur (0,3 à 1 m) de l’automne à la fin du printemps.
Bassin de Thau (34), Pointe Longue (Sète), 1,2 m
14/06/2006


Dans le courant
Elle est présente au début de l’infralittoral à un niveau proche du zéro des cartes marines, parfois dans un assez fort courant, mais en milieu abrité.
Tourelle chenal tribord Breac'h Verr, Aber Wrac'h (29), 3 m
10/02/2006


Aspect variable dans le temps
Sur le même site, on a récolté des individus d’âges différents : à gauche stade juvénile avec fronde lancéolée non lobée, au centre à l’approche de la maturité la fronde devient plus large et lobée ; à droite, à maturité, les sporophylles sont développés et la partie supérieure de la fronde se dégrade.
Bassin de Thau (34), Le Ponton (Balaruc), 1 m
19/04/2010


Sporophylles
A maturité, des ailes ondulées et plissées (sporophylles*) se forment à la base du stipe, elles contiennent les structures fertiles qui vont produire des spores mobiles. L’algue cesse de croitre et se dégrade. Une anémone s’est fixée sur le sporophylle de l’individu de gauche.
Bassin de Thau (34), Le Ponton (Balaruc), 0,7 m
29/05/2010


Support à des algues et divers animaux
Des hydraires se sont fixés sur les lobes du sporophylle de l’individu de droite.
Bassin de Thau (34), Le Ponton (Balaruc), 0,7 m
29/05/2010
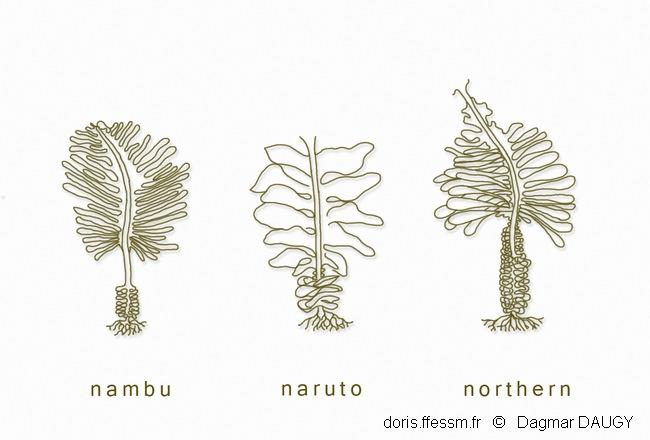
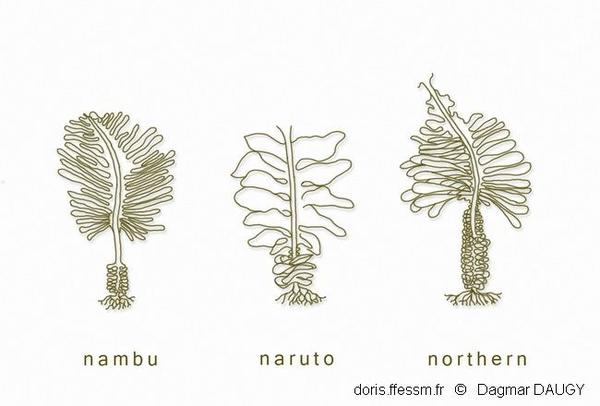
Morphotypes
Trois morphotypes* sont décrits chez cette espèce, en fonction de la forme du sporophylle, du thalle et de la longueur du stipe. Ces morphotypes n’ont pas de bases génétiques particulières et ne correspondent pas à des sous-espèces ou à des variétés. Ils correspondent à des variations phénotypiques notamment saisonnières. Ce dessin montre quelques exemples de variants phénotypiques originellement attribués à différents « types » : Northern ou distans, Naruto ou typica, Nambu (d'après Hay, 1999).
N/A
02/2012
Rédacteur principal : Claude WACQUANT
Correcteur : Daphné GRULOIS
Responsable régional : Véronique LAMARE
Cecere E., Petrocelli A., Saracino O.D., 2000, Undaria pinnatifida (Fucophyceae, Laminariales) spread in the central Mediterranean : its occurrence in the Mar of Taranto (Ionian Sea, southern Italy), Cryptogamie, Algol., 21(3), 305-309.
Gollasch S., 2006, UNDARIA PINNATIFIDA, D.A.I.S.I.E, 4p.
Grulois D., 2010, Etude de la dispersion et du recrutement à différentes échelles spatiales chez Undaria pinnatifida, une macro-algue introduite le long des côtes bretonnes, Thèse de l’Université Pierre & Marie Curie (Paris VI), 396p.
Hay C.H., Sanderson J.C.,1999, Dispersal of the Asian kelp Undaria pinnatifida in Australasia, In: Islands in the Pacific Century. Pacific Science Inter-Congress, 13-19 July 1998, The University of the South Pacific, Suva, Fiji Islands.
Perez R., Lee J.Y., Juge C. 1981, Observations sur la biologie de l'algue japonaise Undaria pinnatifida (Harvey) Suringar introduite accidentellement dans l'étang de Thau, Science et Pêche, 315, 12p. Archimer Ifremer.
Perez R., Kaas R., Barbaroux O., Arbault S. 1990, TECHNIQUE DE CULTURE POUR LES COTES BRETONNES DE L'ALGUE ALIMENTAIRE UNDARIA PINNATIFIDA, Tableau de marché - étude économique, 66p. Archimer Ifremer.
Voisin M., 2007, Les processus d'invasions biologiques en milieu côtier marin : le cas de l'algue brune Undaria pinnatifida, cultivée et introduite à l’échelle mondiale, Thèse de l’Université Pierre & Marie Curie, (Paris VI), 269p.
La page sur Undaria pinnatifida sur le site de référence de DORIS pour les algues : AlgaeBase
La page d'Undaria pinnatifida dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.