Organisme gélatineux planctonique transparent
Peut se présenter sous deux formes : solitaire et en colonie
Oozoïde (phase asexuée, solitaire) :
Taille de 5 à 81 mm
6 larges bandes musculaires (la plus postérieure étant plus étroite) parallèles et interrompues dorsalement et ventralement
Tunique rigide symétrique
Avant du corps rectangulaire, arrière légèrement protubérant, portant deux petites expansions de chaque côté
Blastozoïde (phase sexuée, coloniale) :
Taille de 4 à 55 mm
5 bandes musculaires parallèles interrompues ventralement, la bande la plus antérieure l’est aussi dorsalement
Tunique asymétrique avec expansion postérieure du côté droit
Avant du corps tronqué de manière oblique
Existence en chaîne, accroché à de nombreux autres blastozoïdes
Holothurium zonarium Pallas, 1774
Salpa zonaria (Pallas, 1774)
Iasis zonaria (Pallas, 1774)
Salpa polycratica Forskål, 1775
Holothuria zonaria Linneaus 1778
Salpa cordiformis Quoy & Gaimard, 1827
Salpa microstoma Quoy & Gaimard, 1827
Salpa unicuspidata Lesson, 1830
Salpa quadrangularis Lesson, 1832
Salpa tricuspida Lesson, 1832
Salpa nitida Hedman, 1888
Jasis zonaria Sewell, 1926
Cosmopolite (zones tropicales et tempérées)
Zones DORIS : ● Indo-Pacifique, ● Atlantique Nord-Ouest, ● Europe (côtes françaises), ○ [Atlantique Nord-Est, Manche et mer du Nord françaises], ○ [Méditerranée française]Elle est cosmopolite et eurytherme* mais se trouve généralement dans les zones tempérées et chaudes, parfois au delà.
Soestia zonaria a été échantillonnée dans les océans Indien, Pacifique, Atlantique de 40°S jusqu’aux environs du Groenland, ainsi qu’en mer Méditerranée, en mer du Japon et en mer d’Arabie.
Soestia zonaria est une espèce holoplanctonique*, c’est-à-dire que contrairement aux ascidies qui possèdent un stade fixé, cette espèce comme tous les thaliacés, passe l’intégralité de son cycle de vie dans la colonne d’eau.
Elle est principalement épipélagique* mais a également été observée à des profondeurs pouvant atteindre 1100 m. Elle effectue des migrations verticales nycthémérales* de faible amplitude (Lüskow et al. 2024), qui varient selon les saisons. Ces migrations d’ascension nocturne et de descente diurne se font entre -400/500 m et la surface.
Lorsque les conditions sont favorables (abondance de phytoplancton* (nourriture) et température optimale), l’espèce est capable de former des blooms* au cours desquels sa concentration peut atteindre 120 individus/1000 m³ (Daponte et al. 2013, Atlantique Sud-Ouest). Des concentrations record de 6000 ind./1000 m³ (dans le nord de la mer d’Arabie) ont même été observées.
Ces blooms coïncident également avec de fortes concentrations de Salpa fusiformis (Daponte et al. 1993, Giachini Tosetto et al. 2022).
Soestia zonaria est un organisme gélatineux planctonique* transparent.
L’espèce passe par deux stades de vie : l’un asexué (oozoïde* solitaire) et l’autre sexué (blastozoïde* colonial).
Un individu solitaire est plus grande qu'un individu appartenant à une colonie. En effet, des oozoïdes de 25 à 81 mm et des bastozoïdes 4 à 42 mm ont été observés en Atlantique Sud-Ouest (Daponte et al. 2013). Et des tailles de 5 à 65 mm et de 5 à 55 mm respectivement pour des oozoïdes et des blastozoïdes ont été rapportées dans "Faune de France" (Harant et Vernières, 1938).
La forme oozoïde présente six larges bandes musculaires parallèles entre elles (la plus postérieure est moins large), interrompues à la fois dorsalement et ventralement.
La tunique* est rigide, transparente, symétrique et relativement prismatique. L’avant du corps est rectangulaire, l’arrière légèrement protubérant (mucron*), portant deux petites expansions de chaque côté. A l’intérieur du mucron postérieur se trouve le nucléus* autour duquel s’entoure le stolon* en spirale.
La forme blastozoïde présente 5 bandes musculaires, moins larges et interrompues ventralement uniquement (à l’exception de la bande la plus antérieure qui l’est aussi dorsalement). Elle présente un prolongement conique postérieur à droite.
Les blastozoïdes forment des chaînes d’individus sous la forme de deux chaînes parallèles au sein desquelles ils sont alignés, parallèlement à l’axe de mouvement de la colonie. Cet arrangement, bénéfique hydrodynamiquement, en fait probablement d’efficaces et puissants nageurs (Damian-Serrano et al. 2024).
Soestia zonaria n’est pas souvent confondue avec d’autres salpes. En effet, ses larges bandes musculaires et sa forme sont assez caractéristiques. De plus, les espèces des genres Ritteriella et Weelia (anciennement regroupées avec Soestia dans le genre Salpa) partageant un cycle de vie similaire ne lui ressemblent pas.
Soestia est un genre monospécifique*.
Comme toutes les salpes, Soestia zonaria est un organisme filtreur* qui se nourrit essentiellement de phytoplancton*.
La contraction de ses muscles génère un courant qui lui permet simultanément de se déplacer et de filtrer l’eau qui entre par le siphon buccal* et ressort par le siphon cloacal*. Les particules alimentaires qui pénètrent dans la cavité pharyngienne sont alors tamisées par un filet de mucus (sécrété par l’endostyle*) avant d’être aspirées vers la bouche et digérées.
Le régime alimentaire de S. zonaria n’a pas été étudié en détail. Néanmoins, des travaux sur d’autres espèces montrent qu’elles capturent non seulement des « algues » unicellulaires dont le diamètre est supérieur à celui de la maille de leur tamis, mais qu’elles se nourrissent également de très petites bactéries (Thompson et al. 2024, Sutherland et al. 2010). Le taux de filtration des salpes, qui peut atteindre plusieurs millilitres par seconde, compte parmi les plus élevés parmi les animaux marins, ce qui leur permet de se nourrir efficacement dans des milieux oligotrophes*.
En comparaison avec d’autres salpes, S. zonaria semble moins dépendre de nourriture riche en azote, ce qui la rend plus résiliente et adaptée à la vie tempérée chaude et tropicale épipélagique* et (haut) mésopélagique* (Lüksow et al. 2024).
L’oozoïde*, solitaire, se reproduit asexuellement et aboutit au relargage de chaînes (au moins 4) de blastozoïdes* tandis que le stade sexué donne un à deux individus asexués : l’oozoïde.
Les blastozoïdes sont protogynes* : ils sont d’abord femelles (les ovocytes sont matures) et fécondés par des blastozoïdes mâles (spermatozoïdes matures) plus âgés. Les blastozoïdes ont 2 à 11 sacs ovariens, mais tous les ovocytes* ne se développent pas, de sorte qu’un blastozoïde ne produit qu’un à deux embryons au cours de sa vie (Daponte et al. 2013).
L’oozoïde produit un stolon* qui, s’enroulant autour du nucléus*, se segmente et donne deux rangées de bourgeons qui deviendront les blastozoïdes, tous génétiquement identiques (ce sont des clones*). Une fois mature, la chaîne est expulsée par l’oozoïde grâce à la formation d’un orifice dans la région ventrolatérale droite de sa tunique, ce qui lui laisse une cicatrice visible (Daponte et al. 2013).
Chaque chaîne comporte une centaine de blastozoïdes en moyenne, de sorte qu’un oozoïde peut produire plusieurs centaines de blastozoïdes au cours de sa vie. La reproduction asexuée est donc centrale dans la formation des blooms saisonniers.
Bien que la durée exacte du cycle de vie reste inconnue, des travaux menés au large de l’Argentine suggèrent qu’il dure plusieurs mois (Daponte et al. 2013).
La filtration active du phytoplancton* par les salpes conduit à la production d’un grand nombre de pelotes fécales, qui coulent rapidement (992 ± 174 m par jour environ chez Soestia zonaria (Yoon et al. 2001)). De ce fait, les salpes sont considérées comme des animaux essentiels pour la pompe à carbone (Decima et al. 2023), système naturel permettant une régulation du climat via des processus physiques et, dans ce cas précis, biologiques.
Les résultats récents sur leur régime alimentaire montrent aussi qu’elles ont un impact important sur les communautés microbiennes océaniques et le cycle de l’azote (Thompson et al. 2024).
Certaines espèces de poissons, comme l’aiglefin, l’anchois et le poisson-hachette, se nourrissent de Soestia zonaria. Cette dernière est également la proie de cnidaires (méduses et siphonophores), cténophores, tortues ou oiseaux marins.
Salpe à larges bandes : nom descriptif de cette espèce de salpe, mettant en avant les larges bandes musculaires de l'oozoïde.
Soestia : le genre a été décrit en 1998 par la chercheuse australienne, spécialiste des Tuniciers, Patricia Kott (1925-2012 - aussi connue par son nom de mariage : Patricia Mather), mais elle n'a donné à notre connaissance aucune explication sur l'origine ou le sens de ce nom qu'elle a choisi, Soestia.
C'est un genre monospécifique*, qui ne contient donc qu'une seule espèce : Soestia zonaria.
zonaria : du latin [zona] = ceinture. Ce nom est en rapport avec les bandes musculaires présentes sur la tunique.
Numéro d'entrée WoRMS : 137275
| Termes scientifiques | Termes en français | Descriptif | |
|---|---|---|---|
| Embranchement | Chordata | Chordés | Animaux à l’organisation complexe définie par 3 caractères originaux : tube nerveux dorsal, chorde dorsale, et tube digestif ventral. Il existe 3 grands groupes de Chordés : les Tuniciers, les Céphalocordés et les Vertébrés. |
| Sous-embranchement | Urochordata / Tunicata | Urochordés / Tuniciers | Chordés marins fixés (ascidies) ou pélagiques (thaliacés), solitaires ou coloniaux. Epaisse tunique cellulosique. Deux siphons, pharynx bien développé, la chorde larvaire régresse chez l'adulte (sauf chez les Appendiculaires). |
| Classe | Thaliacea | Thaliacés | Tuniciers pélagiques qui ont perdu leur chorde larvaire. Organismes transparents libres et planctoniques, les siphons buccal et atrial sont terminaux et diamétralement opposés. |
| Ordre | Salpida | Salpides | Thaliacés toujours solitaires, ou en chaînes de plusieurs dizaines d'individus mais jamais coloniaux. Bandes musculaires périphériques incomplètes. |
| Famille | Salpidae | Salpidés | Unique famille de l'ordre des Salpides. |
| Sous-famille | Salpinae | Salpinés | |
| Genre | Soestia | ||
| Espèce | zonaria |
 Tuniciers et Céphalocordés (Ascidies...)
Tuniciers et Céphalocordés (Ascidies...)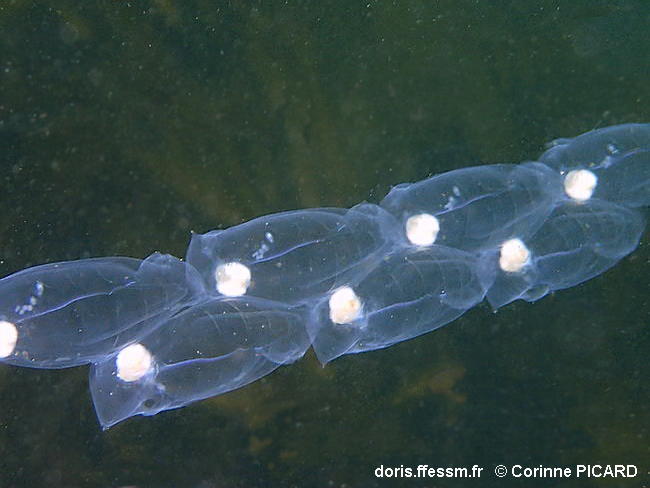
Salpe en chaîne alternée
Les salpidés sont des animaux planctoniques, que les plongeurs rencontrent généralement dans les 10 premiers mètres, portés par les courants durant certaines périodes de l'année.
Lorsqu'on les rencontre en colonies (en chaînes), comme sur cette photo, on peut savoir que ce sont des individus sexués : les blastozoïdes.
Pririac-sur-Mer (44), Atlantique, 3 m
17/05/2020
 Tuniciers et Céphalocordés (Ascidies...)
Tuniciers et Céphalocordés (Ascidies...)

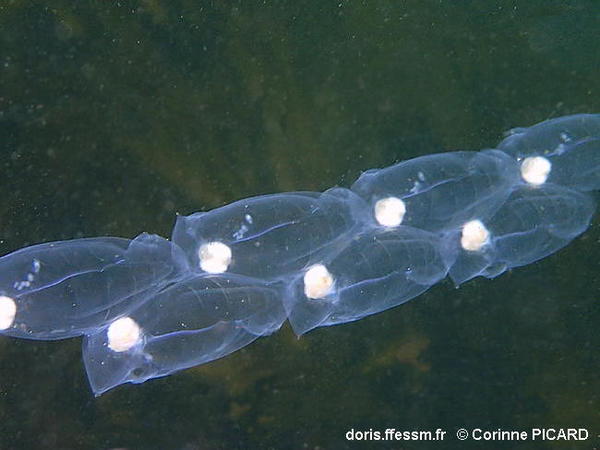
Blastozoïdes : description (Hawaï)
Les blastozoïdes sont les individus correspondant à la phase sexuée de l'espèce. Ils forment des colonies : plusieurs chaînes émises par l'oozoïde solitaire. Les individus de ces colonies sont protogynes (femelles puis mâles).
La différence de maturité entre les individus d'une même génération permet la reproduction sexuée. En effet, les individus relargués en premiers, plus vieux, pourront féconder les individus femelles, plus jeunes.
Le blastozoïde peut atteindre une taille de 55 mm. Il a 5 bandes musculaires parallèles dans une tunique asymétrique, avec une expansion postérieure du côté droit.
Colonie de blastozoïdes, collectée à Hawaï, océan Pacifique
225/04/2022
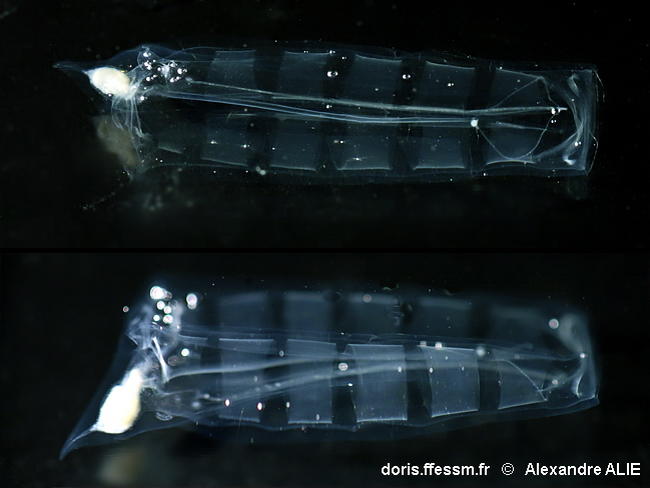

Oozoïde : description
L'oozoïde correspond à l'individu solitaire, en phase asexuée.
Sa taille va jusqu'à 81 mm. Il présente 6 larges bandes musculaires parallèles (la plus postérieure étant plus étroite et discrète que les autres).
La tunique est rigide et symétrique avec la partie antérieure (à droite sur l'image) plutôt rectangulaire et on peut distinguer une petite extension de chaque côté sur l'arrière de l'animal.
Echantillonné en baie de Villefranche-sur-Mer (06), Méditerranée, sur un trait vertical entre 0 et -75m
29/06/2018
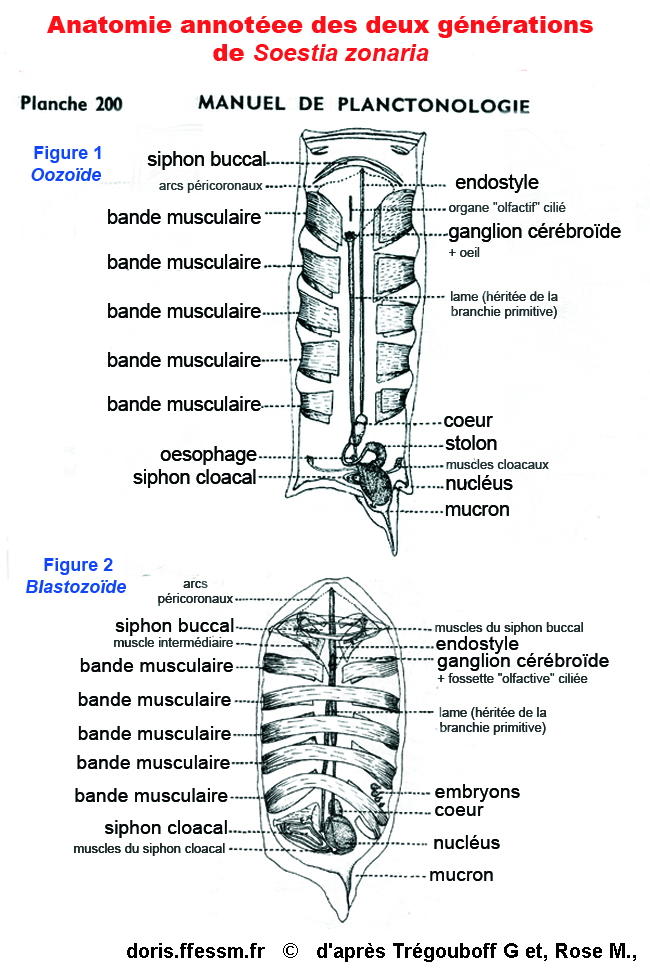
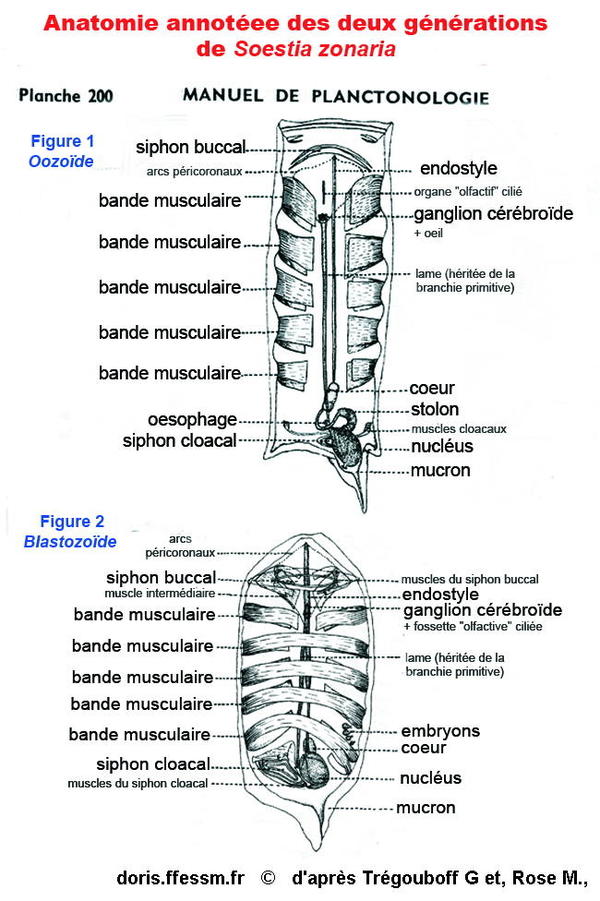
Anatomies internes durant les deux phases
Vue anatomique des deux générations de l'espèce.
Figure 1. phase asexuée (Oozoïdes). Notez la présence, en partie postérieure, du stolon, d'où vont bourgeonner les individus de la phase suivante. Une 6e bande musculaire, beaucoup plus étroite est généralement présente à hauteur du nucléus.
Figure 2. phase sexuée (Blastozoïdes). La localisation des embryons est marquée, qui donneront à terme les oozoïdes suivants. Sur ce schéma (2), les gonades, un ovaire et un testicule par individu, ne sont pas pointées (il y a déjà les embryons).
Planche 200, extraite de ; Trégouboff G., Rose M., 1957, MANUEL DE PLANCTONOLOGIE MEDITERRANEENNE, tome 2,
Annotations ajoutées
Reproduction de documents anciens
Alain-Pierre SITTLER
-
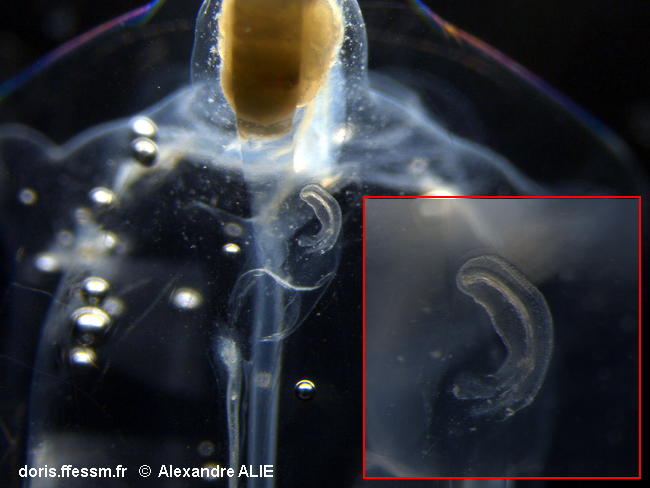
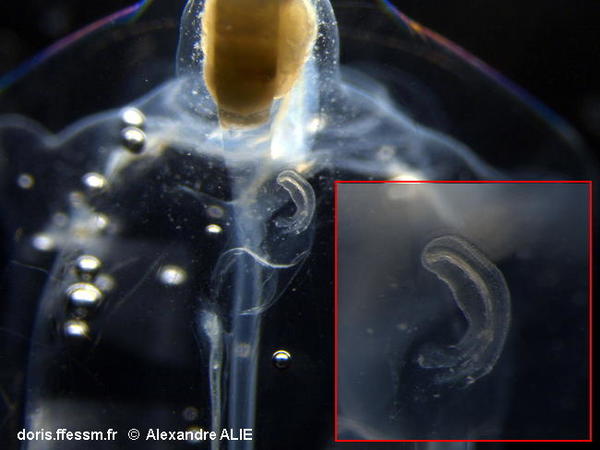
Stade précoce de croissance du stolon sur un oozoïde
On distingue ici, sous le nucléus jaune orangé, le départ du stolon (la petite pièce en croissant dans le cartouche de droite).
C'est ce stolon qui va se segmenter en plusieurs "bourgeons", qui deviendront les blastozoïdes, individus sexués accrochés les uns aux autres, en chaînes, et qui vont représenter la génération suivante.
Echantillonné en rade de Villefranche-sur-Mer (06), Méditerranée, sur un trait vertical entre 0 et -75m
29/06/2018


Partie postérieure d'un oozoïde
C'est dans la partie postérieure des salpes que l'on trouve le principal des organes vitaux, dans la région du nucléus.
Chez cet oozoïde, on constate également la présence de plusieurs amphipodes parasites ! Et d'un chétognathe à droite, dont on ne sait s'il est arrivé, lui, avec la salpe ou à la suite du traitement en laboratoire.
Animal collecté en baie de Villefranche-sur-mer (06), Méditerranée
29/06/2018


Biotope
Les plongeurs pourront rencontrer les salpes à larges bandes dans leurs zones d'évolutions respectives, souvent proche de la surface, comme cette chaîne coincée dans les algues par petit fond.
Soestia zonaria passe l’intégralité de son cycle de vie dans la colonne d’eau (espèce holoplanctonique). Elle est principalement épipélagique (entre la surface et 200 m environ) mais a également été observée à de grandes profondeurs de plus de 1000 m. Cette espèce effectue des migrations verticales nycthémérales, qui varient en amplitude selon les saisons.
Ouessant (22), océan Atlantique, 4 m
21/06/2020
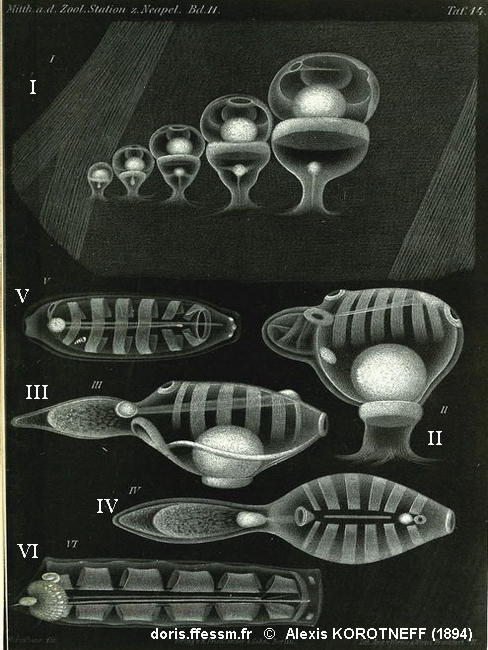
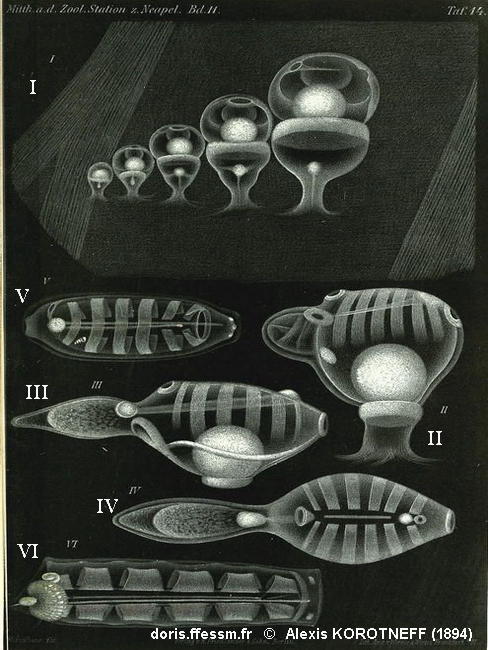
Développement embryonnaire de Soestia zonaria
Cette planche ancienne illustre les stades du développement embryonnaire de l'espèce (sous Iasis zonaria).
I : stades précoces de développement de l’embryon dans la cavité atriale de l’oozoïde. Le développement est interne et l’embryon est connecté à son oozoïde parent par un placenta (figuré par une boule blanche).
II – IV : stades successifs de croissance de l’oozoïde (encore un embryon, on reconnaît le placenta figuré par la grosse masse blanche, et l’ébauche de différents organes tels que les siphons et les bandes musculaires). IV est une vue dorsale de III.
V : blastozoïde dans lequel un embryon est visible (entre les deux bandes musculaires postérieures, en bas à gauche sur le dessin).
VI : oozoïde adulte portant un stolon postérieur enroulé autour du nucléus (à gauche sur le dessin).
Planche 14 extraite de : Korotneff A., 1894, Tunicatenstudien, Mitt. Zool. Stat. Neapel, 11, 325-367.
Reproduction de documents anciens
-


Très large distribution mondiale
La distribution de Soestia zonaria couvre à peu près toutes les mers et tous les océans, principalement dans les zones tempérées à chaudes mais pas uniquement. L'espèce a ainsi été largement rencontrée dans les océans Indien, Pacifique (comme la photo provenant de Hawaï) et Atlantique (comme cette image-ci), de 40° sud jusqu’aux environs du Groenland dans le nord.
On la rencontre également en mer Méditerranée (comme d'autres images de cette fiche provenant de la rade de Villefranche-sur-mer), en mer du Japon, en mer d’Arabie...
Les espèces planctoniques voyagent au gré des vents et des courants.
Ouessant (29), Bretagne, océan Atlantique, 4 m
21/06/2020
Rédacteur principal : Zazie BERNEZ
Rédacteur : Alexandre ALIÉ
Rédacteur : Léa BASTID-SOLINAS
Responsable régional : Alain-Pierre SITTLER
Damian-Serrano A., Walton K.A., Bishop-Perdue A., Bagoye S., Clos K.T.D., Gemmell B.J., Colin S.P., Costello J.H., Sutherland K.R., 2024, Colonial Architecture Modulates the Speed and Efficiency of Multi-Jet Swimming in Salp Colonies, bioRxiv, 31p.
Daponte M.C., Capitanio L.F., Machinandiarena L., Esnal G., 1993, Planktonic Tunicates (Chordata, Tunicata) Of The Rtma 'evrika' In The Southwestern Atlantic Ocean (1988), Iheringia Serie Zoologia, 74, 71-80.
Daponte M., Palmieri M., Casareto B., Esnal G., 2013, Reproduction and population structure of the salp Iasis zonaria (Pallas, 1774) in the southwestern Atlantic Ocean (34 30’ to 39 30’S) during three successive winters (1999-2001), Journal of Plankton Research, 35, 813-830.
Décima M., Stukel M.R., Nodder S.D., Gutiérrez-Rodríguez A., Selph K.E., Dos Santos A.L., Safi K., Kelly T.B., Deans F., Morales S.E., Baltar F., Latasa M., Gorbunov M.Y., Pinkerton M., 2023, Salp blooms drive strong increases in passive carbon export in the Southern Ocean, Nature Communication, 14(1), 425.
Gershwin L., Lewis M., Gowlett-Holmes K., Kloser R., 2014, The Pelagic Tunicates. In: Pelagic Invertebrates of South-Eastern Australia: A field reference guide, Version 1.1. CSIRO Marine and Atmospheric Research: Hobart.
Giachini Tosetto E., Barkokébas Silva B., García Díaz X. F., Neumann-Leitão S., Bertrand A., 2022, Thaliacean community responses to distinct thermohaline and circulation patterns in the western tropical South Atlantic Ocean, Hydrobiologia, 849, 4679–4692.
Kim S.W., Won J.H., Kim C.B., 2010, A New Record of Iasis zonaria (Salpida : Salpidae) in Korean Waters, Korean Journal of Systematic Zoology, 26, 161-163.
Lüskow F., Bahl A., Décima M., Steinberg D., Pakhomov E., 2024, Reproductive biology, elemental composition and diel vertical migration of the cosmopolitan warm-temperate pelagic tunicate Soestia zonaria, Journal of Plankton Research, 46, 72-85.
Sutherland K.R., Madin L.P., Stocker R., 2010, Filtration of submicrometer particles by pelagic tunicates, Proc Natl Acad Sci U S A., 107(34),15129-15134.
Thompson A.W., Nyerges G., Lamberson K.M., Sutherland K.R., 2024, Ubiquitous filter feeders shape open ocean microbial community structure and function, PNAS Nexus, 3(3), 1-11.
Yoon W.D., Kim S.K., Han K.N., 2001, Morphology and sinking velocities of fecal pellets of copepods, molluscan, euphausiid, and salp taxa in the northeastern tropical Atlantic, Mar.Biol.,139, 923–928.
----------
La page de Soestia zonaria dans l'Inventaire National du Patrimoine Naturel : INPN
Les textes et images sont sous licence et ne sont pas libres de droit.
Pour les ayants-droits, connectez-vous.
Pour toute demande d'utilisation (exemple d'un formateur Bio de la FFESSM...) contactez nous ici.